氮磷含量对微生物修复油污土壤的影响
2015-10-27孙万虹陈丽华徐红伟
孙万虹 陈丽华 徐红伟
(西北民族大学实验中心,兰州 730030)
氮磷含量对微生物修复油污土壤的影响
孙万虹 陈丽华 徐红伟
(西北民族大学实验中心,兰州 730030)
以甘肃西峰市油田附近土壤中的土著微生物为菌源,富集培养、筛选分离得到 5 种菌属的降解石油菌。通过向油污土壤中添加尿素、磷酸氢二铵的现场试验,历时63 d。研究了氮、磷含量在由5种菌制得的混合菌剂对油污的降解中的影响。结果表明,人为增加土壤中氮、磷元素对混合微生物菌剂修复油污土壤具有显著促进效果。在含油量1.5%和3%的污染土壤中,氮、磷元素的变化表现为两个阶段,前28 d氮、磷含量迅速减少,后35 d氮、磷含量变化表现出波动性,且在浓度为3%的污染土壤中,微生物菌剂的修复效果更为明显,最大降油率达到52.5%。利用GC-MS测定分析混合菌剂对石油主要成分藿烷的降解程度和演化规律的研究表明,混合菌剂对油污土壤中霍烷类化合物的降解均在80%以上,降解率较高,其中最高的是芒柄花根烷,达到86.3%.
微生物修复;油污土壤;氮磷含量;藿烷
石油是一种复杂的混合物,主要含多种烷烃类、芳香烃、脂环烃等及少量其他的非烃类物质[1]。在石油勘探、开采、加工、存储及运输过程中,不可避免地会使一些石油洒落地面,造成土壤污染。土壤受到石油烃污染后,其各方面性质会发生一定程度的改变。石油污染物会对土壤孔隙造成堵塞,使土壤的渗水量和透水性下降[2]。石油污染物还会改变土壤中有机质的碳氮比和碳磷比,从而引起土壤微生物群落、区系的变化,破坏整个土壤的微生态环境[3,4]。目前,治理油污土壤有多种方法,如焚烧法、固化法、热脱附法、洗涤法、溶剂萃取法、生物法等[5],而国内外研究和运用较多的处理技术是微生物修复和堆制处理。在堆置处理过程中配合投加高效原油降解菌和优良营养物能促进原油的去除[6-8]。生物法主要是采用微生物处理技术[9-13],即就地生物处理技术,利用微生物降解土壤中的原油等污染物,使其最终完全矿化。
影响油污土壤生物治理效率的因素很多,如微生物的种群构成和驯化、油的化学组成和浓度、环境温度及土壤酸碱度和盐度等都会影响微生物降解的效果。只有将这些因素控制好,才能在实际治理中获得预期的治理效率,而土壤中氮、磷的缺乏最可能成为微生物降解石油的限制因素[14]。研究结果表明,营养的不足或过量都会抑制微生物对有机污染物的生物降解,说明加入氮磷等营养物质的量并不是越多越好,存在一个经济合理的添加量及添加比例[15]。
本文在前期研究的基础上,以甘肃陇东地区含油土壤为菌源,以原油为唯一的碳源,经过富集、分离筛选出5株石油降解菌,将其制成混合菌剂投加到现场油污土壤中。通过向陇东地区油田所采的石油污染土壤中添加氮、磷等元素,测定混合菌剂对油污土壤中石油的降解率,研究氮、磷含量对石油降解的影响。并通过GC-MS测定分析混合菌剂在7 d对石油主要成分藿烷类化合物的降解程度。
1 材料与方法
1.1 混合菌剂降解油样
1.1.1 混合菌剂的筛选及制备 以甘肃陇东西峰市油田(西-27#原油)附近土壤中的土著微生物为菌源,以原油为唯一碳源进行筛选分离,得到高效石油降解菌。经大连宝生物工程有限公司鉴定分别为:A6菌株属于铜绿假单胞菌(Pseudomonas aeruginosa)菌属,D4菌株归属于蒙氏假单胞菌(P. monteilii)菌属,A5菌株属于鲁菲不动杆菌(Acinetobacter lwoffii)菌属,F1菌株属于黄色类诺卡氏菌(Nocardioides luteus)菌属,F2菌株属暗黑微绿链霉菌(Streptomyces atrovirens)菌属。
单个菌剂的培养采用的是三级扩大培养法,在37℃的恒温箱中培养24 h,经平板稀释法检查菌落数大于1×1010个/mL后,制成菌液;培养细菌用营养琼脂培养基,放线菌用改良高氏1号,霉菌用马丁培养基。
1.1.2 混合菌剂降解油样 将单菌菌液(按照A6+D4、A5、F1、F2菌的混合体积比约为5∶2∶2∶1配制)接入20 mL含10 mg原油的无机盐培养基的三角烧瓶,28℃摇床震荡培养7 d,取出加入氯仿10 mL,放入超声波仪器中破乳15 min,倒入滴液漏斗中萃取出氯仿相,如此反复3次,将萃取液收集一起,放入水浴中将氯仿蒸发殆尽,剩下的残油准确称量后用正己烷(色谱纯)定容至10 mL,即为GS-MC测试降解油样。同时不添加混合菌剂设置对照组。
1.1.3 氮磷元素添加剂及膨松剂 用农用尿素、磷酸氢二铵分别作为氮、磷元素的添加剂;用木材加工厂生产过程中产生的锯末,经四十目筛筛选后作为膨松剂。
1.2 方法
1.2.1 GC-MS分析条件及藿烷含量测定 GC-MS(Angilent 7890A/5975C)载气为氦气,流速1.0 mL/min;DB-5MS毛细管柱(30.0 m×0.25 mm×0.25 μm),分流进样,分流比10∶1,进样量1 μL;尾吹流量10.0 mL/min;进样口温度250℃,离子源温度230℃;柱温采用程序升温,初温40℃,保持8 min,在以10℃/min升至220℃,保持17 min,再以10℃/min升至290℃,保持10 min;离子化方程(EI),离子化能量70 eV。质谱全扫描定性,扫描范围:45-500 amu。
石油中藿烷类化合物的测定参照《环境中石油污染物的分析技术》(1987)中的氧化铝层析柱法[16],分离石油中的藿烷类化合物,用GC-MS解析藿烷各组分物质,用质量归一法计算出样品中藿烷各种化合物的含量。石油中藿烷类的降解率R计算方法如下:藿烷类化合物的降解率=(M1-Mi)/M1
式中:M1为第1天土壤中藿烷类物质含量(mg·kg-1);Mi为第i天土壤中藿烷类物质含量(mg·kg-1)。
1.2.2 油泥中微生物数量分析 土壤中微生物数量测定采用稀释涂布平板计数法(CFU)[17],微生物数量是土壤中细菌、真菌和放线菌数量之和。微生物计数选用培养基为牛肉膏蛋白胨培养基、查氏培养基和高氏一号培养基,分别用于细菌、真菌和放线菌的计数。测定方法:称取10 g鲜土样置于已灭菌的装有玻璃珠的三角瓶中,加入90 mL无菌水,振荡10 min使土样分散成为均匀的土壤悬液,对土壤悬液进行梯度稀释,取合适的稀释度涂平板,一般好氧异养细菌采用10-4-10-6,放线菌采用10-3-10-5,真菌采用10-1-10-3稀释度。将涂布均匀的平板倒置于30℃培养一定时间(细菌1-2 d,放线菌4-5 d,真菌3-4 d),进行CFU计数。
1.2.3 油污土壤中含油量测定 土壤中石油类物质的测定采用紫外分光光度法[18]。用索式提取法提取土壤中石油类物质,在紫外分光光度计下测出相对应的吸光度,计算每千克干土中石油类物质含量。
1.2.4 土壤中总氮的测定方法 参照土壤全氮测定法(GB 7173-1987)。用浓硫酸消化分解,以甲基红-溴甲酚绿为指示剂,用标准盐酸滴定至粉红色为终点,根据盐酸的用量,求出分析样品中的含氮量。
1.2.5 土壤中有效磷的测定方法 参照石灰性土壤有效磷测定方法(GB 12297-1990)。用0.5 mol/L的NaHCO3作为浸没剂处理土壤,在一定的酸度下,用硫酸钼锑抗还原显色成磷钼蓝,通过分光光度计测定其浓度。
1.2.6 油污土壤现场修复设计 在西峰27#油井旁的一块试验田进行现场试验。试验田的面积为2×3 m2,深度为30 cm。首先将试验田中土壤进行翻耕,边翻耕边按土量的8.3%添加锯末。混合均匀后将试验田分为1.5%浓度和3%浓度两块区域。然后向1.5%浓度区和3%浓度区分别添加原油1.5 L和3 L,再按照C∶N∶P=100∶10∶1调整土壤中N、P的含量,向1.5%浓度区添加尿素3.36 kg,磷酸氢二铵0.70 kg;向3%浓度区添加6.73 kg,磷酸氢二铵1.47 kg,充分混合。最后投加40 L的混合菌剂。
将两区域各均匀划分为6块小区域,再从两个区域中各随机预选3块小区域编号为1、2、3区进行试验。按0、7、14、28、21、28、35、49、63 d从试验田中分别取土样,晾干后进行油含量和氮磷含量的测定。现场试验中,在第28天补充过一次氮磷,向低浓度区添加尿素0.50 kg,磷酸氢二铵0.10 kg;向高浓度区添加1.00 kg,磷酸氢二铵0.20 kg。
2 结果
2.1 土壤理化特征
自西峰27#油区6个典型油泥收集点,采集4.770 kg的油污土壤,以及未受污染的背景土壤样品18个,测定其矿物油、有效磷、总氮、速效钾、有机质、pH、干物质重量(含水率)、电导率、含油量及石油组分。测定结果如表1和图1所示。
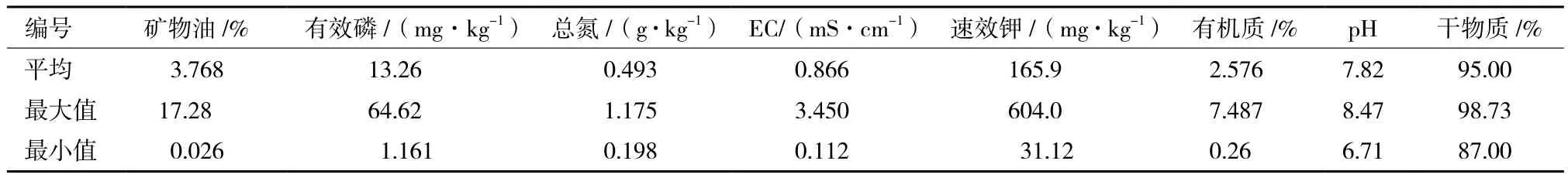
表1 背景土壤基本信息
由于油田散布于黄土塬农业区中,土壤中速效钾是肥力的重要表征参数,总氮、有效磷、有机质既是土壤肥力表征参数,又是油污土壤微生物降解所需氮源、磷源、碳源的背景土壤。从背景土壤理化值可以看出,陇东油区土壤含水率较低(小于5%);pH在7.8 左右,为弱碱性,有利于微生物降解;总氮量较低,平均为0.493 g/kg,有机质含量低,平均2.6%左右,土壤较为贫瘠;有效磷、速效钾由于人工施肥背景值比荒地的高,但远低于微生物降解所需要的氮磷含量;电导率普遍小于1 mS/cm,表现出土壤盐度低的特点。
从图1可以看出,速效钾、有效磷的含量随含油率变化并未呈现明显的线性关系,可以说速效钾、有效磷的含量与含油率的大小关系不明显。图中含油土样有效磷含量最小值为1.16 mg/kg,最大值为64.62 mg/kg,相差有近56倍,而其对应的含油率为5.61%和3.97%,相差不到两倍。同样含油土样速效钾含量最小值为31.12 mg/kg,最大值为604.01 mg/kg,相差有近20倍,而其对应的含油率为6.47%和3.97%,变化也不到两倍。从图中可以明显地看出,速效钾与有效磷含量的变化呈现出同增同减,具有较强的同步性。

图1 速效钾和有效磷含量与含油率变化关系
2.2 不同石油浓度土壤的现场修复效果及微生物变化的关系
不同浓度实验区微生物数量和降解幅度之间的关系如图2所示。高低浓度区(3%)微生物总数变化以35 d为界,在此之前,低浓度区(1.5%)微生物总数高于高浓度区,之后高浓度区的微生物总数大于低浓度区。这与第28天时对高浓度区进行了营养物质的补充和菌剂的补加有关,说明低浓度石油烃刺激了土壤中微生物的活动,表现为数量增加,以降解外来污染物保持原有的平衡[19]。当石油浓度为某一浓度范围时,微生物数量和降解率会维持在较高的水平;当石油浓度过高时,一些对微生物生长代谢具有毒性或抑制作用物质的浓度达到阈值时就会大大抑制微生物的生长代谢,甚至会杀死微生物细胞,最终影响石油降解[20]。另外,高浓度的石油也会影响培养基的溶氧速度,使微生物缺氧,对营养盐的利用也产生阻碍作用,从而影响了微生物的生长产生抑制作用。由此可见,油质量浓度对微生物降解石油烃有明显的影响。
微生物对油污土壤的降解率随微生物数量变化呈现出相似变化趋势,在前两周降解率高,降解幅度达到32.86%,第3周降解幅度逐渐降低至8.33%,在35 d左右降解率提高,降解幅度增加为17%后降解率呈下降趋势,降至2.06%,可见微生物数量跟降解率成正比。后期降解率趋于平缓可能跟培养时间有关系。另外微生物对不同类型石油烃的降解能力不同,则各类石油烃被微生物降解的速率存在一定的差异[21]。
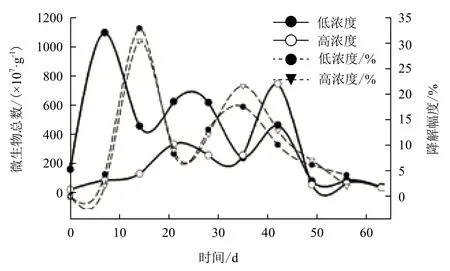
图2 微生物数量与降解幅度之间的关系
2.3 氮、磷含量对降解油污土壤的影响
氮磷含量和降油率随时间变化情况如图3所示。降油率随着氮、磷的降低而增加,氮磷含量的变化与降油率存在反比关系。氮、磷含量消耗的非常迅速。仅在第一个试验周期,1.5%和3%两个浓度区的氮消耗率都较大,而磷含量的变化相对较小,充分说明微生物菌剂对氮元素的需求量远大于对磷的需求量。氮消耗相对较小的另一个原因在于:试验田区第一周并未降雨和人工灌溉,致使磷的损失很少,而氮的挥发损失较多,致使氮消耗量比磷大。而在前28 d,土壤中的油含量迅速减少,在28 d达到最低值,降油率达到最大,之后进入一个波动期。这说明在1.5%和3%的油污土壤中按C∶N∶P=100∶10∶1添加氮磷元素,对微生物修复作用的促进效果非常明显。可能是混合菌剂在有充足的氮、磷来源时,降油能力明显提升,能迅速大量地分解土壤中的石油,同时土壤中碳、氮、磷等元素因大量消耗而减少。
从图3中也可以明显看出,3%浓度区氮含量的消耗速率远大于1.5%浓度区,这可能是3%浓度区尿素和磷酸氢二铵的添加量比1.5%浓度区大,致使挥发损失量相对较大。在试验的第35天,氮、磷含量变化进入一个新的消耗阶段,此阶段氮、磷的消耗速率比前28 d小且呈现出很大波动性。产生这种情况的可能原因是,代谢产物大量积累对微生物菌体产生毒害致使部分微生物死亡,而被微生物所固定的氮、磷元素重新释放到土壤中。
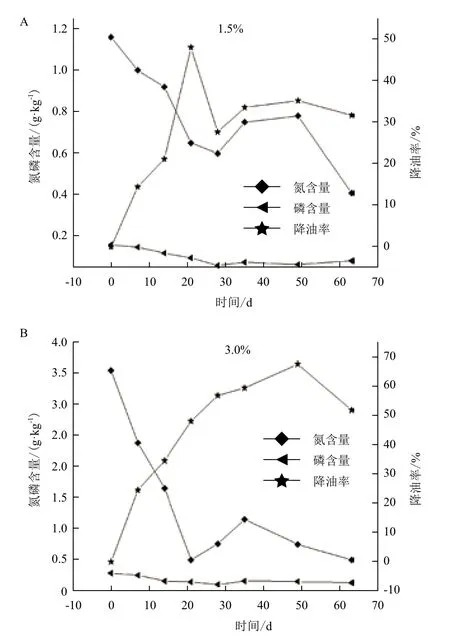
图3 氮磷含量与降油率变化关系图
2.4 混合菌剂对藿烷降解特性
石油是以链烷烃、环烷烃、芳香烃以及少量非烃类化合物为主要成分的复杂混合物。微生物降解就是微生物利用石油烃类作为碳源和能源,经过一系列氧化、还原、分解、合成等生化作用,将石油污染物最终矿化转变为无害的CO2和H2O的过程。藿烷类化合物是石油中常见的生物标志物。藿烷不是由生物体直接合成,而是由死亡生物体经地球化学过程演化而来。在成岩过程中藿烷类化合物由生物构型(R型)逐渐转变为地质构型(S型),最后达到S型与R型的平衡状态[S/(S+R)=0.6]。
以原油为唯一碳源和能源,经混合菌剂对其进行 7 d 的培养基降解,藿烷降解情况如图4所示。对图4的GC-MS数据进行整理,结果如图5所示,混合菌剂对油污土壤中藿烷类化合物的降解率都在80%以上,降解幅度较高,说明藿烷的手性碳向稳定构型S型转化。混合菌剂降解率最高的是芒柄花根烷,降解率高达86.3%。而对γ-蜡烷、17α(H)21β(H)-22S-31,32-二升藿烷、17α(H)21β(H)-22R-31,32-二 升 藿 烷、17α(H)21β(H)-22S-31,32,33-三升藿烷、17α(H)21β(H)-22R-31,32,33-三升藿烷、17α(H)21β(H)-22S-31,32,33,34-四升藿烷、17α(H)21β(H)-22S-31,32,33,34,35-五升藿烷的降解率都在85%以上。可见在合适的氮磷配比下,该混合菌剂对油污土壤中的藿烷类化合物降解率较高,原油和混合菌剂作用7 d的原油的藿烷系列碳数分布相同均为C27-C35(C28缺失),主峰相同均为C30-αβ藿烷。由表3可以看出,原始油样C31-αβ-22S/22(S+R)和C32αβ-22S/22(S+R)比值分别为0.591和0.577,接近转化终点值0.600,所以原石油样为成熟质,受外力作用变化不会很大。经混合菌7 d降解后样品的C31-αβ-22S/22(S+R)和C32αβ-22S/22(S+R)比值均大于原始油样值,说明混合菌剂能促使五环三萜类化合物的手性碳R构型向更稳定的S构型转化,短期内就可以达到转化终点。
w(Ts)/w(Tm)比值是石油地质领域常用的有机质演化程度参数,Ts为18α(H)22,29,30三降藿烷,Tm为17α(H)22,29,30三降藿烷。在生物体原生质中只有Tm构型而没有Ts构型,当这类生物进入地质体后,在热、微生物、压力及矿物催化作用下三降藿烷将由Tm立体构型逐渐向更稳定的 Ts 立体构型转化,因而w(Ts)/w(Tm)比值越大既反映了有机质受外作用力的程度越强。而在实验中通过添加菌剂提供外作用力,可见w(Ts)/w(Tm)比值越大则说明菌剂对有机质的降解越强烈。

图4 降解后藿烷离子流图

图5 混合菌剂降解油样藿烷组分及降解率
3 讨论
从背景土壤理化特性可以看出,陇东黄土原油区土壤以黄绵土为主,土壤中石英的含量最大,约为37%-57%,透水性强,有机质含量低。由于油田作业区许多分散在农业用地上,油污土壤人为施加过氮、磷等肥料,土样中氮、磷含量相对较高,且同一样品中的速效钾、有效磷含量具有很强的一致性;有机质含量在整体趋势上随含油率的增大而增大。
对1.5%和3%两个不同浓度区油污土壤进行对比分析研究表明,按C∶N∶P=100∶10∶1添加氮、磷元素后,1.5%浓度区石油降解达到最大值的时间短,且降解效果不佳,在第3周便达到降油率的最大值,降解率最大为49.35%。而3%浓度区试验降解率达到最大值的时间分别为28 d、49 d和49 d,降解率最大为73.29%。这说明按C∶N∶P=100∶10∶1添加氮、磷元素能延长微生物对石油降解的时间,且对3%浓度区石油的降解比1.5%浓度区石油的降解促进效果更为明显。
在两个不同浓度区油污土壤中,氮、磷含量变化趋势基本一致,存在个别差异的可能原因有:(1)使微生物菌剂能够及时利用的氮、磷含量稍有不同;(2)土壤的湿度、土壤空隙的饱和度、pH等因素对微生物的活性影响不同,从而使利用氮、磷元素的效率存在差异;(3)各试验组氮、磷损失存在细微差异。
从混合菌剂对藿烷的降解参数可以看出,混合菌剂降解石油的w(Ts)/w(Tm)比值大于原始油样的值,表明该混合菌剂可促使五环三萜类化合物立体不稳定构型向稳定性构型转化。且菌剂在短期内对藿烷的降解就较明显。从表3中w(∑藿烷)/w(∑正构烷烃)比值可看出,混合菌剂的比值明显小于原始油样的0.394,表明混合菌剂作用原油时藿烷的降解速率明显大于正构烷烃系列。

表3 藿烷降解组分演化分析
4 结论
对含油量为1.5%和3%左右的油污土壤63 d微生物修复过程中,氮、磷元素的变化以28 d为界限存在两个明显的阶段,前28 d氮、磷含量迅速减少,后35 d氮、磷含量变化表现出波动性。
不同浓度实验区微生物总数变化以35 d为界,35 d之前,低浓度区微生物总数高于高浓度区,而之后高浓度区的微生物总数大于低浓度区。降解幅度随时间的变化规律微生物总数的变化规律相一致。
西峰长庆油田区油污土壤中氮、磷含量水平很低,不利于微生物修复。按C∶N∶P=100∶10∶1人为添加氮、磷物质对混合微生物菌剂修复石油污染的土壤促进效果明显,高低浓度区最大降油率平均分别达到52.5%和33.44%,因此,人为添加氮、磷物质对高浓度的油泥的微生物修复效果促进作用更为明显。
混合菌剂对油污土壤中藿烷类化合物的降解均在80%以上,降解率较高,其中最高的是芒柄花根烷,达到86.3%;w(Ts)/w(Tm)比值说明藿烷的降解表现出手性碳由R型向稳定构型S型转化的特征。w(∑藿烷)/w(∑正构烷烃)比值可看出,混合菌剂的比值明显小于原始油样的0.394,表明混合菌剂对藿烷的降解速率较快。
[1] Nadim F, Hoag GE, Liu S, et al. Detection and remediation of soil and aquifer systems contaminated with petroleum products:an overview[J]. Journal of Petroleum Science and Engineering, 2000,(26):169-178.
[2] 程金香, 马俊杰, 王伯铎, 等. 石油开发工程生态环境影响分析与评价[J]. 环境科学与技术, 2004, 27(6):64-65.
[3] Akio U, Yukiya I. Isolation and characterization of bacteria from oil contaminated with diesel oil and the possible use of these in autochthonous bioaugmentation[J]. World Journal of Microbiology & Biotechnology, 2007, 23:1739-1745.
[4] 张秀霞, 郑茂盛, 王荣靖, 等. 石油污染土壤中高效石油烃降解菌Y-16的筛选及其降解性能[J]. 环境工程学报, 2010, 4:1916-1920.
[5] 曾玲玲, 刘德福, 张兴梅. 石油污染土壤的微生物治理研究进展[J]. 生物技术通报, 2006(6):48-51.
[6] Alejandro RG, Mar AC, Ferre RO, et al. Bioremediation of crude oil polluted seawater by a hydrocarbon degrading bacterial strain immobilized on chitin and chitosan flakes[J]. International Biodete rioration & Biodegradation, 2006, 57(4):222-228.
[7] 欧阳威, 刘红, 于勇勇, 等. 微生物强化处理与堆制强化处理含油污泥对比试验[J]. 环境科学, 2006, 27(1):160-164.
[8] Jorgensen KS, Puustinen J, Suortti AM. Bioremediation of petroleum hydrocarbon contaminated soil by composting in biopiles[J]. Environmental Pollution, 2000, 107(2):245-254.
[9] 齐建超, 张承东, 乔俊. 微生物与有机肥混合剂修复石油污染土壤的研究[J]. 农业环境科学学报, 2010, 29(1):66-72.
[10] 陈丽华, 马金珠, 雒晓芳, 等. 添加复合菌剂对石油污染土壤的降解研究[J]. 中南大学学报:自然科学版, 2012, 43(11):4581-4589.
[11] 张海荣, 李培军, 孙铁珩, 等. 四种石油污染土壤生物修复技术研究[J]. 农业环境保护, 2001, 20(2):78-80.
[12] 胡晓芳, 夏福军, 朱南文, 等. 原油污染土壤的生物法修复效果研究[J]. 环境化学, 2006, 25(9):593-597.
[13] 胥九兵, 迟建国, 邱维忠, 等. 微生物菌剂对石油污染土壤的修复研究[J]. 环境工程学报, 2011, 5(6):1414-1418.
[14] 许超, 夏北成. 土壤多环芳烃污染根际修复研究进展[J]. 生态环境, 2007, 16(1):216-222.
[15] 孙清, 陆秀君, 梁成华. 土壤的石油污染研究进展[J]. 沈阳农业大学学报, 2002, 33(5):390-393.
[16] Woo DJ, Lee TK, Lee JW, et al. Novel U-slot and V-slot DGSs for bandstop filter with improved Q factor[J]. IEEE Trans Microw Theory Tech, 2006, 54(6):2840-2847.
[17] 李洪梅, 郜玉环, 江丽华, 等. 不同浓度石油烃对油菜产量、土壤中石油烃残留量及土壤微生物的影响[J]. 中国农学通报,2010, 26(17):382-385.
[18] 孙寓姣, 郝旭光, 王红旗. 不同温度下石油污染土壤中石油降解菌群的实验研究[J]. 石油学报, 2010, 26(1):87-92.
[19] Joseph GL, Colwell RR. Microbiol degradat ion of hydrocarbons in the environment[J]. Micrb Rew, 1990, 54(3):305-315.
[20] 张丽莉, 陈利军, 刘桂芬, 等. 污染土壤的酶学修复研究进展[J]. 应用生态学报, 2003, 14(12):2342-2346.
[21] Palmroth MRT, Langwaldt JH, Aunola TA, et al. Effect of modified Fenton’s reaction on microbial activity and removal of PAHs in creosote oil contaminated soil[J]. Biodegradation, 2006, 17(2):131-141.
(责任编辑 李楠)
Effects of Nitrogen and Phosphorus Contents on the Oil Degradation Rate
Sun Wanhong Chen Lihua Xu Hongwei
(Experimental Center of Northwest University for Nationalities,Lanzhou 730030)
Five oil-degradation bacterial strains were cultured, isolated and screened from soil at Xifeng Oilfield of Gansu Province,northwestern China. On-site experiments by adding different levels of urea and ammonium dibasic phosphate to oil-contaminated soil lasted 63 d, the effects of nitrogen and phosphorus contents on the oil degradation rate by mixed bacterial agent from 5 strains were investigated. The results reveal that nitrogen and phosphorus contents in oil-contaminated soil of Xifeng Oilfield are in low level, and it is not conducive for bioremediation;however, artificially adding a certain amount of nitrogen and phosphorus for bioremediation of oil-contaminated soil with mixed bacterial agent have significant promoting effects. The changes of nitrogen and phosphorus show two stages in the 63 d microbial remediation process for 1. 5% and 3% oil-contaminated soil:the contents of nitrogen and phosphorus decrease rapidly in the first stage(0-28 d);while they fluctuate after 35 d. The microbial remediation effect for the 3% oil-contaminated soil is obvious, and the maximum oil-degradation rate reaches 52. 5%. GS-MC was used to measure and analyze the degradation rate and evolution pattern of mixed bacterial agent for hopane - the major constituent of oil. The results show that, in the optimal ratio of nitrogen to phosphorus, the degradation rate of mixed bacterial agent for hopane-like compounds in the oil-contaminated soil is over 80%, the highest degradation rate(86. 3%)for onocerane.
microbial remediation;oil-contaminated soil;nitrogen and phosphorus content;hopane
10.13560/j.cnki.biotech.bull.1985.2015.06.025
2014-08-28
国家自然基金项目(41361070),中石油长庆油田分公司项目(14AQ-KF-011),2014年甘肃省自然科学基金项目(145RJZA224),2013年西北民族大学创新团队项目资助
孙万虹,女,博士,副教授,研究方向:土壤石油污染机理与修复;E-mail:sunwh2004@126.com
陈丽华,女,博士,教授,研究方向:土壤石油污染机理与修复;E-mail:clh@xbmu.edu.cn
