大肠杆菌表达托佩克猪SLA-1胞外区的研究
2015-10-26翟晓鑫张秀娟杨杰高凤山
翟晓鑫 张秀娟 杨杰 高凤山
(大连大学生命科学与技术学院,大连 116622)
大肠杆菌表达托佩克猪SLA-1胞外区的研究
翟晓鑫 张秀娟 杨杰 高凤山
(大连大学生命科学与技术学院,大连 116622)
为构建托佩克猪SLA-1重链基因原核重组表达载体并研究其在pET-21a(+)中的表达,设计引物,PCR扩增托佩克猪SLA-1基因胞外区(命名为SLA-1-TPKe),并克隆至pMD19-T Simple Vector,经酶切鉴定后将SLA-1-TPKe基因与表达系统pET-21a(+)连接,转化到BL21(Rosseta)菌进行诱导表达,SDS-PAGE检测目的蛋白。提取SLA-1-TPKe包涵体,并经SDSPAGE检测。PCR结果显示,SLA-1-TPKe大小为851 bp,成功克隆到pMD19-T Simple Vector,酶切鉴定大小为831 bp,连接到pET-21a(+)并转化到BL21(Rosseta)菌,经诱导表达和SDS-PAGE检测目的蛋白的大小为31 kD。目的蛋白以包涵体形式存在,纯化后蛋白纯度达到90%以上。
托佩克猪;SLA-1;重链基因;表达;包涵体
SLA-1属于猪白细胞抗原(swine leukocyte antigen,SLA),亦称为猪主要组织相容性复合体(major histocompatibility complex,MHC)I类分子重链的功能基因,是重要的免疫应答基因群,分为SLA-I、SLA-II和SLA-III三类分子[1,2]。SLA-I类分子分为重链和轻链,重链分子含有3个功能基因,分别称为SLA-1、SLA-2和SLA-3。轻链分子只有一个等位基因β2m。重链与轻链非共价结合构成SLA-I类分子,在体内结合和递呈抗原表位[3-6]。在3个SLA-I类分子功能基因中,SLA-1基因多态性最强,目前已经可查到的SLA-1等位基因序列达到140多个,高于SLA-2和SLA-3,推测SLA-1在SLA-I类分子中利用率可能高于其他两个功能基因[7]。而事实证明,动物MHC I类分子的重链、多肽及轻链的结合不仅在体内可以进行,在体外也可以完成[8]。本试验所用托佩克猪是世界第二大种猪公司荷兰国际种猪公司在20世纪60年代培育的品系,该品系猪生长快、抗病力强、遗传性能稳定,是目前欧美“当家”猪种[9]。目前,该品系猪已经在国内大量饲养,其相关的基因表达研究等正在国内外展开[10,11]。本课题组已经克隆了多个国内外品系猪的SLA-1等位基因,包括托佩克猪。托佩克猪是我国目前引进的主要饲养品系,研究该品系猪SLA-1的结构和功能对于今后制定针对性的疾病防治策略及种间遗传育种具有指导意义。本研究拟在前期研究的基础上,选取托佩克猪的SLA-1等位基因,构建其pET-21a(+)的原核表达载体,并获得表达蛋白,旨在为今后对托佩克猪SLA-1的晶体结构解析、多肽结合等研究奠定基础。
1 材料与方法
1.1 材料
重组质粒SLA-1-TPK/pMD19-T simple为大连大学分子免疫实验室构建并保存,表达载体pET-21a(+)及菌株 Escherichia coli BL21(Rosseta)来自于中国科学院微生物研究所;Escherichia coli Top10菌株为大连大学分子免疫学实验室保存。克隆载体 pMD19-T Simple Vector购自大连宝生物公司。
限制性内切酶XhoⅠ和NdeⅠ、PCR扩增酶Ex Taq、连接酶T4 DNA Ligase、低分子量蛋白Marker、DL2000 DNA Marker均购买自大连宝生物公司;SanPrep柱式DNA胶回收试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒、IPTG、胰化蛋白胨、甘氨酸酵母提取物、NaCl、琼脂粉、过硫酸铵、二甲基甲叉双丙烯酰胺、TEMED、三羟甲基氨基甲烷等购自上海生工。
1.2 方法
1.2.1 引物的设计 托佩克猪SLA-1基因胞外区表达引物设计pTPK21F-SLA-1-T:5'-GGGAATTCCAT ATGGGCCCGCATTCTCTGAGCCATTTC-3';pHB21RSLA-1-276:5'-AGTCTCGAGTTAAGGGTCCCATCTCA GGGTGAGG-3'。
1.2.2 SLA-1-TPKe基因的亚克隆 以重组质粒SLA-1-TPK/pMD19-T simple为模板,以pTPK21F-SLA-1-T/pHB21R-SLA-1-276为引物对,扩增基因链SLA-1-TPKe,PCR扩增条件为:94℃ 3 min;94℃ 45 s,68℃ 30 s,72℃ 45 s,33个循环;72℃延伸10 min。PCR结束后将产物进行核酸电泳,电泳完毕后使用凝胶成像系统检测PCR产物,最后使用SanPrep柱式DNA胶回收试剂盒回收PCR产物[12]。
SLA-1-TPKe回收产物连接pMD19-T Simple并转化大肠杆菌Top10,37℃过夜培养,通过SanPrep柱式质粒DNA小量抽提试剂盒抽提质粒,酶切筛选阳性克隆菌种,送至生工生物公司进行测序。
1.2.3 表达载体的构建 将筛选的阳性克隆菌抽提质粒,然后用NdeⅠ、XhoⅠ对其进行双酶切,酶切后通过凝胶纯化回收SLA-1-TPKe基因,然后与表达载体pET-21a(+)连接,转化至感受态细胞BL21(Rosseta),涂布到含氨苄霉素的平板中,37℃过夜培养,挑选菌落至新鲜LB培养基,过夜培养后抽提质粒,然后用NdeⅠ、XhoⅠ对其进行双酶切筛选阳性质粒,并命名为pET-21a(+)/SLA-1-TPKe(图1),送生物公司测序。
1.2.4 SDS-PAGE检测SLA-1-TPKe蛋白表达 将阳性重组菌种100 μL接种5 mL LB液体培养基,37℃,170 r/min震荡培养至OD600达0.4-0.6之间,加入IPTG 至终浓度达到1 mmol/L,37℃,170 r/min,诱导5 h后,取菌液1 mL,12 000 r/min,2 min,去上清,菌体经TE溶解并经5×SDS样品buffer处理,SDS-PAGE测蛋白表达[13]。
1.2.5 SLA-1-TPKe包涵体的提取 表达后的SLA-1-TPKe重组菌按1%比例接种后扩大培养,相同方法诱导表达,6 000 r/min离心收集菌体,洗涤后采用超声波冰浴破碎,6 000 r/min离心后,进行SDSPAGE电泳,并保存包涵体。
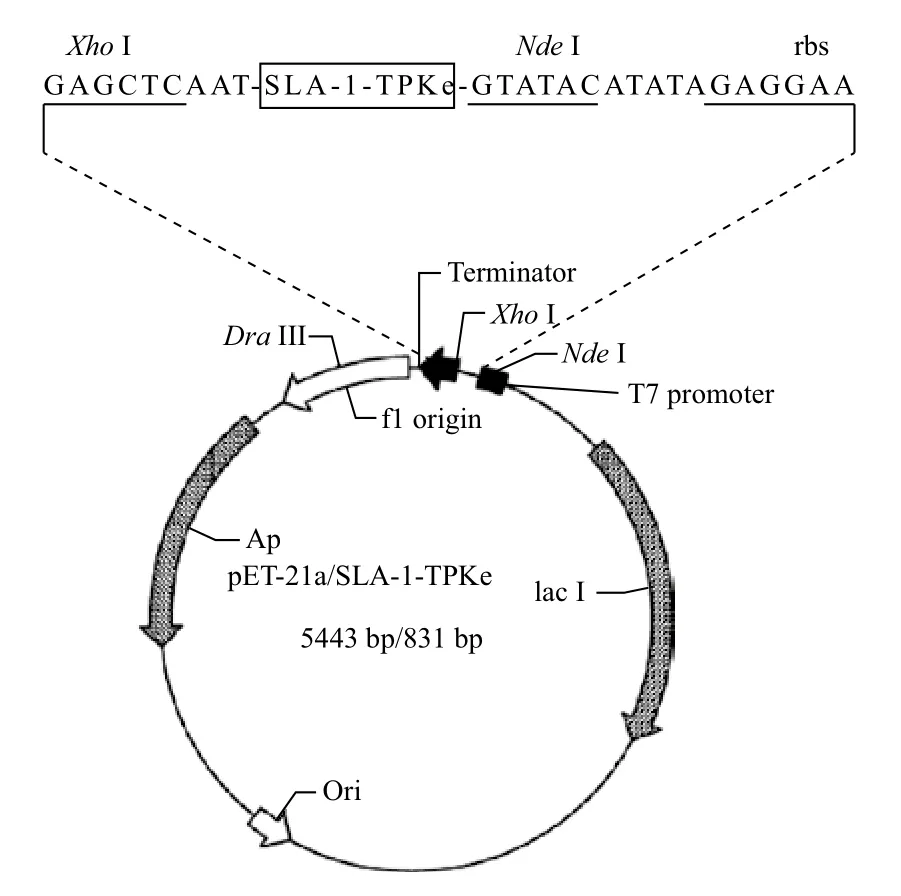
图1 SLA-1-TPKe表达载体的构建
2 结果
2.1 SLA-1-TPKe基因的扩增
经PCR和琼脂糖电泳检测到一条约850 bp的条带(图2),与理论设计值851 bp相符。
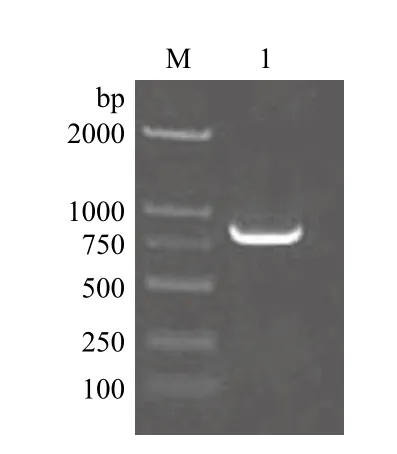
图2 SLA-1-TPKe的PCR扩增结果
2.2 SLA-1-TPKe基因亚克隆到pMD19-T Simple Vector
经连接转化后,挑取单菌落培养,提取质粒,用Nde I、Xho I进行双酶切,电泳显示插入片段约为850 bp左右的条带(图3),与理论设计值831 bp大小相符。
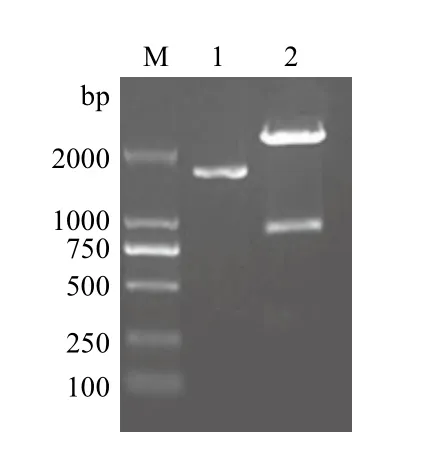
图3 pMD19-T Simple Vector/ SLA-1-TPKe重组质粒双酶切鉴定
2.3 SLA-1-TPK基因亚克隆到pET-21a(+)
将与pMD19-T Simple载体连接的重组质粒双酶切,回收目的片段后与 pET-21a(+)连接,转化至感受态细胞BL21(Rosseta),再经双酶切鉴定发现插入片段大小为830 bp左右(图4),与理论值831 bp相符。
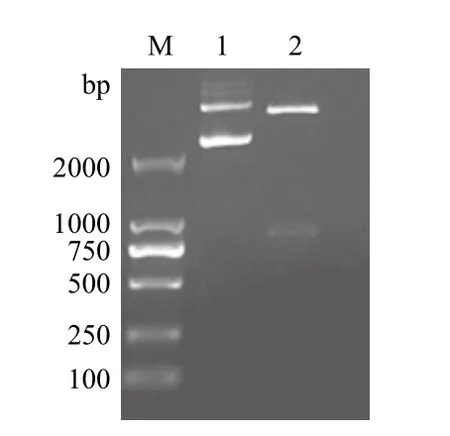
图4 重组质粒pET-21a(+)/SLA-1-TPKe双酶切鉴定
2.4 序列分析pET-21a(+)/SLA-1-TPK
经序列测定分析,pET-21a(+)/SLA-1-TPKe编码的氨基酸序列与原序列100%同源(图5)。
2.5 SDS-PAGE分析pET-21a(+)/SLA-1-TPK中的表达
将鉴定阳性的重组表达菌再经IPTG诱导,SDSPAGE检测目的基因的表达,结果(图6)显示重组菌表达出一条约30 kD的蛋白,与目的蛋白理论值31 kD相符。
2.6 SLA-1-TPKe包涵体提取
SDS-PAGE检测包涵体蛋白,发现包涵体蛋白的大小约30 kD,与目的蛋白大小一致,而且在包涵体提取过程中,去除了大部分杂蛋白,目的蛋白得到了纯化(图7)。
3 讨论
托佩克猪是来自于荷兰20世纪60年代培育的优质高产品系,目前该品系猪已经在我国广泛饲养。然而,对于该品系猪的基因资源了解的不多,尤其是涉及到与免疫应答有关的基因,如SLA-I类分子,对这些基因的研究将有利于针对该品系猪制定科学的免疫治疗手段和策略。SLA-I类分子包括3个功能基因,SLA-1、SLA-2和SLA-3。其中SLA-1基因的多态性比较丰富,目前对其研究报道较多。然而,目前国内还没有展开对托佩克猪SLA-1的报道研究。

图5 亚克隆SLA-1-TPKe及序列分析
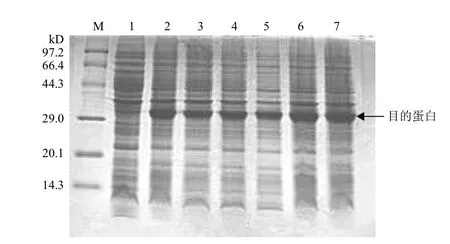
图6 SDS-PAGE分析pET-21a(+)/SLA-1-TPKe中的表达
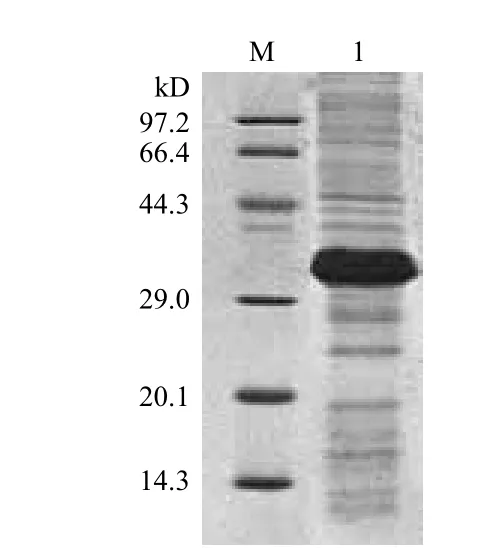
图7 SDS-PAGE检测pET-21a(+)/SLA-1-TPKe包涵体
SLA-1基因表达的重链可以与抗原肽及轻链β2m组成复合体,然后经过高尔基体加工后被递呈到细胞表面与CD8+T细胞的TCR结合,刺激CD8+T细胞活化,分泌细胞因子,从而杀死被感染的靶细胞[14]。而事实证明,动物MHC I类分子的重链、多肽及轻链的结合不仅可以在体内进行,在体外也可以完成[15]。在体外研究MHC I类分子表达时,为了提高表达效果,一般要去掉信号肽及胞内区,而集中选择胞外区,因为只有胞外区涉及到多肽结合等功能。
本研究以托佩克猪的SLA-1基因胞外区为研究对象,构建了原核重组表达载体并获得表达蛋白,旨在为今后研究SLA-1分子与抗原肽以及轻链β2m的结合提供参考。本研究结果显示,原核重组表达载体构建成功,插入片段大小与理论设计值831 bp相符。在插入片段的两端,设计了Nde I和Xho I酶切位点,因为这两个位点在pET-21a(+)载体位于多克隆位点两端,而且Nde I本身包含起始密码子ATG,因此表达出的目的蛋白不带有其他标签,非常适合于做蛋白的结构研究,也有利于其功能研究[16]。初步的诱导表达显示,目的基因SLA-1-TPKe成功表达,大小约为30 kD,与理论设计值31 kD相符。由于目前没有市售的SLA-1单抗,而表达蛋白不带有任何标签,因此蛋白不能用Western blot鉴定。但课题组通过酶切鉴定及测序初步证明表达的蛋白为SLA-1-TPK。包涵体提取,证明该重组蛋白主要以包涵体的形式存在,而且包涵体蛋白含量和纯度均较高,适合进行下一步结构和功能的研究。
4 结论
本研究成功克隆及表达了托佩克猪SLA-1-TPKe,并得到其包涵体蛋白。
[1] Vaiman M, Renard C, LaFage P, et al. Evidence for a histocompatibility system in swine(SL-A)[J]. Transplantation,1970, 10(2):155-164.
[2] Ando A, Kawata H, Shigenari A, et al. Genetic polymorphism of the swine major histocompatibility complex(SLA)class I genes, SLA-1, -2 and -3[J]. Immunogenetics, 2003, 55(9):583-593.
[3] Chardon P, Renard C, Gaillard CR, Vaiman M. The porcine major histocompatibility complex and related paralogous regions:a review[J]. Genet Sel Evol, 2000, 32(2):109-28.
[4] Oleksiewicz MB, Kristensen B, Ladekjaer-Mikkelsen AS, Nielsen J. Development of a rapid in vitro protein refolding assay which discriminates between peptide-bound and peptide-free forms of recombinant porcine major histocompatibility class I complex(SLAI)[J]. Vet Immunol Immunopathol, 2002, 86(1-2):55-77.
[5] 冯磊, 赵德, 高凤山. 猪主要组织相容性复合体研究进展[J].生命科学, 2012, 24(7):686-690.
[6] Velten FW, Renard C, Rogel-Gaillard C, et al. Spatial arrangement of pig MHC class I sequences[J]. Immunogenetics, 1999, 49(11-12):919-930.
[7] Gao C, Jiang Q, Guo D, et al. Characterization of swine leukocyte antigen(SLA)polymorphism by sequence-based and PCR-SSP methods in Chinese Bama miniature pigs[J]. Dev Comp Immunol,2014, 45(1):87-96.
[8] 于辉, 李彬, 李华, 等. SLA与免疫抗病的研究进展[J]. 中国畜牧杂志, 2009, 45(5):60-64.
[9] 张敬雄, 施文华, 杨昆祥. 优良瘦肉型猪品种-托佩克配套系[J]. 云南农业, 2008(2):18.
[10] 白婧, 许崇波, 张强, 等. 托佩克猪SLA-2基因克隆及功能区生物信息学分析[J]. 生物技术通报, 2011(8):133-139.
[11] 刘腾飞, 冯磊, 田永发, 等. 托佩克猪SLA-2基因克隆与表达[J]. 动物医学进展, 2013, 34(1):19-23.
[12] 刘筏, 杨金刚, 翟晓鑫, 等. 烟台黑猪SLA-I重链末端生物素修饰及表达[J]. 生物技术通报, 2014(1):191-195.
[13] 高凤山, 夏春, 张强, 等. 大肠杆菌表达的重组猪β2微球蛋白二级结构的圆二色谱分析[J]. 微生物学报, 2009, 49(12):1596-1600.
[14] Rodriguez A, Ley V, Ortuno E, et al. A porcine CD8+ T cell clone with heterotypic specificity for foot-and-mouth disease virus[J]. J Gen Virol, 1996, 77(Pt 9):2089-2096.
[15] Gao FS, Bai J, Zhang Q, et al. Construction of multiple recombinant SLA-I proteins by linking heavy chains and light chains in vitro and analyzing their secondary and 3-dimensional structures[J]. Gene, 2012, 502(2):147-153.
[16] 严婷婷, 苟东州, 董宋鹏, 等. 地方三品系猪SLA-1原核表达载体构建及表达研究[J]. 生物技术, 2014, 24(1):16-19.
(责任编辑 马鑫)
Expression of the Extracellular Domain of SLA-1 Derived from Topigs Pig in Escheichia coli
Zhai Xiaoxin Zhang Xiujuan Yang Jie Gao Fengshan
(College of Life Science and Technology,Dalian University,Dalian 116622)
In order to construct the recombinant prokaryotic expressed vector of the heavy chain of SLA-1 derived from Topigs pig and to study its expression in pET-21a(+), a pair of primers was designed to amplify the extracellular domain of SLA-1-TPK gene(named SLA-1-TPKe)followed by sub-cloning the gene into pMD19-T Simple Vector. After identification by cleavage with Nde I and Xho I, the SLA-1-TPKe was ligated to pET-21a(+)and transformed into BL21(Rosseta)to be induced to express followed by analysis of the expressing products by SDS-PAGE. Finally, the inclusion bodies of the SLA-I-TPKe was isolated and detected by SDS-PAGE. The PCR result was shown that the length of the SLA-1-TPKe was about 851 bp which was consistent with the calculated value. Then, the SLA-1-TPKe was successfully cloned into the pMD19-T Simple Vector and identified by cleavage with Nde I and Xho I and the inserted fragment was about 831 bp. In succession, the gene was successfully inserted into pET-21a(+)followed by transforming into Escherichia coli BL21(Rosseta). After induction and expression,the SLA-1-TPKe was successfully expressed with the interest of protein about 31 kD. The protein was expressed mainly as inclusion body protein with the purity of 90%.
Topigs pig;SLA-1;the heavy chain gene;expression;inclusion protein
10.13560/j.cnki.biotech.bull.1985.2015.04.019
2014-07-30
国家自然科学基金项目(31172304),大连大学本科生创新项目(2013249)
翟晓鑫,男,研究方向:动物分子免疫学;E-mail:1689616387@qq.com
高凤山,男,博士,副教授,研究方向:基因工程和动物分子免疫学;E-mail:gfsh0626@126.com
