甘蔗脱毒健康种苗中单糖转运蛋白基因差异表达分析
2015-10-26王俊刚赵婷婷杨本鹏蔡文伟张树珍
王俊刚 赵婷婷 杨本鹏 蔡文伟 张树珍
(中国热带农业科学院甘蔗研究中心 中国热带农业科学院热带生物技术研究所 农业部热带作物生物学与遗传资源利用重点实验室,海口 571101)
甘蔗脱毒健康种苗中单糖转运蛋白基因差异表达分析
王俊刚 赵婷婷 杨本鹏 蔡文伟 张树珍
(中国热带农业科学院甘蔗研究中心 中国热带农业科学院热带生物技术研究所 农业部热带作物生物学与遗传资源利用重点实验室,海口 571101)
旨在探讨脱毒处理对单糖转运蛋白表达量的影响,分析了3种甘蔗单糖转运蛋白基因SGT1、SGT2和PST2a在健康种苗和常规种苗不同生长时期的表达量差异。结果显示,在苗期和分蘖期甘蔗脱毒健康种苗叶片中SGT1、SGT2和PST2a表达量高于未脱毒种苗;在拔节期和成熟期甘蔗脱毒健康种苗未成熟茎节中SGT1、SGT2和PST2a表达量也高于未脱毒种苗;而在成熟茎节中表达量没有差异。苗期和分蘖期甘蔗叶片以及未成熟茎节中细胞生长分裂旺盛,需要利用大量单糖以提供能源和生物合成的前体物质。结果表明,该3种单糖转运蛋白基因表达量上升可能提供更多单糖用于细胞代谢,促进脱毒健康种苗的快速生长及最终生物量的积累。
甘蔗;健康种苗;单糖转运蛋白基因;基因表达;产量
高等植物中源库组织相互交织形成一个复杂的有机整体。一些源组织如成熟叶片主要为糖类等有机物合成的场所,其合成的光合产物主要以蔗糖的形式运输至库器官后,一部分储存在薄壁细胞中,另外一部分在各种蔗糖代谢酶的作用下水解为单糖,并在单糖转运蛋白的协助下被库器官所利用,从而为植物的生长提供基本能量和营养物质。植物单糖转运蛋白属于易化因子超家族(Major facilitator superfamily)成员之一,是一种能量依赖性H+共转运蛋白,具有12次跨膜结构,包括己糖转运蛋白(hexose transporter,HT)和葡萄糖转运蛋白(glueose tansporter,GT)等,在植物碳水化合物分配、韧皮部装载和卸载、植物防御以及糖信号过程中发挥关键作用,同时与植物生物量形成有密切的关系[1-3]。
甘蔗(Saccharum officinarum L.)是最为重要的糖料作物,是一种多年宿根无性繁殖栽培作物。多年种植尤其是宿根后,几乎所有甘蔗品种在大规模应用后均受到宿根矮化病(Ratoon Stunting Disease,RSD)和甘蔗花叶病(Sugarcane mosaic virus,SCMV)的危害,导致品种退化,造成甘蔗减产达10%,有的甚至高达50%[4,5]。目前,生产上尚无有效的化学方法防治这两种病害。研究表明,采用热处理结合腋芽分生组织培养技术培育的脱毒健康种苗是防治这两种病害最有效的措施之一[6-10]。种植甘蔗脱毒健康种苗可以增产20%-40%[6-8]。从甘蔗农艺性状上对其增产机理研究比较多[8,9],但更进一步分子水平的增产机理还未见报道。本研究利用已报道的3个甘蔗单糖转运蛋白基因PST2a(Putative Sugar Transporter 2a,PST2a)、SGT1(Glucose Tansporter1,SGT1)和SGT2(Glucose Tansporter2,SGT2)为研究对象,分别从甘蔗生长的苗期、分蘖期、拔节期和成熟期对它们的表达量进行比较分析,以期探讨脱毒处理对单糖转运蛋白表达量的影响,从分子生物学层面上揭示种植脱毒健康种苗可能的增产机理。
1 材料与方法
1.1 材料
供试材料为ROC22脱毒健康种苗二代种茎苗和未脱毒ROC22种茎。材料来源于中国热带农业科学院热带生物技术研究所甘蔗试验地。
1.2 方法
1.2.1 总 RNA 提取、定量及完整性检测 取从10个完整植株剥离的冻存样品进行研磨,用RNAout试剂盒(北京天泽基因)试剂提取全部研磨样品的总RNA以减少取样误差。用核酸分析仪(Eppendorf Biophotometer Plus)测260 nm和280 nm处的吸光值,以A260/A280比值估计总RNA的纯度,以A260的值进行总RNA定量。以1.2%普通琼脂糖凝胶电泳检测RNA完整性。
1.2.2 第一链 cDNA的合成 取甘蔗总RNA 3 μg与反转录引物(oligo-dT接头引物)1 μL(10 pmol/L)混合,70℃加热5 min后,立即放置冰上,然后加入5×buffer,2.5 mmol/L dNTP混合液,Ribonuclease Inhibitor,M-MLV反转录酶,反应体系为25 μL。反应过程为42℃ 60 min,70℃ 15 min,5 min后瞬时离心,最后放入-80℃保存备用。
1.2.3 引物设计 根据公布的甘蔗单糖转运蛋白基因SGT1(GenBank 登录号:L21752)、SGT2(GenBank登录号:L21753)、PST2a(GenBank登录号:AY-165599)序列利用primer3设计引物,内参GADPH基因引物引自参考文献[11]。

表1 引物序列、PCR扩增基因片段长度和扩增效率
1.2.4 Real-Time PCR 扩增及数据分析 选用SYBR®Premix Ex TaqTMⅡ(TaKaRa)试剂盒,按照说明书建立25 μL荧光定量PCR 反应体系:cDNA模板1μL,引物1、引物2各1 μL,RoxⅡ 0.5 μL,SYBR Taq 12.5 μL,dH2O 9 μL;反应程序:95℃热变性15 s;95℃ 15 s,60℃ 40 s,40个循环。反应在Mx3005P(Stratagene)上完成,每个处理设置3 次重复,扩增效率见表1。以甘蔗GADPH基因为内参基因,所有结果以2-ΔΔCT法计算相对定量值[12]。
2 结果
2.1 RNA 纯度鉴定
不同组织以及不同生长时期的总RNA琼脂糖凝胶电泳表明,28S和18S条带清晰可见,无明显降解;A260/A280比值皆在1.8-2.2之间,可用于下一步试验。
2.2 苗期单糖转运蛋白基因表达分析
研究结果表明,3个单糖转运蛋白基因SGT1、SGT2和PST2a在苗期甘蔗叶片中均有表达;在脱毒健康种苗未成熟叶片中表达量均明显高于未脱毒种苗;在脱毒健康种苗成熟叶片中SGT1和SGT2表达量与对照无差异,PST2a基因表达量升高(图1)。

图1 甘蔗苗期不同组织SGT1、SGT2和PST2a基因相对表达量
2.3 分蘖期单糖转运蛋白基因表达分析
选择甘蔗分蘖中期单糖转运蛋白基因的表达特征进行分析。大约在甘蔗第一棵分蘖苗长出7 d后,对主茎甘蔗进行采样,此时主茎甘蔗叶片光合效率高,需要大量合成有机化合物,随后光合效率维持一段时间后,慢慢降低(数据未显示)。研究结果(图2)表明,SGT1、SGT2和PST2a在脱毒健康种苗未成熟和成熟叶片中的表达量较未脱毒种苗均大幅提高,表明脱毒处理可能使分蘖期甘蔗叶片中单糖利用效率提高,促进植株的分蘖和快速生长。
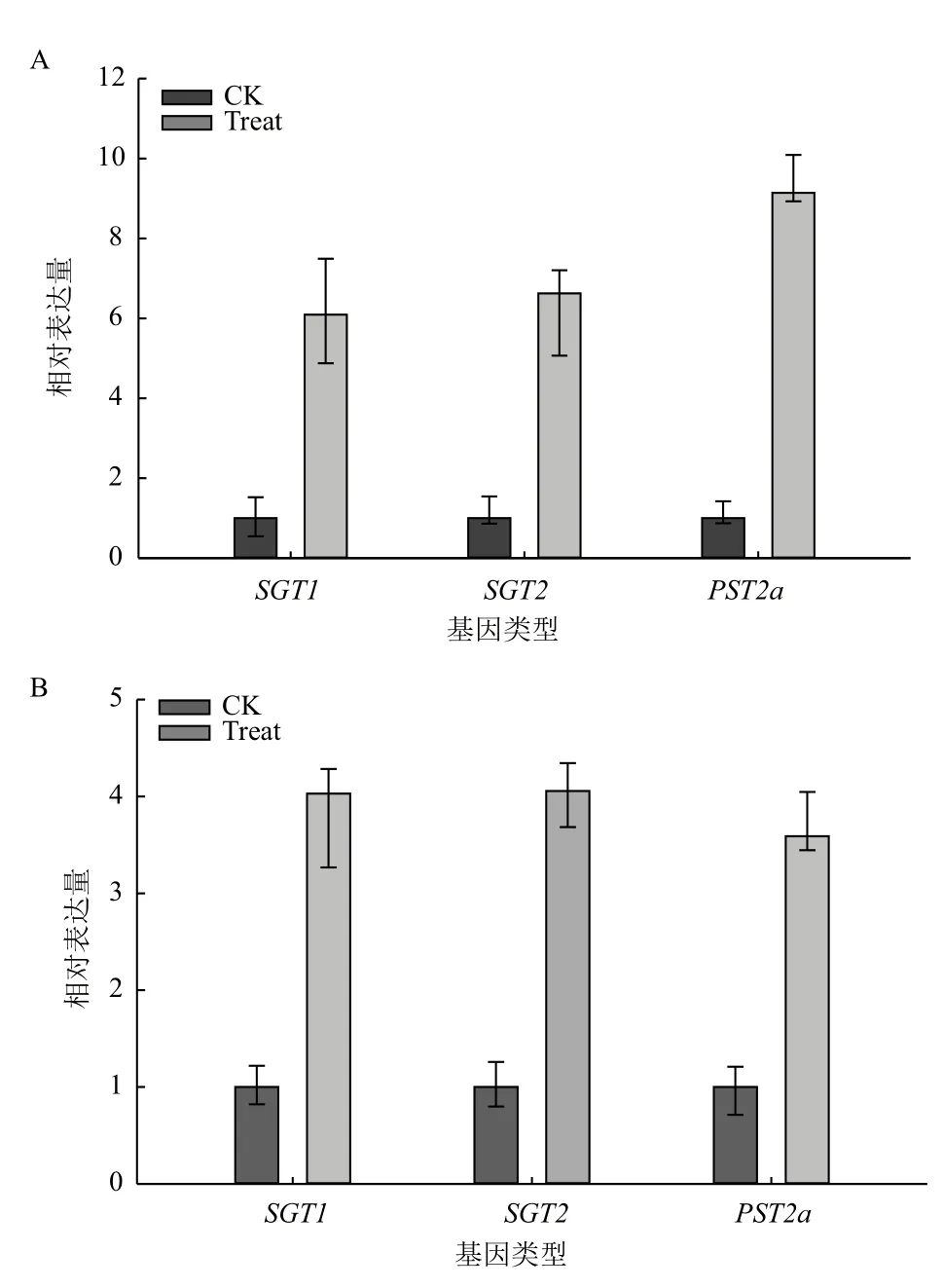
图2 甘蔗分蘖期不同组织SGT1、SGT2和PST2a基因相对表达量
2.4 拔节期单糖转运蛋白基因表达分析
甘蔗拔节期为茎秆快速生长时期,甘蔗最终生物量与此阶段的快速生长呈正相关。结果(图3)表明,SGT1、SGT2和PST2a在拔节期甘蔗脱毒健康种苗叶片中表达量与未脱毒种苗差异不明显;然而在茎节中的表达量差异却呈现出一定的趋势:在幼嫩未成熟1-3茎节中,表达量稍有提高;随着茎节发育糖分的快速利用,到7-8节SGT1、SGT2和PST2a表达量均大幅提高;随着茎节成熟表达量差异增幅逐渐变小或没有差异,可能与甘蔗茎秆中单糖的利用效率呈正相关。
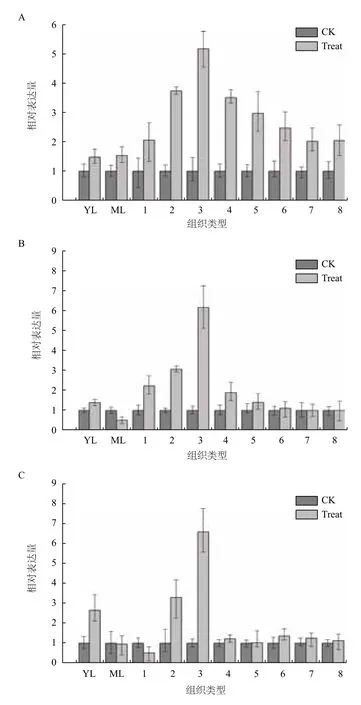
图3 甘蔗拔节期不同组织SGT1(A)、SGT2(B)和PST2a(C)基因相对表达量

图4 甘蔗成熟期不同组织SGT1(A)、SGT2(B)和PST2a(C)基因相对表达量
2.5 成熟期单糖转运蛋白基因表达分析
结果(图4)表明,SGT1和PST2a在成熟期脱毒健康甘蔗种苗叶片中的表达量大幅增加,而SGT2表达量差异较小;SGT1和SGT2在脱毒健康种苗未成熟茎节中表达量大幅提高,随着茎节成熟表达量低于对照,然而PST2a在成熟期脱毒健康甘蔗种苗茎秆中的表达量与未脱毒种苗没有差异。表明该3种单糖转运蛋白可能在不同组织中参与调控单糖的分配及利用。
3 讨论
植物单糖转运蛋白是调控生物量的一类重要蛋白[13]。在多种植物中均存在多基因现象,并且在不同植物中基因成员数及不同部位表达量也有所不同。在植物生长发育过程中不同单糖转运蛋白可能是通过协同作用实现其生理学功能[14-16]。水稻单糖转运蛋白OsMST6在种子灌浆中期表达量达到最高,随着种子成熟逐渐降低,主要表达部位在幼嫩种子维管薄壁组织的珠心和胚乳、花粉、花药以及叶片叶肉细胞中,推测OsMST6可能与种子形成及产量有相关性[17];水稻OsMST4 在种子灌浆期早期和中期表达量最高,随后降低,拟推测其重要功能为种子形成供应单糖[18];拟南芥单糖转运蛋白STP1和STP13在根部表达,能够从根的周围吸收糖分[19];通过提高拟南芥单糖转运蛋白TMT1表达量能够增加其种子的生物量[13]。各种单糖转运蛋白差异表达量和组织特异性表达,也决定了其在植物不同发育阶段发挥不同的作用。此外,单糖转运蛋白也参与植物防御过程,通常基因表达受到病原菌入侵的调控[3]。
种植甘蔗脱毒健康种苗通常能够增产20%以上,其增产机理在田间主要表现为分蘖强、生长快、成茎率高等性状[8]。然而进一步从分子生物学方面对其可能的增产机理的研究报道较少,特别是关于单糖转运方面的研究还未见报道。植物中单糖转运蛋白通常与单糖的快速利用和分配相关。在生长和细胞分裂旺盛的细胞及组织中通常对单糖的需求高,因此也需要较多的单糖转运蛋白参与。本研究表明,甘蔗SGT1、SGT2和PST2a基因在脱毒健康种苗苗期和分蘖期叶片中的表达显著高于未脱毒种苗,表明脱毒处理可能使得这一生长阶段甘蔗叶片中单糖利用提高,促进叶片及整株植株的快速生长发育,这也可能为脱毒健康种苗的强分蘖提供更多的单糖而被加以利用。SGT1、SGT2和PST2a在拔节期脱毒健康种苗快速生长1-8茎节中的表达明显高于对照,可能有利于茎节的快速生长,为其提供更多的单糖以及纤维素合成前体底物,因此进一步需要更多的单糖转运蛋白来增强对单糖的利用。SGT1和SGT2在脱毒健康种苗成熟期1-8节茎节中大量表达,有利于未成熟茎节增粗,增加产量;同时在成熟茎节中表达量降低,降低了对单糖的利用,促进蔗糖的积累,提升甘蔗品质。通过对整个生长期脱毒健康种苗和非脱毒苗中的单糖转运蛋白基因差异表达研究表明:单糖转运蛋白基因表达量与甘蔗脱毒健康种苗的产量形成呈正相关;该3种单糖转运蛋白基因表达可能受到甘蔗病害的抑制,进一步预测它们可能有利于甘蔗的产量形成。
4 结论
本研究采用Real-Time PCR技术分析了甘蔗脱毒健康种苗和常规种苗中3种单糖转运蛋白基因SGT1、SGT2和PST2a不同生长时期的表达量差异。研究结果表明:(1)在苗期甘蔗脱毒健康种苗叶片中PST2a基因表达高于未脱毒种苗;SGT1和SGT2基因在未成熟叶片中表达高于未脱毒种苗。(2)在分蘖期甘蔗脱毒健康种苗叶片中SGT1、SGT2和PST2a表达量均明显高于对照。(3)在拔节期甘蔗脱毒健康种苗叶片中SGT1、SGT2和PST2a基因表达与对照没有差异;而在未成熟茎节中SGT1、SGT2和PST2a基因表达量都明显高于对照,随着茎节成熟表达量差异逐渐缩小。(4)在成熟期甘蔗脱毒健康种苗叶片中SGT1和PST2a基因表达量比对照高;未成熟茎节中SGT1和SGT2基因表达量高于对照,而成熟茎节中表达量没有差异。
[1] 王俊刚, 赵婷婷, 张树珍, 等. 植物单糖转运蛋白[J]. 植物生理学通讯, 2007, 43(6):1195-1200.
[2] Wormit A, Trentmann O, Feifer I, et al. Molecular identification and physiological characterization of a novel monosaccharide transporter from Arabidopsis involved in vacuolar sugar transport[J]. The Plant Cell, 2006, 18(12):3476-3490.
[3] Slewinski TL. Diverse functional roles of monosaccharidetransporters and their homologs in vascular plants:a physiological perspective[J]. Mol Plant, 2011, 4(4):641-662.
[4]Flynn JL, Anderlini TA. Disease incidence and yield performance of tissue culture generated seedcane over the crop cycle in Louisiana[J]. Sugar Azucar, 1989, 80:20.
[5]Hendre RA, Mascarenhas AF, Nadgir AL, et al. Growth of mosaic virus-free sugarcane plants from apical meristems[J]. Indian Pathology, 1975, 28:185-198.
[6]Leu LS. Apical meristem culture and redifferentiation of callus masses to free some sugarcane systemic disease[J]. Plant Protection Bulletin, 1978, 20:77-82.
[7]Lee TSG. Micropropagation of sugarcane(Saccharum spp. )[J]. Plant Cell Tissue Organ Cult, 1991, 10:47-55.
[8]杨本鹏, 张树珍, 蔡文伟, 等. 甘蔗健康种苗田间栽培主要农艺性状比较[J]. 热带作物学报, 2010, 2(31):117-175.
[9] 游建华, 曾慧, 李松, 等. 甘蔗脱毒健康种苗田间比较试验[J].中国糖料, 2005, 2:12-15.
[10]杨本鹏. 糖料甘蔗栽培[M]. 海口:南方出版社.
[11]Iskandar HM, Simpson SR, Casu RE, et al. Comparison of reference genes for quantitative real-time polymerase chain reaction analysis of gene expression in sugarcane[J]. Plant Mol Biol Rep, 2004, 2(22):325-337.
[12]Livak KJ, Schmittgen TD. Analysis of relative gene expression data using Real-Time Quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25:402-408.
[13]Wingenter K, Schulz A, Wormit A, et al. Increased activity of the vacuolar monosaccharide transporter TMT1 alters cellular sugar partitioning, sugar signaling, and seed yield in Arabidopsis[J]. Plant Physiol, 2010, 154(2):665-677.
[14]Johnson DA, Hill JP, Thomas MA. The monosaccharide transporter gene family in land plants is ancient and shows differential subfamily expression and expansion across lineages[J]. BMC Evol Biol, 2006, 6:64.
[15]Buttner M. The monosaccharide transporter(-like)gene family in Arabidopsis[J]. FEBS Letters, 2005, 81(12):2318-2324.
[16]Lalonde S, Frommer WB. SUT sucrose and MST monosaccharide transporter inventory of the Selaginella genome[J]. Trends Plant Sci, 2012, 3:24.
[17]Wang Y, Xiao Y, Zhang Y, et al. Molecular cloning, functional characterization and expression analysis of a novel monosaccharide transporter gene OsMST6 from rice(Oryza sativa L. )[J]. Planta, 2008, 228(4):525-535.
[18]Wang Y, Xu H, Wei X, et al. Molecular cloning and expression analysis of a monosaccharide transporter gene OsMST4 from rice(Oryza sativa L. )[J]. Plant Mol Biol Rep, 2007, 65(4):439-451.
[19]Yamada K, Kanai M, Osakabe Y, et al. Monosaccharide absorption activity of Arabidopsis roots depends on expression profiles of transporter genes under high salinity conditions[J]. J Biol Chem,2011, 286(50):43577-43586.
(责任编辑 马鑫)
The Differential Expression of Monosaccharide Transporter Genes in Disease-free Sugarcane Plants
Wang Jungang Zhao Tingting Yang Benpeng Cai Wenwei Zhang Shuzhen
(Sugarcane Research Center of Chinese Academy of Tropical Agricultural Sciences,Institute of Tropical Bioscience and Biotechnology of Chinese Academy of Tropical Agricultural Sciences,Key Laboratory of Biology and Genetic Resources of Tropical Crops,Ministry of Agriculture,Haikou 571101)
The sugarcane yield can be increased by planting disease-free sugarcane seedlings. However, the physiological and molecular mechanisms of this yield increasing are still not clear now. Monosaccharide transporters are one type of key regulatory proteins involved in carbon accumulation and partitioning processes, and play an important role in plants defense process. The differential expression of three monosaccharide transporter genes(SGT1, SGT2 and PST2a)in disease-free and untreated sugarcane plants was studied to clarify the potential function of these genes on sugarcane yields. The expression levels of SGT1, SGT2 and PST2a in leaves of disease-free plants at seedling and tillering stages were obviously higher than untreated plants. Furthermore, the expression levels of these genes were increased in immature internodes of disease-free plants at elongation and mature stages, but there were no difference in mature internodes. The sugarcane leaves(at seedling and tillering stages)and the immature internodes(at elongation and mature stages)grow rapidly and demand for more monosaccharide to provide energy and the precursor of biosynthesis. The up-regulations of these monosaccharide transporter genes might accelerate the growth and biomass accumulation of disease-free sugarcane plants by increasing the transporting and uptake of monosaccharide.
sugarcane;disease-free plants;monosaccharide transporter gene;gene expression;yield
10.13560/j.cnki.biotech.bull.1985.2015.04.016
2014-09-04
“863”计划(2013AA102604-1),海南省自然科学基金项目(313078),海南省重大科技项(ZDZX2013023-1)
王俊刚,男,博士研究生,助理研究员,研究方向:甘蔗生物技术;E-mail:wangjungang@itbb.org.cn
张树珍,女,博士,研究员,研究方向:甘蔗生物技术;E-mail:zhangsz2007@163.com
