蒙古沙冬青AmDREB2.1基因的克隆及表达分析
2015-10-26李章磊高飞曹玉震张至玮王宁李华云周宜君
李章磊 高飞 曹玉震 张至玮 王宁 李华云 周宜君
(中央民族大学生命与环境科学学院,北京 100081)
蒙古沙冬青AmDREB2.1基因的克隆及表达分析
李章磊 高飞 曹玉震 张至玮 王宁 李华云 周宜君
(中央民族大学生命与环境科学学院,北京 100081)
基于已建立的蒙古沙冬青[Ammopiptanthus mongolicus(Masxim.)Cheng f.]根的转录本数据库,分离到1个编码DREB类转录因子基因,命名为AmDREB2.1。该序列全长978 bp,包括531 bp的开放阅读框(ORF),编码176个氨基酸,具有典型的DREB转录因子保守的AP2结构域。实时荧光定量PCR分析表明,该基因能在根、叶中表达,但对干旱、低温响应不同,AmDREB2.1主要参与根的干旱胁迫应答。
蒙古沙冬青;AmDREB2.1;序列分析;表达模式
沙冬青属植物是亚洲中部地区唯一和特有的常绿阔叶灌木,是第四季冰川孑遗植物[1],具有重要的研究价值。沙冬青属为寡种属,仅有蒙古沙冬青和新疆沙冬青2个种。蒙古沙冬青[Ammopiptanthus mongolicus(Maxim)Cheng f.],也被称为沙冬青、冬青、蒙古黄花木,主要分布于我国内蒙古、宁夏等地,具有抗旱、抗寒、抗风蚀等特性,在我国西北部荒漠地区的生态平衡和水土保持中发挥了重要作用,同时也被认为是研究林木抗逆机制、发掘抗逆基因资源的理想材料。近年来,关于沙冬青抗逆分子机制和抗逆功能基因的研究受到越来越多的重视[2-6]。
干旱、低温等非生物逆境是影响植物生长发育的重要因素。植物对逆境胁迫的响应是通过众多基因的逐次表达实现的,这些基因可分为功能基因和调节基因两大类。转录因子基因是一类重要的调节基因,研究转录因子在植物胁迫应答中的作用有助于推进对于植物逆境分子机制的认识。DREB(dehydration responsive element binding)类转录因子属于植物AP2/EREBP(ethylene-responsive element binding protein)转录因子大家族中的一个亚族,可通过其保守的AP2结构域与多个逆境应答基因启动子区的DRE(dehydration responsive element)/CRT(C-repeat responsive element)顺式作用元件特异性地结合,在逆境胁迫下调控一系列下游逆境应答基因的表达[7,8]。目前,研究人员已经对DREB类转录因子基因(拟南芥CBF3 /DREB1A[9]、水稻OsDREB1F[10]、玉米ZmDREB2[11],烟草NbDREB-2a[12])进行了转基因研究,发现所获得的转基因植物能具有较高的干旱、高盐或低温耐受性。克隆和鉴定更多的DREB 类基因用于筛选抗逆作物育种的候选基因已成为国内外植物抗逆分子生物学领域研究的热点之一[13]。
本研究以蒙古沙冬青为材料,基于实验室前期建立的蒙古沙冬青根转录本数据库[2],从中克隆得到1个新的DREB类基因,对其序列特征、编码蛋白的功能域及系统进化关系进行分析,并对其逆境表达模式进行研究,旨在为阐释蒙古沙冬青DREB类转录因子在应答干旱、低温等逆境胁迫中的分子机制提供试验数据。
1 材料与方法
1.1 材料
蒙古沙冬青(A. mongolicus)种子采自宁夏自治区中卫县。Trizol试剂购自Invitrogen公司,FastQuant cDNA第一链合成试剂盒和PCR Master Mix购自天根公司,胶回收试剂盒购自Bio Teke公司,pGEM-T载体购自Promega公司,大肠杆菌(Escherichia coli)DH5α感受态细胞购自北京博迈德科技发展有限公司,SYBR Green Supermix购自Thermo公司。
1.2 方法
1.2.1 试验材料处理 种子经播种、萌发培养4周后,采用含20% PEG6000的1/2 Hoagland营养液浇灌,分别处理1、6、24和72 h。在低温恒温冷光源光照培养箱中,4℃下分别处理1、3、6和24 h;以未胁迫处理(0 h)为对照。分别取胁迫处理和未经胁迫处理后的植物根和叶片组织,称量后迅速放入液氮中,用于基因的克隆和表达模式分析。
1.2.2 AmDREB2.1基因的克隆 采用本实验室改良的Trizol 法分别提取不同胁迫处理的植物根和叶片组织总RNA[14],用FastQuant cDNA第一链合成试剂盒合成cDNA第一链。
根据本实验室的蒙古沙冬青根转录本数据库中的数据,进行DREB相关基因序列的搜索,获得1个编码DREB基因序列。采用Primer 5.0设计简并引物,引物序列为5'-GGCGGTGGTGTGATAAACTC-3'/5'-ATGCACCACAACACACGATT-3'。以反转录得到的未经胁迫处理的cDNA为模板,进行PCR扩增,反应体系:2×Pfu PCR Master Mix 20 μL,上下游引物(10 μmol/L)各1 μL,cDNA 1 μL,ddH2O 17 μL,总体积40 μL。反应条件:94℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 45 s,30个循环;72℃ 5 min;4℃保温。胶回收目的片段,与pGEM-T载体连接,转化E.coli DH5α感受态细胞,挑取单克隆进行菌落PCR 检测,筛选出阳性克隆,送至北京华大基因公司测序。
1.2.3 AmDREB2.1基因的生物信息学分析 分别采用相关生物信息学软件对获得的蒙古沙冬青编码DREB基因AmDREB2.1及演绎的氨基酸序列进行分析,具体分析目标及选用的相关软件见表1。

表1 AmDREB2.1基因的生物信息学分析使用的相关软件
1.2.4 AmDREB2.1的表达模式分析 根据荧光定量PCR(Quantitative real-time PCR,qRT-PCR)检测引物的设计原则设计基因检测引物和内参引物。用引物5'-GTGCCAGAGTGGATGCTCTT-3'/5'-ATGCACCACAACACACGATT-3'扩增目标基因AmDREB2.1,用引物5'-CTGACATGCGCCGTAGGAACG-3'/5'-CCCTGCTTATGCCAGTCTTTT-3'扩增内参基因AmeIF1(蒙古沙冬青的真核起始因子基因)。
采用qRT-PCR对不同胁迫处理下AmDREB2.1在根和叶片中的表达模式进行分析,以未处理(0 h)为对照,以AmeIF1为内参基因。反应体系(10 μL):2×SYBR Green Supermix 5 μL, 上 下游引物(10 μmol/L)各0.3 μL,稀释后cDNA模板0.8 μL,ddH2O 3.6 μL。 反 应 于Bio-Rad MyIQ2荧光定量PCR仪上进行。反应条件:95℃预变性5 min;95℃ 10 s,60℃ 20 s,循环40次;55℃ 10 s(0.5℃/循环),循环81次。采用基因表达相对定量分析,将对照样本的基因表达量设为1,处理样本中的基因表达量变化的倍数用2-△△Ct来表示,其中:△△Ct=△Ct(处理)-△Ct(对照),△Ct=Ct(目标基因)-Ct(内参基因),计算在不同处理下基因的表达量,其中每个处理重复3次,每个重复做3个平行。
2 结果
2.1 AmDREB2.1基因全长的克隆
用改良Trizol法提取蒙古沙冬青总RNA,根据本实验室已建立的蒙古沙冬青根的转录本数据库中搜索获得的DREB基因序列设计引物,进行PCR扩增,获得的目的片段大小为600 bp左右,扩增结果与预测结果一致(图1)。
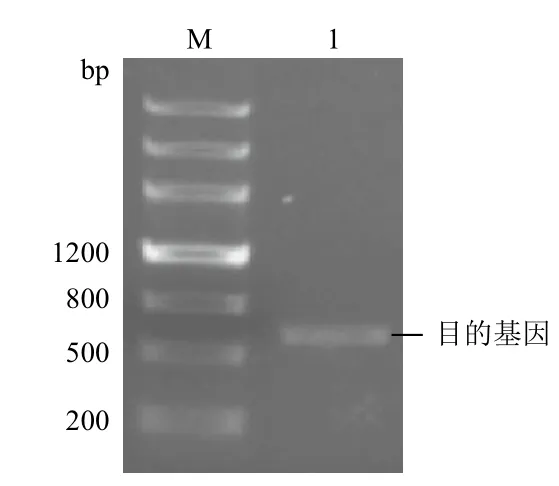
图1 蒙古沙冬青AmDREB2.1的ORF区PCR产物电泳图
2.2 AmDREB2.1基因的生物信息学分析
2.2.1 AmDREB2.1基因全长序列的结构特征 采用DNAMAN 7.0分析从蒙古沙冬青根转录本数据库中获得的1个编码DREB的基因全长序列。序列全长为978 bp,其中5' UTR 长度为257 bp,3' UTR长度为 190 bp 。ORF编码区长度为531 bp,可编码176个氨基酸(图2-A)。计算其等电点(pI)为5.59,分子量(MW)为20 210.16 Da。采用NCBI在线分析序列表明,此基因编码的蛋白质具有典型的AP2结构域,具有11个DNA结合位点,应属于AP2超家族成员(图2-B)。与GenBank登录的部分DREB基因进行多序列比对,发现该基因与很多DERB2类基因高度相似,故将其命名为AmDREB2.1。
AmDREB2.1的氨基酸序列的潜在磷酸化位点共计11个,其中7个为Ser,3个为Thr,1个为Tyr。AmDREB2.1不存在跨膜结构,不是跨膜蛋白。用SignalP 3.0Server在线软件分析确定AmDREB2.1不具有信号肽。用PSORT对AmDREB2.1的氨基酸序列进行亚细胞定位分析,推测其定位于细胞核中。采用cNLS Mapper对AmDREB2.1的氨基酸序列进行核定位信号分析,确定其核定位信号序列由30个氨基酸构成(图2-A灰色阴影部分)。
2.2.2 AmDREB2.1高级结构预测 基因功能的最终表现在于它所编码的蛋白质的功能,而功能的实现取决于其高级结构特征。二级结构预测表明AmDREB2.1的二级结构主要有3种类型,分别为α-螺旋、β-折叠片和无规则卷曲。3种结构所占比例不同,以无规则卷曲为主,β-折叠片较少(图3-A)。三级结构预测结果见图3-B。
2.2.3 AmDREB2.1的系统进化分析 在NCBI中搜索与AmDREB2.1氨基酸序列相近的10个编码DREB氨基酸序列:拟南芥(Arabidopsis thaliana)AtDREB2A/BAA36705.1、AtDREB2B /AEE74994.1和AtDREB2C/ AEC09816.1,白刺花(Sophora davidii)SdDREB2/AFP89590.1,大豆(Glycine max)GmDREB1/AAP47161.1、GmDREB2/ABB36645.1和 GmDREB3/ABB36646.1,盐豆木(Halimodendron halodendron)HhDREB2/ACJ66376.1,水稻(Oryza sativa)OsDREB2A/Q0JQF7.1和玉米(Zea mays)ZmDREB-2A/ANP_001105876.1,已有文献报道的2个蒙古沙冬青中编码DREB序列AmDREB1[15]和AmDREB3[16],与本研究的AmDREB2.1等共计13个DREB的氨基酸序列采用MEGA5.0进行多序列比对,并构建进化树,结果见图4和图5。

图2 AmDREB2.1的核苷酸序列及推测的蛋白质序列特征

图3 AmDREB2.1的二级结构(A)与三级结构预测(B)
图4为选取的不同植物13个DREB氨基酸序列比对结果,各序列尽管长短有别,但都具有13个保守的氨基酸,保守氨基酸的存在可能与AP2结构域有关。从构建的系统进化树(图5)可知,在选取的13种DREB蛋白质中,AmDREB2.1和豆科的盐豆木HhDREB2、大豆GmDREB2和GmDREB1聚为一类,与HhDREB2亲缘关系最近;与拟南芥的AtDREB2A、AtDREB2B和AtDREB2C的关系较远。此外,本研究的AmDREB2.1与已报道的AmDREB1和AmDREB3的亲缘关系相对较远。

图4 AmDREB2.1与其他植物已知DREB 蛋白的多序列比对
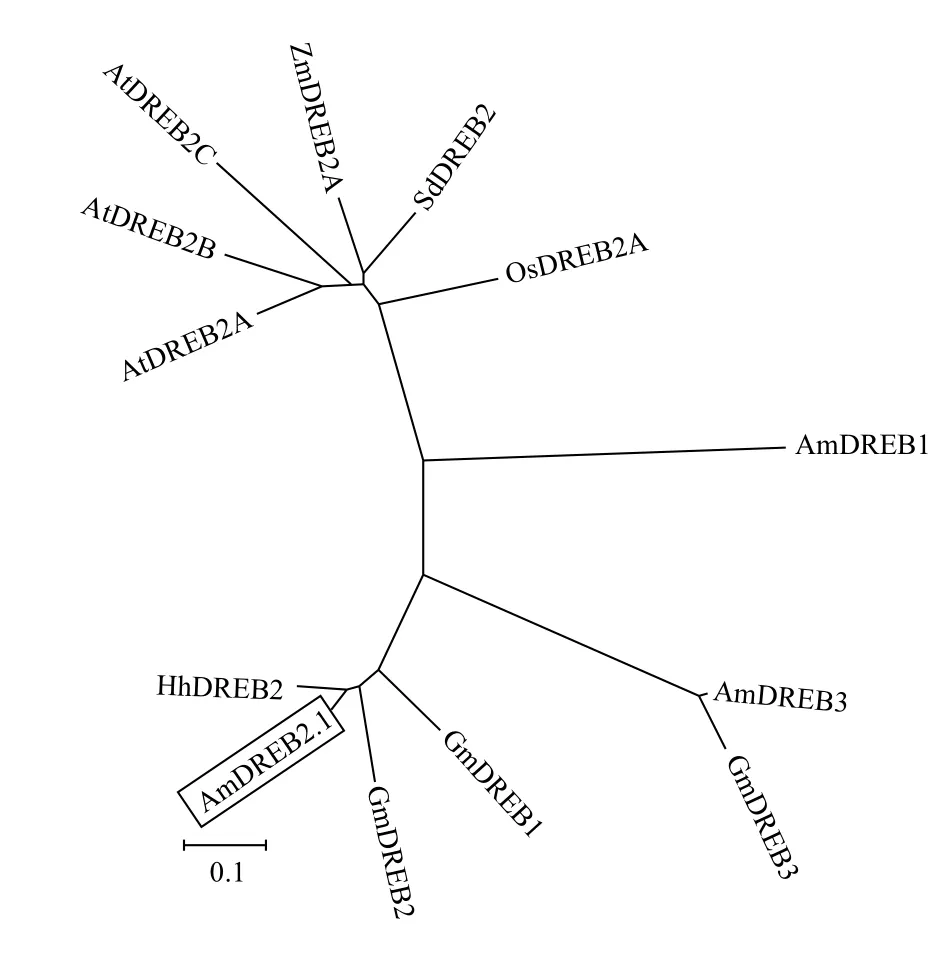
图5 AmDREB2.1的系统进化树分析
2.3 AmDREB2.1基因的表达模式分析
2.3.1 干旱胁迫下AmDREB2.1的表达特征 以20% PEG6000模拟干旱胁迫处理,采用qRT-PCR研究AmDREB2.1在干旱胁迫下不同组织中的响应特点,结果(图6-A)显示,AmDREB2.1在根和叶片中的逆境表达模式不同。根中AmDREB2.1在不同的干旱胁迫下皆为显著上调表达,1 h表达量为对照水平的4.47倍;6 h表达量达到最大值,为对照水平的12.73倍;随着胁迫时间延长,24 h和72 h表达量呈明显的回落趋势,但高于对照。而叶中AmDREB2.1在不同干旱胁迫条件下表现为下调表达,1 h表达量显著下调,为对照水平的0.31;随着胁迫时间延长,表达量有上升趋势。
2.3.2 低温胁迫下AmDREB2.1的表达特征 以4℃进行处理,采用qRT-PCR研究AmDREB2.1在低温胁迫下的响应特点,结果(图6-B)显示,AmDREB2.1在根和叶片中的逆境表达模式相似,与对照相比皆表现为下调表达,且随胁迫时间延长表达量有上升趋势,但在24 h表达量显著下调,其中根中表达量为对照水平的0.36,而叶中表达量为对照水平的0.26。

图6 AmDREB2.1响应干旱(A)和低温(B)胁迫的表达特征
3 讨论
植物在干旱、低温等逆境胁迫下,与逆境相关转录因子的高效表达可激活多个下游基因的转录和表达,进而达到调节多个功能基因的效果。研究表明,在低温和干旱等逆境胁迫下,DREB 类转录因子通过与逆境信号途径中下游基因的启动子区域中的DRE 或CRT 顺式作用元件结合,进而激活rd(Responsive to dehydration)/COR(Cold responsive /regulated gene)类基因的表达,从而增强植物对逆境胁迫的耐受力[17,18]。DREB类转录因子成员较多,有的参与低温响应,有的则与干旱、高盐/高温有关。如在拟南芥中,DREB1基因主要受低温诱导表达,DREB2基因则受干旱、高盐和高温诱导表达[18]。DREB类转录因子对不同胁迫的选择性应答可能与其自身启动子结构特点等多种因素有关。
本研究从耐逆植物蒙古沙冬青中分离获得了1个编码DREB类转录因子基因AmDREB2.1,生物信息学分析表明其编码蛋白具有典型的DREB 类转录因子所共有的保守AP2结构域和保守的氨基酸。AmDREB2.1与同为豆科的盐豆木HhDREB2、大豆GmDREB1和GmDREB2亲缘关系最近,与十字花科的拟南芥AtDREB2A、AtDREB2B和AtDREB2C亲缘关系较远,与已经报道的蒙古沙冬青AmDREB1和AmDREB3分属在不同的进化支上,同种植物不同成员之间的进化关系结果提示可能存在功能上的差异。
Li等[19]在研究大豆GmDREB时发现GmDREBc仅在根中受盐、干旱和ABA诱导。本研究结果表明,尽管AmDREB2.1在蒙古沙冬青的根和叶片中均能表达,但在不同胁迫条件下,AmDREB2.1在根与叶片的表达模式不同。AmDREB2.1主要在根中受干旱胁迫的强烈诱导,而不受低温胁迫诱导,表明AmDREB2.1主要参与蒙古沙冬青应答干旱胁迫的反应,且具有组织特异性,仅在根中积极响应,符合DREB2类基因主要受干旱、高盐和高温诱导表达的特征。我们推测这种现象可能与DREB基因复杂的调控机制有关。研究人员已经发现,在植物DREB的启动子区域分布着多种与光、ABA、GA、乙烯和茉莉酸等激素、温度、钙信号相关的顺式作用元件[20],这些顺式作用元件与相应的反式作用元件(如ICE1)发生相互作用,共同决定DREB基因的表达水平。在干旱和低温胁迫下的蒙古沙冬青叶片和根系中,激素等条件可能会出现差异,这种差异可能会导致本研究观察到的AmDREB2.1在不同组织中的不同的逆境诱导模式。研究结果提示DREB转录因子中的不同成员不仅具有应答不同逆境胁迫的分工,同时存在组织特异性表达特征,研究不同胁迫下不同成员的组织表达特征是十分必要的。本研究结果为进一步探索蒙古沙冬青DREB类转录因子基因在逆境胁迫应答中的作用机理与功能研究提供了试验依据。
4 结论
从蒙古沙冬青中分离到1个编码DREB类转录因子基因,命名为AmDREB2.1。该序列开放阅读框编码176个氨基酸,具有典型的DREB转录因子保守的AP2结构域。实时荧光定量PCR分析表明,该基因能在根、叶中表达,但对干旱、低温响应不同,AmDREB2.1主要参与根的干旱胁迫应答。
[1] 潘伯荣, 葛学军. 我国沙冬青属植物保护生物学研究和保护实践的回顾与展望[A]. 中国生物多样性保护与研究进展VI—第六届全国生物多样性保护与持续利用研究会论文集(2004).北京:气象出版社, 2005:373-392.
[2] Zhou YJ, Gao F, Liu R, et al. De novo sequencing and analysis of root transcriptome using 454 pyrosequencing to discover putative genes associated with drought tolerance in Ammopiptanthus mongolicus[J]. BMC Genomics, 2012, 13:266.
[3] Pang T, Ye CY, Xia X, et al. De novo sequencing and transcriptome analysis of the desert shrub, Ammopiptanthus mongolicus, during cold acclimation using Illumina/Solexa[J]. BMC Genomics, 2013,14(1):488.
[4] Guo H, Li Z, Zhou M, et al. cDNA-AFLP analysis reveals heat shock proteins play important roles in mediating cold, heat, and drought tolerance in Ammopiptanthus mongolicus[J]. Funct Integr Genomics, 2014, 14(1):127-133.
[5] Wei Q, Kuai BK, Hu P, et al. Ectopic expression of an Ammopiptanthus mongolicus H+-pyrophosphatase gene enhances drought and salt tolerance in Arabidopsis[J]. Plant Cell Tiss Organ Cult, 2012,110:359-369.
[6] Deng LQ, Yu HQ, Liu YP, et al. Heterologous expression of antifreeze protein gene AnAFP from Ammopiptanthus nanus enhances cold tolerance in Escherichia coli and tobacco[J]. Gene,2014, 539(1):132-140.
[7] 李科友, 朱海兰. 植物非生物逆境胁迫DREB/CBF转录因子的研究进展[J]. 林业科学, 2011, 47(1):124-134.
[8] Mizoi J, Shinozaki K, Yamaguchi-Shinozaki K. AP2 /ERF family transcription factors in plant abiotic stress responses[J]. Biochim Biophys Acta, 2012, 1819:86-96.
[9] Liu Q, Kasuga M, Sakuma Y, et al. Two transcription factors, DREB1 and DREB2, with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought and low-temperature-responsive gene expression, respectively, in Arabidopsis[J]. Plant Cell, 1998, 10:391-406.
[10] Wang Q, Guan Y, Wu Y, et al. Overexpression of a rice OsDREB1F gene increases salt, drought, and low temperature tolerance in both Arabidopsis and rice[J]. Plant Mol Biol, 2008, 67:589-602.
[11] Qin F, Kakimoto M, Sakuma Y. Regulation and functional analysis of ZmDREB2A in response to drought and heat stresses in Zea mays L. [J]. Plant J, 2007, 50:54-69.
[12] 耿芳, 郭伟华, 郭玉双, 等. 烟草DREB转录因子新基因的克隆与功能分析[J]. 浙江大学学报:农业与生命科学版,2011, 37(1):22-30.
[13] Xu ZS, Chen M, Li LC, et al. Functions and application of the AP2 /ERF transcription factor family in crop improvement[J]. J Integr Plant Biol, 2011, 53(7):570-585.
[14] 陈静, 高飞, 周宜君, 等. 改良Trizol法提取蒙古沙冬青总RNA[J]. 生物技术通报, 2013(10):87-92.
[15] 杨杞, 白肖飞, 高阳, 等. 沙冬青CBF/DREB1转录因子cDNA的克隆及序列分析[J]. 基因组学与应用生物学, 2009, 28(6):1043-1048.
[16] 张锋, 王学峰, 董博, 等. 沙冬青AmDREB3基因的克隆及植物表达载体构建[J]. 内蒙古农业大学学报, 2012(33):5-6.
[17] Stockinger EJ, Gilmour SJ, Thomashow MF. Arabidopsis thaliana CBF1 encodes an AP2 domain containing transcription activator that binds to the C-repeat /DRE, a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit[J]. Proc Natl Acad Sci USA, 1997, 94:1035-1040.
[18] Lata C, Prasad M. Role of DREBs in regulation of abiotic stress responses in plants[J]. J Exp Bot, 2011, 62(14):4731-4748.
[19] Li XP, Tian AG, Luo GZ, et al. Soybean DRE-binding transcription factors that are responsive to abiotic stresses[J]. Theor Appl Genet, 2005, 110(8):1355-1362.
[20] Srivastav A, Mehta S, Lindlof A, et al. Over-represented promoter motifs in abiotic stress-induced DREB genes of rice and sorghum and their probable role in regulation of gene expression[J]. Plant Signal Behav, 2010, 5(7):775-784.
(责任编辑 马鑫)
Cloning and Expression Analysis of AmDREB2.1 in Ammopiptanthus mongolicus
Li Zhanglei Gao Fei Cao Yuzhen Zhang Zhiwei Wang Ning Li Huayun Zhou Yijun
(College of Life and Environmental Sciences,Minzu University of China,Beijing 100081)
A new dehydration responsive element binding protein(DREB)transcription factor gene, which was named as AmDREB2.1,was isolated from Ammopiptanthus mongolicus(Masxim.)(Cheng f.)root transcriptome database, that it had been established in our previous work. The full length of the AmDREB2.1 cDNA was 978 bp, including a single 531 bp opening reading frame which encoded a 176-amino acid peptide with a conserved AP2 domain. Quantitative real-time PCR analysis revealed that the AmDREB2.1 expressed in leaf and root of A. mongolicus, but there were different expression patterns under drought or low temperature stress respectively, and it could be mainly induced by drought in root.
Ammopiptanthus mongolicus;AmDREB2.1;sequence analysis;expression pattern
10.13560/j.cnki.biotech.bull.1985.2015.04.015
2014-08-20
国家自然科学基金项目(31370356),中央民族大学一流大学一流学科建设项目(YLDX01013),国家大学生创新训练项目(GCCX2013110015),中央民族大学研究生科研创新项目(K2014044)
李章磊,男,硕士,研究方向:植物分子生物学;E-mail:lizhanglei2008@126.com
周宜君,女,博士,教授,研究方向:植物分子生物学;E-mail:queenzhou@263.net
