甘草多糖对小麦叶片膜损伤的保护作用
2015-10-26杨小峰侯梦雪李志英
杨小峰,侯梦雪,李志英
(忻州师范学院生物系,山西忻州034000)
甘草多糖对小麦叶片膜损伤的保护作用
杨小峰,侯梦雪,李志英
(忻州师范学院生物系,山西忻州034000)
研究甘草多糖对盐胁迫导致的小麦幼苗叶片脂膜损伤的保护作用及其对相关酶活性的影响.实验使用微波提取法提取甘草中的甘草多糖,采用对照实验法比较未受到胁迫、受到盐胁迫和受到盐胁迫并加入了甘草多糖的小麦叶片的电导率、MDA的含量和SOD、CAT、POD活性的差异.结果显示甘草多糖对膜损伤和相关酶具有保护作用.研究结果可为合成、改造膜质保护剂提供理论依据.
甘草多糖;膜损伤;盐胁迫
甘草(Glycyrrhiza uralensis Fisch)为豆科,多年生草本植物,是我国传统中药,具有止咳、祛痰、解毒等作用,在食品、冶金、畜牧等方面有广泛的应用.甘草多糖为甘草重要的活性成分之一,具有免疫调节作用、抗肿瘤、抗病毒等作用[1].小麦是我国三大粮食作物之一,受高浓度的盐环境作用导致植物的离子失衡和高渗胁迫,从而影响种子正常萌发和幼苗的正常生长.
目前,人们对甘草多糖作用的研究主要集中在动物方面,对植物方面则很少.本文通过研究甘草多糖对盐胁迫导致的小麦幼苗叶片脂膜损伤的保护作用,为探讨甘草多糖与植物抗盐性间的关系和合成、改造脂膜保护剂提供参考.
1 实验部分
1.1主要仪器与试剂
仪器:SP-723型可见分光光度计(上海光谱仪器有限公司);UV-1800型紫外可见分光光度计(上海精密仪器仪表有限公司);800型电动离心机(江苏金坛市金城国胜实验仪器厂);DDS-11A数显电导仪(上海虹益仪器仪表有限公司).
试剂:2-硫代巴比妥酸(AR,国药集团化学试剂有限公司),焦性没食子酸(AR,中国贵州遵义市建强化工厂),愈创木酚(AR,南开大学精细化学试验厂),三氯乙酸(AR,天津市光复精细化学研究所),乙二胺四乙酸(AR,天津市天新精细化工开发中心),三羟甲基氨基甲烷(Tris)(AR,天津市申泰化学试剂有限公司),浓盐酸(天津市耀华化学试剂责任有限公司),实验用水为二次重蒸馏水;实验用的小麦为冀麦10号.
1.2实验方法
1.2.1甘草多糖的提取
粉碎甘草,用孔径为0.1 mm的土壤筛进行筛选,得到细度范围为0.1 mm的甘草粉末.称取1.0000 g,按1∶30的料液比加80%乙醇,室温浸泡1 h,微波提取(500 W,4 min),抽滤,得到的滤渣按1∶30的料液比加入水,再次微波处理后抽滤.合并两次滤液,活性炭脱色30 min,抽滤,滤液加等体积乙醇进行醇析,再抽滤,滤液再加3倍体积的乙醇进行醇析,抽滤.滤液经旋转蒸发仪浓缩,到粘稠为止,最后于60℃干燥,称重[2],得到提取率1.63%.
1.2.2小麦的种植及酶液的提取
挑选饱满度一致的小麦种子.用0.1%的HgCl2溶液消毒10 min,然后用蒸馏水冲洗三遍.在自然条件下风干,备用[3].小麦置于铺有湿滤纸的培养皿中(蒸馏水浸透),12 h光照/12 h黑暗,25℃恒温条件下培养5天.选择生长良好且高度一致的小麦幼苗进行处理,处理条件如下:(1)蒸馏水培养(对照);(2)5% NaCl培养;(3)5%NaCl并加入提取出的甘草多糖0.1000 g培养.3天后,对小麦幼苗进行相关指标的测定[3].
称取组织1.0000 g放于研钵中,加5 mL 0.05 mol/L的磷酸缓冲液(pH=5.5)在冰浴中研磨成匀浆.将匀浆全部转入离心管中,在3000 rpm,4℃条件下离心10 min,上清液为酶粗提液,4℃保存备用.
1.2.3植物叶片相对电导率测定的方法
采用浸泡法.每组取大小相当的幼苗叶片若干(尽量保证叶片的完整性,少含茎节),用自来水洗净后,再用蒸馏水冲洗3次.用滤纸吸干表面水分后,将叶片剪成适宜长度的长条(避开主脉).分组称取鲜样3份,每份0.1 g,分别置于10 mL去离子水的刻度试管中,盖上玻璃塞置于室温下浸泡处理12 h.用电导率仪测定浸提液电导率(R1);然后沸水浴加热30 min,冷却至室温后摇匀,再次测定浸提液电导率(R2)[4].
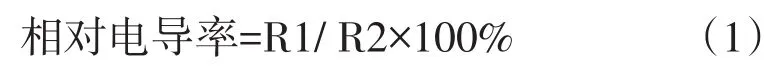
1.2.4丙二醛(MDA)含量测定的方法
丙二醛(MDA)含量的测定采用硫代巴比妥酸法测定[5].计算公式见式(2):
1.2.5超氧化物歧化酶(SOD)活性测定的方法
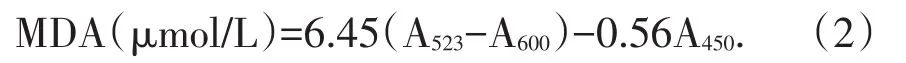
SOD的活性测定是基于经典的分光光度法,碱性条件下,邻苯三酚自氧化成红桔酚,然后用紫外-可见光谱跟踪波长为325 nm、420 nm或650 nm(经典为420 nm),产生O2,SOD催化O2发生歧化反应进而抑制邻苯三酚的自氧化,样品对邻苯三酚自氧化速率的抑制率,可反映样品中SOD的活性[6].

ASOD为吸光度.
1.2.6过氧化氢酶(CAT)活性测定的方法
过氧化氢在240 nm波长下有强烈吸收,过氧化氢酶能分解过氧化氢,使反应溶液的吸光度(A240)随反应时间而降低.加入0.1 mol/L的H2O2,每加完1管后立即记时,在260 nm下测定吸光度,每隔1 min读数1次,共测4 min.根据测量吸光率的变化速度即可测出过氧化氢酶的活性[7].

As0:加入失活酶液的对照管吸光值;As1,As2:样品管吸光值;Vt:粗酶提取液总体积(mL);Vl:测定用粗酶提取液体积(mL);FW:样品鲜重(g);0.1∶A240每下降0.1为1个酶活单位(μ);t:过氧化氢到最后一次读数时间(min).
1.2.7过氧化物酶(POD)活性测定的方法

在37℃水浴中混合均匀,于470 nm处测定其吸光度,连续记录3 min.以不加酶的反应混合液作对照,每30 s读一次数[8].

式中△A:吸光度;w:鲜重(g);t:反应时间(min);D:总酶液为反应系统内酶液倍数.
2 结果与讨论
2.1植物叶片相对电导率的测定
相对电导率是反映植物膜系统状况的一个重要的生理生化指标,植物在受到逆境或者其他损伤的情况下细胞膜容易破裂,膜蛋白受伤害因而使胞质的胞液外渗而使相对电导率增大,其反映直接实际,是一个比较有用的数据.
由表1可以明显看出,小麦经过盐胁迫后叶片的相对电导率比没有经过盐胁迫的小麦叶片的相对电导率增大了很多,受到盐胁迫并加入了甘草多糖的小麦叶片的相对电导率比未加入甘草多糖的小.盐胁迫对植物造成渗透胁迫,引起细胞失去水分,增大细胞膜透性,同时随着电解质外渗的增加从而导致电导率的提高.受到盐胁迫的小麦细胞膜透性增大,加入甘草多糖减少盐胁迫的小麦细胞膜透性的增大.由此可以得知甘草多糖对小麦细胞膜受到损伤后的透性有降低的作用.

表1 植物叶片相对电导率的比较Tab.1Comparison of relative electrical conductivity of plant leaves
2.2丙二醛(MDA)含量的测定
植物在逆境下与活性氧积累诱发的膜脂过氧化物,如二烯轭合物、脂类过氧化物、丙二醛、乙烷等,其中丙二醛(MDA:Malondialdehyde)含量与膜脂过氧化密切相关,因此可通过测定MDA来评估了解膜脂过氧化的程度,以间接测定膜系统受损程度.
从表2中的数据可以看出这三组对照的MDA含量依次是:空白对照<5%NaCl+甘草多糖<5%NaCl.可知受到盐胁迫的小麦的细胞膜受到的损伤最严重,在加入甘草多糖的受到盐胁迫的小麦的膜脂过氧化减轻,细胞膜所受到的的损伤减轻.表明甘草多糖对膜脂过氧化有减轻的作用,即对细胞膜的损伤有保护作用.
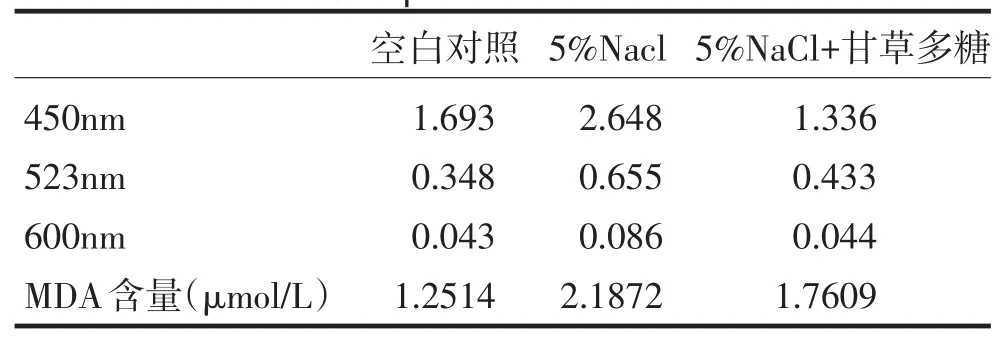
表2 丙二醛含量的比较Tab.2Comparison of MDA content
2.3相关酶活性(POD)的测定
植物组织中SOD、CAT、POD的活性与植物的抗逆性密切相关.
SOD是生物体内清除自由基的首要物质.SOD能催化生物体内超氧自由基(O2-)发生歧化反应,是机体内O2-的天然消除剂,对机体细胞起保护作用.由表3可知,加入了甘草多糖的小麦中的SOD活性比没有加入的大.因此得出结论:甘草多糖的加入使由盐胁迫所引起的SOD活性的降低得到了很好的恢复,甘草多糖对小麦体内SOD的活性有保护作用.
从表3数据可知CAT和POD的活性:空白对照>5%NaCl+甘草多糖>5%NaCl,盐胁迫使小麦体内活性氧的过量生产、积累而打破了小麦体内的平衡,活性氧导致膜过氧化和脱脂化从而使细胞结构和功能受到破坏并最终抑制了CAT和POD的活性.

表3 几种酶活性的比较Tab.3Comparison of several enzyme activities
3 结论
本实验采用微波提取法提取甘草中的甘草多糖,培养了未受到盐胁迫、受到盐胁迫及受到盐胁迫并加入了提取的甘草多糖的三种小麦,测定了小麦叶片的相对电导率,叶片中MDA的含量和SOD、CAT、POD的活性.同样受到盐胁的小麦,加入了甘草多糖小麦的叶片的电导率较低、叶片中的MDA含量较低,SOD、CAT、POD的活性较高,可以得知甘草多糖对膜损伤具有保护作用,并对相关生物酶具有保护作用.
[1]方热娜·卡斯木,丛媛媛,等.胀果甘草多糖的分离纯化及其理化性质[J].华西药学杂志,2008,23(4):448-450.
[2]张海艳.微波提取甘草多糖工艺的优化研究[J].湖北农业科学,2011,50(4):818-820.
[3]杨艳丽,韩榕.Ca2+对小麦萌发及幼苗抗盐性的效应[J].植物学报,2011,46(2):155-161.
[4]陈爱葵,韩瑞宏,李东洋,等.植物叶片相对电导率测定方法比较研究[J].广东教育学院学报,2010,30(5):88-91.
[5]易运连,饶汉珍,汤爱国.黄褐斑患者血中超氧化物歧化酶活性、丙二醛和维生素C、E含量的测定[J].临床皮肤科杂志,2000,21(6):98-100.
[6]许雅娟,赵艳景,胡虹.邻苯三酚自氧化法测定超氧化物歧化酶活性的研究[J].西南民族大学学报:自然科学版,2006,32(6):1207-1212.
[7]李仕飞,刘世同,周建平,等.分光光度法测定植物过氧化氢酶活性的研究[J].安徽农学通报,2007,46(2):111-113.
[8]周远明,刘均洪.过氧化物酶活性检测方法的研究[J].河北化工,2003,22(1):458-460.
责任编辑:刘红
Protective Effect of Glycyrrhiza Polysaccharide on Wheat Leaf Membrane Damage
YANG Xiaofeng,HOU Mengxue,LI Zhiying
(Department of Biology,Xinzhou Teachers Normal University,Xinzhou 034000,China)
This essay is about protective effect of Glycyrrhiza polysaccharide on wheat seedling leaves lipid membrane damage caused by salt stress.Microwave extraction method was is used to extract licorice polysaccharide from licorice.We use the controlled experiments to make a comparison of diversity for the wheat blades'conductivity,MAD content,SOD ac⁃tivity as well as the pod content,blades cultivated by salt stressed,non-salt stressed and salt stressed with the licorice poly⁃saccharide.By comparison,the measured results can show that licorice polysaccharide has a protective effect on membrane damage,and licorice polysaccharide has a protective effect on related enzymes.This study can provide the theoretical basis for synthesize and make the membranous protective agent.
licorice polysaccharide;membrane damage;salt stress
S 19
A
1674-4942(2015)04-0418-03
2015-11-10
