磁性阳离子吸附树脂在双水相体系中分离神秘果蛋白的研究
2015-10-26姜伟马艺丹闫瑞昕廖小伟戚金玲马思聪薛秉祥刘红
姜伟,马艺丹,闫瑞昕,廖小伟,戚金玲,马思聪,薛秉祥,刘红,2*
(1.海南师范大学化学与化工学院,海南海口571158;2.海口市热带特色药食同源植物研究与开发重点实验室,海南海口571158)
磁性阳离子吸附树脂在双水相体系中分离神秘果蛋白的研究
姜伟1,马艺丹1,闫瑞昕1,廖小伟1,戚金玲1,马思聪1,薛秉祥1,刘红1,2*
(1.海南师范大学化学与化工学院,海南海口571158;2.海口市热带特色药食同源植物研究与开发重点实验室,海南海口571158)
利用磁性阳离子吸附树脂与双水相体系联用对神秘果蛋白进行分离和纯化.探究了溶液pH值、离子强度和吸附速率对羧基改性粒子吸附神秘果蛋白能力的影响,并考察了双水相的组成、溶液pH和氯化钠质量分数对该体系萃取神秘果蛋白效果的影响.结果表明,当羧基改性粒子在溶液pH值为4.9,且不加氯化钠时,吸附神秘果蛋白效果最佳.双水相体系中,当PEG 4000质量分数为16%,(NH4)2SO4质量分数为8%时,该双水相体系对神秘果蛋白的萃取效果最佳.联合两种方法,经紫外分光光度法测定,从25 g冻干神秘果果肉中,提取出了30 mg的神秘果蛋白.
磁性树脂;双水相;神秘果蛋白
神秘果(Synsepalum dulcificum)属于山榄科热带常绿灌木,又称变味果,它的果肉中含有奇特的变味糖蛋白,能改变人的味觉,使原本酸味食物变得甘甜[1].种子含有天然固醇和多种微量矿物元素[2].近年来,对神秘果植物的研究获得了较大的成果,早期的探究热点主要集中在对神秘果蛋白的结构、功能及其在转基因植物上的表达[3],对神秘果蛋白的提取方法研究较少.一般提取蛋白的方法有透析法、离心分离法、溶剂沉淀法和色谱法[4].若想提高神秘果蛋白的纯度,一般将以上几种方法联合使用[5].对于一般生物样品来说,蛋白质的分离是比较困难的,因为它们的浓度范围较大而且不均匀[6].磁性颗粒具有良好的生物相容性和超顺磁特性,其表面可以通过改性附加多种活性官能团,在蛋白质吸附和亲和力的相互作用中起重要作用[7].外部磁场很容易地从样品中分离蛋白质,无需离心分离或过滤的复杂过程,因此,在目标分子的快速和选择性分离上具有一定优势[8].
双水相系统(ATPS)是由不同的水溶性聚合物,或一种单一的聚合物和特定盐的水溶液混合物组成[9].因为双水相中的两相含有水超过70%,可用于蛋白质和其他生物分子的分离纯化.双水相萃取,一般用PEG/盐体系进行选择性分离和富集生物分子,这个方法简单、快捷、方便、成本低[10-11].Gai等将双水相萃取应用在蛋白质上,如人类唾液中蛋白质的选择性分离和富集,以及血清蛋白,人类免疫球蛋白的纯化,人体尿液中蛋白质的定量提取等[12].
本实验利用羧基改性磁性粒子吸附法结合双水相萃取的方法用于提取神秘果蛋白.根据其等电点,溶液的pH和离子强度进行吸附.通过磁性阳离子交换剂和PEG/硫酸胺双水相体系萃取分离神秘果蛋白.
1 材料与方法
1.1原料与试剂
1.1原料
神秘果采自海南省保亭县,经海南师范大学生命科学学院钟琼蕊老师鉴定为山榄科植物神秘果.将神秘果果实去皮及种子,取其果肉经冷冻干燥、粉碎,备用.
1.2试剂
纳米四氧化三铁(99.5%20 nm);油酸(AR);乙醇(95%);苯乙烯(St,AR),交联剂二乙烯苯(DVB,80%);引发剂偶氮二异丁腈(AIBN,99%);聚乙烯醇(PVA,AR);次甲基蓝溶液;硝酸银;98%浓硫酸;PEG4000(AR);硫酸铵(AR);临时配制Tris-HC1缓冲液(0.05 mol/L,25℃);考马斯亮蓝(BR);
1.2仪器
TU—3900双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);iChrom 5100高效液相色谱仪(大连依利特分析仪器有限公司);HY-5A回旋振荡器(金坛市金楠仪器制造有限公司);DHG-907A电热恒温鼓风干燥箱(上海申贤恒温设备厂);800电动离心机(常州澳华仪器有限公司);DF-101S集热式磁力加热搅拌器(金坛市金南仪器制造有限公司);HH-1数显恒温水浴锅(江苏智博瑞仪器制造有限公司);XO-5200DTS超声波清洗机(南京先欧仪器制造有限公司);
1.3神秘果粗蛋白的提取
采摘新鲜神秘果,去除种子后得到果肉,经冷冻干燥后研磨处理,得到细微的神秘果粉.通过凯氏定氮法测定其粗蛋白的含量.
称取神秘果粉,加入0.02 mol/L Tris-HCl缓冲液,振荡,离心.计算提取率(粗蛋白提取率=粗提液中蛋白质质量/果粉中蛋白质质量).
1.4制备磁性阳离子交换剂
1.4.1油酸修饰改性
取0.5 g纳米Fe3O4通过超声振荡均匀的分散至50 mL蒸馏水中形成纳米Fe3O4溶胶,将16 mL油酸与30 mL纳米Fe3O4溶胶混合,在75℃水浴恒温反应40 min,冷却至室温,静置,待溶液分层,纳米Fe3O4粒子被油酸萃取出来,分布在溶液上层,然后自然烘干48 h,得到羧基改性的纳米Fe3O4粉末.
最佳物质的量之比,由表1可知:n(油酸)∶n(Fe3O4)=96∶1[12].即此时Fe3O4粒子表面被油酸完全包裹.

表1 不同体积的油酸和EDTA对Fe3O4溶胶萃取率的影响Tab.1Influence of different volume of oleic acidand EDTA on extraction by Fe3O4sol
1.4.2聚苯乙烯包覆试验
将10 g苯乙烯(St),0.2 g二乙烯苯(DVB)和0.375 g偶氮二异丁腈(AIBN)加入到20 0mL圆底烧瓶中,安装温度计和回流装置,添加改性纳米Fe3O4磁性微粒,N2保护,搅拌1 h.将0.25 g PVA溶解于超纯水并滴入5滴次甲基蓝溶液,边搅拌边缓慢加入到上述烧瓶中.水浴恒温80℃反应10 h,并用氮气保护,得到的产物用蒸馏水洗涤三次,干燥后称重.
1.4.3浓硫酸磺化反应
取上述产物5 g加入到200 mL圆底烧瓶中,再加入0.25 g AgNO3,加热,温度上升到75℃,缓慢滴加浓硫酸60 mL,当温度升高至80℃,保持反应40 min后,静置15 min,将磺化产物进行过滤,用大量蒸馏水洗涤至pH为7左右,然后过滤,抽干.
1.5磁性树脂对神秘果蛋白吸附量影响因素测定实验
考察pH值对吸附量的影响:取磁性聚合物颗粒3.0 mg分散到0.02 mol/L Tris-HCl缓冲液中直至平衡,然后添加3 mL 0.5 mg/mL的蛋白质溶液中,溶液pH范围在6.0-9.5.在25℃下,用回旋振荡器振荡15 min,然后用磁铁分离磁性颗粒.通过紫外分光光度计在278 nm处测定剩余溶液的上清液中蛋白质的浓度.
考察离子强度对吸附量的影响,取磁性颗粒3.0 mg分散到0.02 mol/L Tris-HCl缓冲液中直至平衡,然后加入3 mL 0.5 mg/mL蛋白质溶液,在不同浓度的NaCl溶液范围内(0.05~0.5 mol/L),室温下振荡器中振荡10 min.通过紫外分光光度计测定上清液中蛋白质残留浓度.
考察改性后磁性粒子对吸附量的影响:取磁性颗粒3.0 mg分散到0.05 mol/L Tris-HCl缓冲液中直到平衡,然后加入3 mL 0.5 mg/mL蛋白质溶液,重复上述步骤,用裸露的纳米四氧化三铁在相同条件下进行测定.
磁性颗粒的动力学吸附研究:取磁性颗粒3.0 mg分散到0.05 mol/L Tris-HCl缓冲液中直到平衡,然后加入3 mL 1 mg/mL蛋白质溶液,室温震荡10 min培育期间,颗粒由外部磁场在间隔10 min内进行分离.吸附量计算公式如下:

C0为初始浓度(mg/mL),Ct为最终浓度(mg/mL),V为混合物体积(mL),m为磁性粒子质量(g).
1.6双水相的制备
1.6.1制备双水相
PEG4000(1.7647 g)和(NH4)2S04(6.7340 g)分别加入到10 mL水,然后各取10 mL震荡离心形成双水相并用移液管获得两相体积.最后得到含15% PEG4000和10%(NH4)2S04的双水相溶液.若添加蛋白质溶液,分别计算:
相比R=上相体积/下相体积
蛋白质分配系数Kp=上相蛋白质的浓度/下相蛋白质的浓度
1.6.2PEG4000/(NH4)2S04双水相相图的绘制
向100 mL烧杯滴加定量的质量分数为15%的聚乙二醇4000溶液,接着滴加质量分数为10%的硫酸铵水溶液,记录溶液质量,离心,直到出现混浊状态,记录硫酸铵水溶液的质量,然后滴加一定量的超纯水,震荡后,重新出现澄清状态,记录此时混合物质量;反复进行如上操作得到数个独立的点,即可得该体系相图.
1.7磁性粒子和双水相的结合
取5.0 mg神秘果蛋白质溶液加到1.5 g双水相溶液中,然后震动离心分离.结果显示顶部和底部各自混入羧基改性的磁性微粒,最后,磁性粒子由外部磁场分离,蛋白质主要集中于双水相的上部,其含量用高效液相色谱法测定.
1.8高效液相色谱法分析测定神秘果蛋白含量
采用TSK-TMS 250色谱柱(4.6*75 mm),流动相:20%乙腈(ν/v),0.05%三氟乙酸.采用线性梯度洗脱蛋白质(乙腈20-70%).溶剂流速为0.5 mL/min,保留时间为60 min,样品注入量为10 uL,柱温为25℃. 278 nm波长的吸光度测定样品的浓度.
2 结果与讨论
2.1对改性后磁性粒子的表征
从电镜图(图1a)可以看出,未改性的纳米F3O4似乎是球形的,其直径约为200 nm,这与使用相同的制备方法获得的颗粒粒径一致.与图1b和c比较,可以清楚地观察到该羧基改性的磁性颗粒的表面上有特定形状的聚合物外壳和特定光对比度的结构,此聚合物外壳的平均厚度约为50 nm.
2.2磁性离子对神秘果蛋白的吸附
采用羧基改性的磁性颗粒,考察了不同因素对蛋白质吸附量的影响,其吸附量取决于蛋白质的等电点、溶液的pH和离子强度.
2.2.1pH值的影响
在吸附过程中,溶液的pH值是直接影响羧基的离解度和蛋白质带电性质的重要的因素之一.当溶液的pH值为6.0~9.5时,羧基改性磁性颗粒对神秘果蛋白有吸附作用(神秘果素的等电点约为9).如图2所示,当溶液的pH值低于其等电点时,对蛋白质有一个明显的吸附作用.这些蛋白质的吸附现象与离子交换吸附的静电相互作用机制是一致的.因此,溶液的pH值和蛋白质等电点以及羧基改性的磁性颗粒对蛋白质的吸附有至关重要的作用.裸露的Fe3O4呈现出较弱的非特异性吸附,由于几个羧基存在于它的表面,其吸附能力随pH增大而变小.
2.2.2离子强度的影响
离子强度的影响对神秘果蛋白的吸附量影响,如图3所示,当氯化钠浓度高于0.1mol/L时,磁性粒子吸附力降低较慢.在氯化钠浓度为0.2 mol/L时,磁性粒子对神秘果蛋白的吸附量迅速降低到7%.当氯化钠浓度高于0.4 mol/L时,几乎不吸附,原因是该离子强度破坏了蛋白质与-COO-之间的静电相互作用.因此,磁性颗粒对蛋白质的吸附受含氯化钠浓度和溶液的离子强度的影响较为显著.同样地,裸露的纳米四氧化三铁对神秘果蛋白的吸附能力并没有随着离子强度的增加而发生明显变化.

图1 a为裸露的纳米F3O4,b、c为羧基修饰改性的纳米F3O4的扫描电子显微镜图Fig.1SEM images of bare F3O4(a)and carboxyl modlfled F3O4(b,c)

图2 溶液pH对神秘果蛋白吸附量的影响Fig.2Influence of pH in the solution on mysteriousfruit protein adsorption
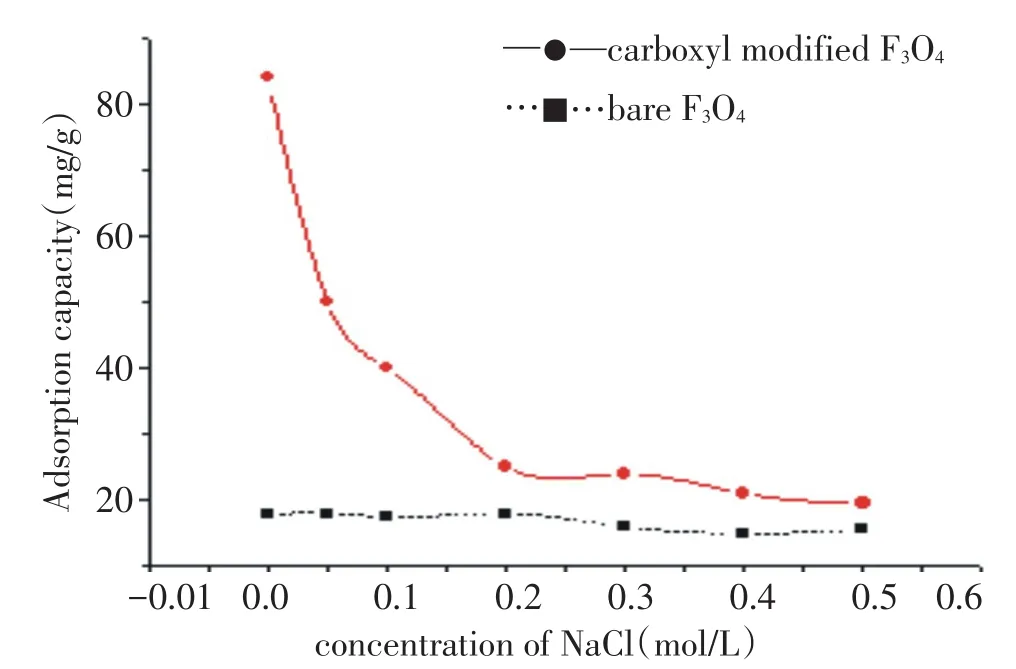
图3 离子强度神秘果蛋白吸附力的影响Fig.3Influence of ionic strength on mysterious fruit protein adsorption
2.2.3吸附速率
根据动力学对磁性粒子在分离蛋白质过程中的吸附率进行了研究,优化神秘果蛋白吸附溶液的pH值后,磁性粒子的吸附能力迅速增加,蛋白质的吸附量达到77%(见图4).时间越长吸附速率减慢,并最终在20 min达到吸附平衡.因此,此方法适合于该蛋白质的快速分离.

图4 羧基改性后的磁性粒子对神秘果蛋白的吸附力与时间的关系Fig.4Relationship between time and adsorptioncapacity for mysterious fruit protein in carboxyl modified magnetic particles
2.3双水相的组成及萃取影响因素的分析
2.3.1PEG4000/(NH4)2SO4双水相组成条件分析
由于盐析作用,亲水性高聚物与无机盐在水中达到一定浓度时,才能形成两相.双水相形成的条件和定量关系可用相图表示,只有当成相组分的配比在曲线的上方时,才能自动分为两相.该相图如图5所示,当PEG溶液的质量分数为16%时,若使之形成双水相,且实验操作方便,硫酸铵的用量取6.0%、7.0%、8.0%、9.0%、10.0%.

图5 PEG4000/(NH4)2SO4双水相体系相图Fig.5PEG4000/(NH4)2SO4aqueous two-phase system diagram
2.3.2(NH4)2SO4质量分数对神秘果蛋白萃取量的影响
在pH值为4.0、聚乙二醇4000溶液的质量分数为16.0%,先加入热熔法制备的磁性阳离子交换剂,再加入神秘果蛋白质溶液1.0 mL,分别用6.0%、7.0%、8.0%、9.0%、10.0%的硫酸铵溶液组成双水相体系,离心分离并计算相比R和分配系数Kp.
由表2可以得到,随硫酸铵量的增加,相比值R减小.当硫酸铵溶液浓度为8.0%(ω/ω)时,神秘果蛋白的分配系数Kp达到最大值1.46.当硫酸铵溶液浓度大于8.0%(ω/ω)时,由于盐析效应使得神秘果蛋白的分配系数Kp开始下降.因此,选定萃取神秘果蛋白的最佳硫酸铵溶液的质量分数为8.0%.
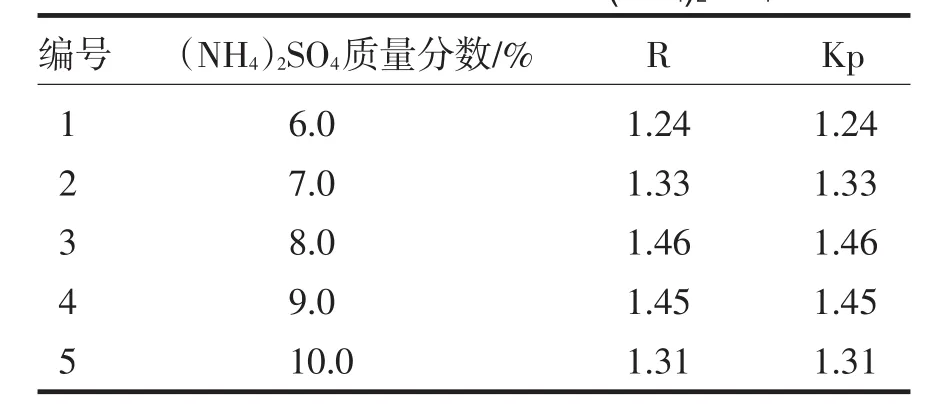
表2 (NH4)2SO4质量分数对神秘果蛋白萃取量的影响Tab.2Mysterious fruit protein extraction rateaffected mass fraction of(NH4)2SO4
2.3.3聚乙二醇4000质量分数的影响
在pH值为4.0,硫酸铵溶液质量分数为8%,先加入热熔法制备的磁性阳离子交换剂,加入神秘果蛋白溶液1.0 mL,使用10.0%、13.0%、16.0%、19.0%和22.0%的聚乙二醇溶液组成双水相体系,离心分离并计算R和Kp.
由表3可以得到,当硫酸铵溶液的质量分数为8%时,随着聚乙二醇质量分数的增加,相比R逐渐增大,而Kp则呈现出先增大后减小的趋势.因此,选定萃取神秘果蛋白的最佳聚乙二醇溶液的质量分数为16.0%.

表3 聚乙二醇4000质量分数对萃取的影响Tab.3Influence of mass fraction of PEG 4000 on mysterious fruit protein extraction
2.3.4pH值对萃取的影响
在聚乙二醇溶液质量分数为16.0%(ω/ω),硫酸铵溶液浓度为8.0%(ω/ω),先加入热熔法制备的磁性阳离子交换剂,再加入神秘果蛋白质溶液1.0mL,改变pH值形成不同的双水相体系,离心分离并计算R和Kp.
根据表4可以得知,pH对相比R的波动幅度不大,分配系数则呈现出先增加后减小的趋势,当pH为4.90时,分配系数达到最大值1.26.因此,以pH值为4.90最好.
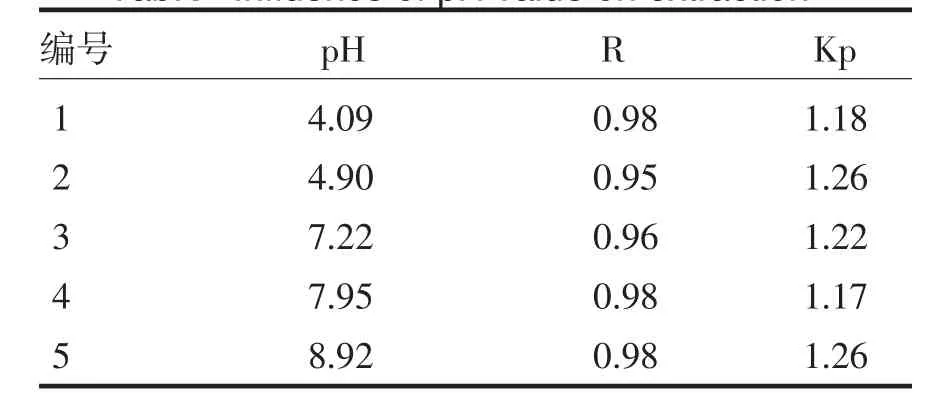
表4 pH对萃取的影响Tab.4Influence of pH value on extraction
2.3.5氯化钠质量分数的影响
在PEG4000溶液的质量分数为16.0%,(NH4)2SO4溶液的质量分数为8.0%,pH 4.90,先加入热熔法制备的磁性阳离子交换剂,加入神秘果蛋白溶液1.0 mL,改变氯化钠的浓度组成不同的双水相体系,离心分离并计算R和Kp.
由表5可知,该萃取体系随NaCl溶液的质量分数的增加,相比减小,在NaCl溶液的质量分数为2%时,神秘果蛋白质分配系数达到最大,因NaCl对神秘果蛋白质的分配系数的增长并不明显,故该体系不添加NaCl.

表5 NaCl质量分数对神秘果蛋白萃取的影响Tab.5Influence of NaCl concentration on mysterious fruit protein extraction
2.4高效液相色谱法分析神秘果蛋白含量
经液相色谱分析,神秘果蛋白在乙腈体积分数为45%时被洗脱出来,如图6所示,该蛋白样品中产生了尖锐的单峰.由文献可知[13],此保留时间在23 min附近的单一峰,即为神秘果蛋白的吸收峰,说明提取的神秘果蛋白的纯度较高.通过测定278nm处的吸光度可知,采用上述方法,从25g的新鲜神秘果果肉中得到了30 mg的神秘果蛋白.
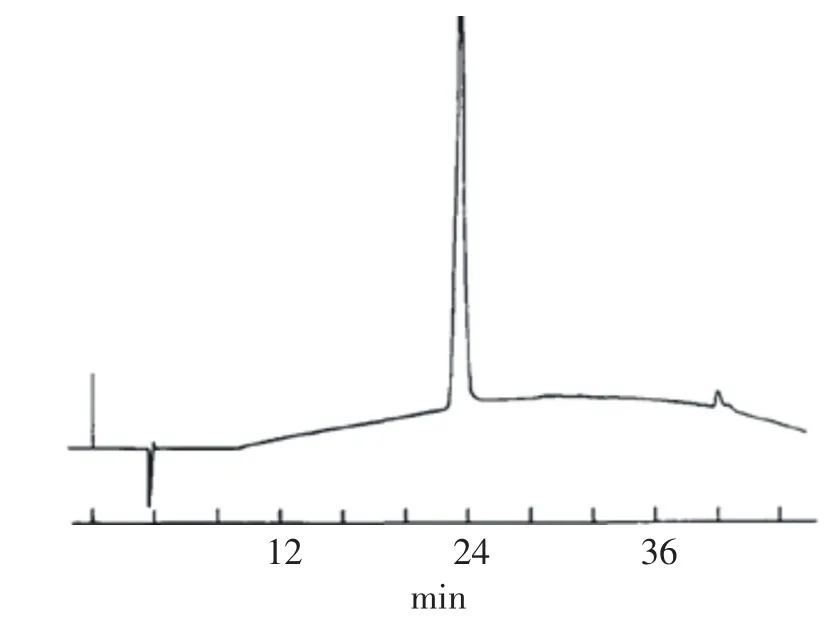
图6 神秘果素的液相色谱图Fig.6The liquid chromatogram of Miraculin
如图6所示,蛋白质样品中产生了尖锐的单峰.通过上述方法,从25g的新鲜神秘果果肉中得到了30 mg的神秘果蛋白.
3 结论
蛋白质在混合物中受静电而吸附,可通过使用羧基改性的磁性粒子和简单的溶液的pH值调节分开.在磁性粒子吸附前,探究了双水相萃取对神秘果[13]蛋白的选择性分离.羧基改性后的磁性粒子和双水相的结合,不仅可以快速和有选择性的吸附蛋白质,也可以对蛋白质进行富集.此外,由于羧基改性粒子和双水相的种类较多,磁性吸附和双水相萃取的组合可在复杂样品中得到更广泛的应用.这种磁吸附和双水相萃取的结合是简单快速的分离方法.其组合包括在液—固吸附,液—液萃取和磁性分离,这可能在蛋白质的分离方法上有很大的前途.
[1]齐赛男,贾桂云,雷鹏,等.神秘果种子挥发油化学成分的气相色谱-质谱分析[J].海南师范大学:自然科学版,2012,25(1):73-78.
[2]姜伟,马艺丹,闫瑞昕,等.三种果粉中矿物质和淀粉含量的测定及抗氧化性研究[J].海南师范大学:自然科学版,2015,25(3):280-283.
[3]Sarroch T,Yoshie K.Complete Purification and Character⁃ization of the Taste-modifying Protein,Miraculin,from Miracle Fruit[J].The Journal of Biological Chemistry,1988,263(23):11536-11539.
[4]刘成伦,梁廷霞.神秘果素的研究进展[J].食品研究与开发,2008,3(29):147-150.
[5]PAN L P,YU S L,LI H H.Studies on miraculin,a tastemodifying protein[J].Science&Technology Review,2009,27(3):99-101.
[6]LIU C L,LIANG T X.Research progress on miraculin[J]. Food Research and Development,2008,29(3):147-150.
[7]林本兰,沈晓冬,崔升.纳米四氧化三铁磁性微粒的表面有机改性[J].无机盐工业,2006,3(38):19-23.
[8]Inglett G E,Dowling B,Albrecht J J,et al.Taste-Modifying Properties of Miracle Fruit(Synsepalum dulcificum)[J].J Agr Food Chem,1965,13(3):284-287.
[9]Girous E L,Henkin R I.Purification and Some Properties of Miraculin,a Glycoprotein from Synsepalum dulificum Which ProvokesSweetness and Blocks Sourness[J].J Agr Food Chem,1974,22(4):595-601.
[10]Fukushima F M,Guthridge M A,McColl S R,et al.A sen⁃sitive magnetic bead method for the detection and identifi⁃cation of tyrosine phosphorylation in proteins by MALDITOF/TOF MS[J].Proteomics,2009,9:3047-3057.
[11]马艺丹,刘红,廖小伟,等.神秘果种子多酚超声双水相复合提取工艺及其抗氧化活性[J].食品与机械,2015,31(6):173-178.
[12]Gai Q Q,Qu F,Liu Z J,et al.J Preparation and adsorption properties of novel magnetic tetrabromobisphenol a molec⁃ularly imprinted composite material based on graphene ox⁃ide surface[J].Chromatogr A,2010,1217(31):5035-5042.
[13]Kurihara K,Beidler L M.Mechanism of the Action of Taste-modifying Protein[J].Nature,1969,222(6):1176-1179.
责任编辑:毕和平
Integration of Carboxyl Modified Magnetic Particles and Aqueous Two-phase Extraction for Selective Separation of Miraculin
JIANG Wei1,MA Yidan1,YAN Ruixin1,LIAO Xiaowei1,QI Jinling1,MA Sicong1,XUE Bingxiang1,LIU Hong1,2*
(1.College of Chemistry and Chemical Engineering,Hainan Normal University,Haikou 571158,China;2.Haikou Key Laboratory of Research and Development on Topical and Special Medicine and Edible Plant,Haikou 571158,China)
A new extraction method of separation and purification on Miraculin by magnetic particles associated with aque⁃ous two-phase extraction technique(ATPE)was explored.The pH value and ionic strength in the solution,also adsorption rates were examined for the impact on mysterious fruit protein adsorption ability in carboxyl-modified particles.The phase⁃forming salt,pH and Nacl concentraton were explored for extration rate of miraculin by ATPE.The results showed that if the carboxyl-modified particles were in a solution with 4.9 of pH without sodium chloride,the adsorbing rate about protein from mysterious fruit was the best.The optimal contiondition of aqueous two-phase systems for protein extraction efficiency were 16%of PEG 4000,8%of(NH4)2SO4,and 4.9 of the pH value.30 mg of Miraculin determined by UV spectrophotometry were successfully obtained from 25 g freeze-dried fruit pulp with comprehensive two kinds of extraction methods.
magnetic particles;ATPE;Miraculin
TS 204
A
1674-4942(2015)04-0404-06
2015-09-21
海南省社会发展专项(2015SF11);海口市应用技术研究与开发项目(2014-90);海南省大学生创新训练项目(20131165800);海南师范大学学生科研项目(XSKY201512);海南师范大学“大学生创新创业训练计划”项目(cx⁃cyxj2015023)
