氮杂二吡咯亚甲基衍生物的合成、表征、光谱性质的研究及离子响应
2015-10-26边永军渠星宇
边永军,渠星宇
(晋中学院化学化工学院,山西晋中030600)
氮杂二吡咯亚甲基衍生物的合成、表征、光谱性质的研究及离子响应
边永军,渠星宇*
(晋中学院化学化工学院,山西晋中030600)
采用邻苯二腈和吡啶-2,3-二甲腈与格式试剂的反应,成功合成氮杂二吡咯亚甲基衍生物1a和1b.通过测定两个化合物的质谱、氢核磁谱和紫外可见吸收光谱,确定了两个化合物的结构,化合物1b的最大吸收光谱峰712 nm比化合物1a的最大吸收峰647 nm红移了65 nm,化合物1b与Ca2+和Zn2+的能够特征性响应.
氮杂二吡咯亚甲基衍生物;Ca2+响应;Zn2+响应
目前,探针的合成已经成为化学领域的一个研究热点.经典的探针需要包含以下几部分,1)识别基团(配位基团或结合基团),能够与分析物结合或者能够改变探针的结构;2)检测基团,可以通过仪器信号来显示探针的存在;3)连接基团[1-3],能够将识别基团和检测基团连接.
氮杂二吡咯亚甲基化合物是合成aza-BODIPY荧光染料的前体,也具有许多优良的光物理性质,摩尔吸光系数大、吸收的半峰宽窄,荧光量子产率高等[4-7].但是,却很少有人研究aza-BODIPY荧光染料的前体氮杂二吡咯亚甲基的性质[8].本论文主要合成两个氮杂二吡咯亚甲基1a和1b,化合物1a为氮杂二苯并吡咯亚甲基,化合物1b为氮杂二吡啶并吡咯亚甲基.两个化合物均有高的摩尔吸光系数,同时化合物1b的最大吸收峰(712 nm)比化合物1a的最大吸收峰(647 nm)红移65 nm.通过测试紫外可见吸收光谱,化合物1b与Ca2+和Zn2+发生了特征性响应.
1 实验部分
1.1仪器与试剂
2.1.1仪器
核磁共振仪(Bruker500型,德国),MALDI-TOF型质谱(Bruker Daltonics Autoflex IITM)岛津紫外可见光谱仪(UV-2550型).
2.1.2试剂
无水苯的制备:在氮气保护下,加入钠丝后,回流,待指示剂二苯甲酮变蓝后,经蒸馏得到无水苯.分子筛置于马弗炉中,500℃保持8 h后待用.无水乙醚的制备:将市售的分析纯无水乙醚加入分子筛,放置7天以上.无机试剂主要有,Zn(OAc)2·2H2O,CaCl2.其它试剂均为市售分析纯试剂,直接使用.紫外可见光谱测试使用试剂均为光谱纯试剂.
1.2化合物1a和1b的合成
目标化合物的合成方法参照文献[9],用溴苯和镁条在乙醚溶液中制备得到格式试剂备用.取250 mL的圆底烧瓶,加入(0.01 mol,1.28g)的邻苯二腈于100 mL的苯,将格式试剂逐渐滴加到烧瓶中,在室温反应1 h.待反应结束后,冷至0-5℃,逐渐加入饱和的氯化铵溶液将未反应的格式试剂分解.用水蒸气蒸馏的方法提纯,干燥,得到墨绿色的粗产物.用中性氧化铝柱层析分离,展开剂为氯仿,得到紫黑色的产品.

图1 化合物1a和化合物1b的合成路线Fig.1Synthetic route of compounds of 1a and 1b

2 结果与讨论
2.1化合物1a和1b的合成
氮杂二吡咯亚甲基化合物具有重要的地位,最早作为合成酞菁或卟啉类化合物的中间体,随后又成为氮杂氟硼二吡咯亚甲基(BODIPY)类化合物的中间体.氮杂二吡咯亚甲基化合物的合成主要有以下几种方法:1)在亚硝酸钠、乙酸酐、乙酸的存在下,2,4-二苯基吡咯与吡咯衍生物(亚硝基衍生物)反应得到目标化合物;2)在甲酸氨的作用下,与羰基发生反应,生成氨基吡咯中间体,脱水得到目标化合物;3)通过邻苯二腈与格式试剂反应,在饱和氯化铵的作用下,加热合成得到目标化合物.本文采用第三种方法,目的为了得到有共轭体系的吡咯,可以使吸收红移.同时在合成的过程中,应注意苯溶剂的使用量,一定要使原料在很稀的条件下反应,否则容易生成副产物酞菁.
2.2化合物1a和1b的结构表征
2.2.1化合物1a和1b的质谱图
本文采用MALDI-TOF质谱仪测试合成的化合物1a和1b,图2(a)为化合物1a的质谱图,397处为分子离子峰,与化合物1a的分子量非常吻合,表明合成出目标化合物.图2(b)为化合物1b的质谱图,400处为分子离子峰,同样与化合物1b的分子量相同,表明合成出化合物1b.
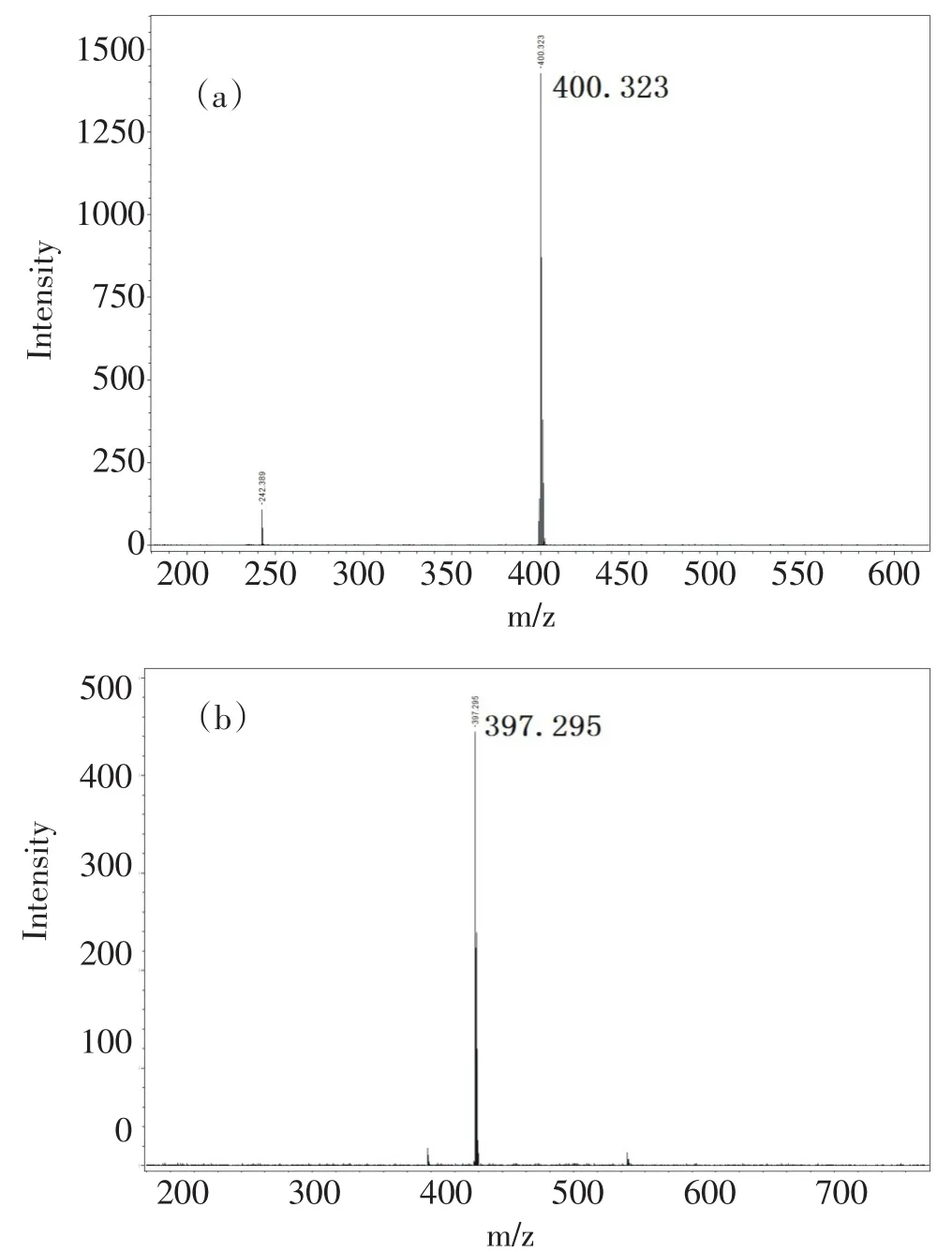
图2 化合物1a(a)和化合物1b(b)的质谱图Fig.2Mass spectra of(a)compound 1a and(b)compound 1b
2.2.2化合物1a和1b的核磁谱图
化合物1a和1b的氢核磁谱图见图3.两个化合物吡咯的NH上的峰均未出现,并且两个化合物的氢均出现在7.3-8.2 ppm之间.化合物1a和1b的空间结构表明,分子中左右两个部分不能够完全对称,所以氢核磁谱中氢裂分较多,但是总的氢个数比与目标化合物的氢个数非常吻合,表明得到目标化合物.
2.3化合物1a和1b的紫外可见光谱
本文测试了化合物1a和1b在二氯甲烷中的吸收光谱,见图4.化合物1a的吸收峰位于300 nm和647 nm处,化合物1b的吸收峰位于306 nm和712 nm处,并且吸收峰值都很强.由于共轭体系由苯环变为吡啶环,使得化合物1b紫外可见吸收峰发生红移.位于300-400 nm的吸收带为S0-S2的跃迁,化合物1b红移6 nm.位于500-800 nm的吸收带为S0-S1跃迁的强吸收峰,化合物1b位于712 nm的吸收峰与化合物1a位于647 nm的吸收峰相比,红移了65 nm. 2.4化合物1b与Ca2+和Zn2+离子的响应
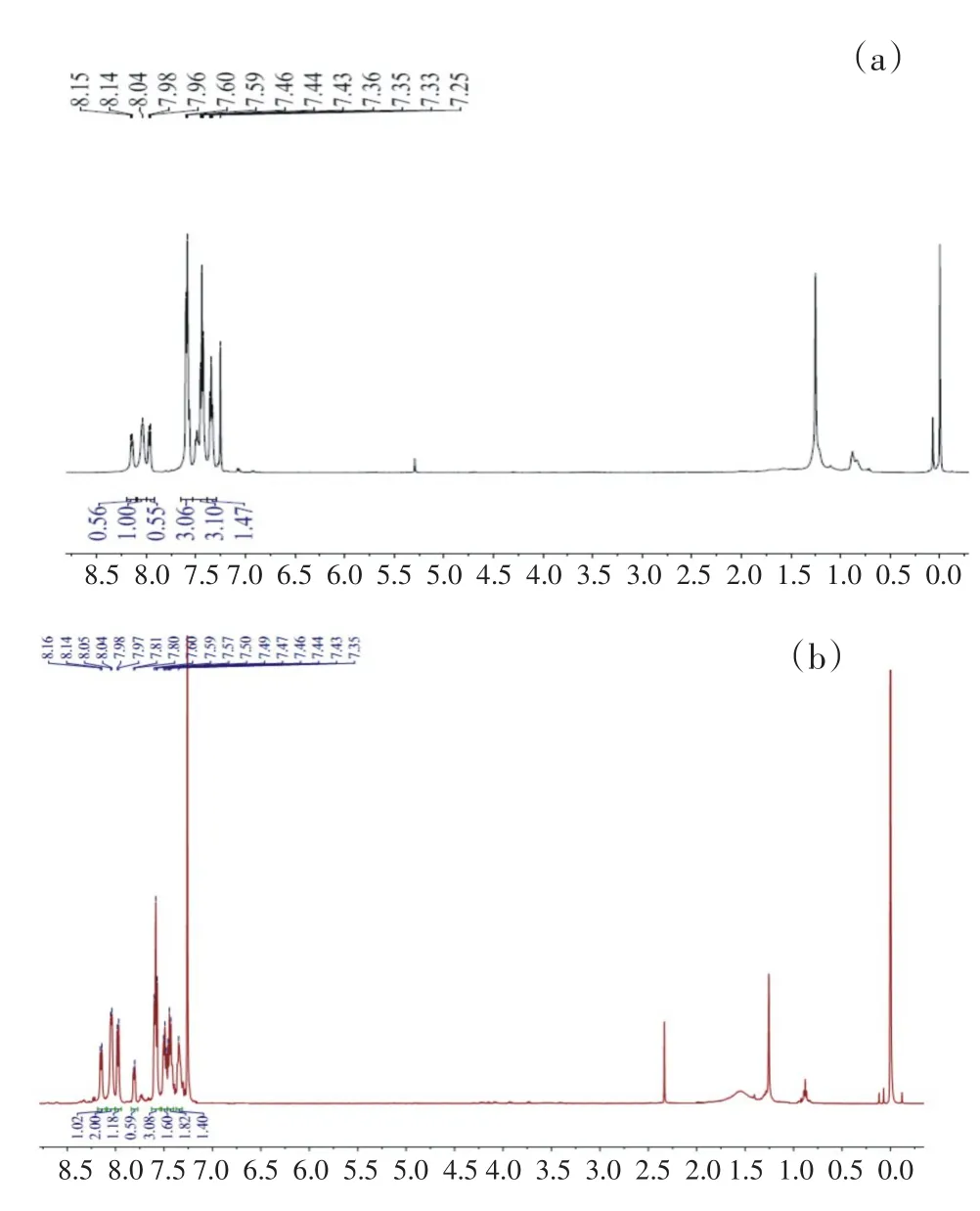
图3 化合物1a(a)和化合物1b(b)的氢核磁谱图Fig.3Hydrogen NMR spectra of(a)compound 1a and(b)compound 1b
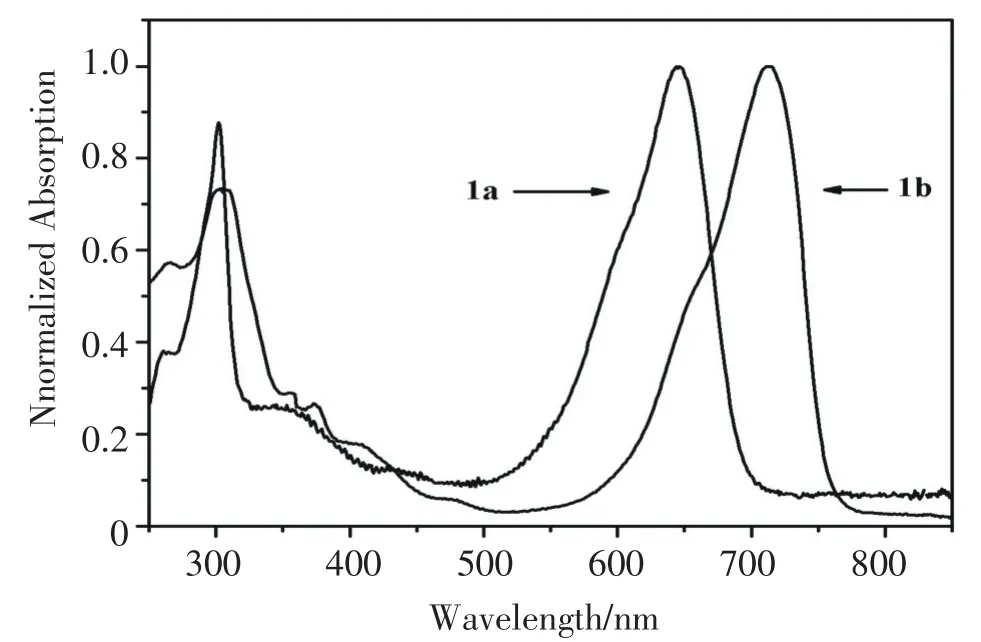
图4 化合物1a和1b的紫外可见谱图Fig.4 UV-visible spectra of compound 1a and 1b
图5为化合物1b溶解到DMSO溶液中,浓度为1×10-5mol/L,测得的紫外可见光谱图,谱图中显示在500-700 nm之间有一个很宽的吸收峰.在该溶液中分别加入Ca2+和Zn2+,加入离子物质的量均为化合物1b物质的量的100倍,紫外可见谱图显示吸收值分别增强了2.19倍和1.38倍.表明Ca2+和Zn2+与化合物发生了配位,同时配位后的化合物阻止了化合物1b可以扭转的空间结构,使得配合物具有刚性结构.

图5 化合物1b与Ca2+和Zn2+响应后的紫外可见谱图Fig.5UV-visible spectra obtained after the reaction between compound 1a and Ca2+and Zn2+,respectively
3 结论
本文成功的合成了两个氮杂二吡咯亚甲基类化合物1a和1b,合成步骤和纯化处理均简单,并且通过质谱和核磁对化合物进行了表征.同时测试了化合物1a和1b的紫外可见吸收光谱,表明化合物1b由于杂原子的引入,吸收峰的位置较化合物1a发生了红移.考察了化合物1b与Ca2+和Zn2+的响应,实验结果表明,Ca2+和Zn2+均能与化合物1b发生配合,配合物的紫外可见吸收值发生很大程度的增强.化合物1a和1b的合成对氮杂氟硼二吡咯亚甲基(BODIPY)(aza-BODIPY)染料或金属配合物的合成具有一定的指导意义,同时也为离子检测的研究提供了一些理论依据.
[1]Qu X Y,Liu Q,Ji X N,et al.Enhancing the Stokes’shift of BODIPY dyes via through bond energy transfer and its ap⁃plication for Fe3+-detection in live cell imaging[J].Chem Comm,2012,48:4600-4602.
[2]Qu X Y,Li C J,Chen H C,et al.A red fluorescent turn-on probe for hydrogen sulfide and its application in living cells[J].Chem Comm,2013,49:7510-7512.
[3]Loudet A,Burgess K.BODIPY Dyes and their derivatives:syntheses and spectroscopic properties[J].Chem Rev,2007,107:4891-4932.
[4]Coskun A,Yilmaz M D,Akkaya E U.Bis(2-pyridyl)-substi⁃tuted boratriazaindacene as an NIR-emitting chemosensor for Hg(II)[J].Org Lett,2007,9:607-609.
[5]Loudet A,Bandichhor R,Wu L X,et al.Functionalized BF2chelated azadipyrromethene dyes[J].Tetrahedron,2008,64:3642-3645.
[6]Murtagh J,Frimannsson D O,O’Shea D F.Azide conjugat⁃able and pH responsive near-infrared fluorescent imaging probes[J].Org Lett,2009,11:5386-5389.
[7]Palma A,Tasior M,Frimannsson D O,et al.New on-bead near-infrared fluorophores and fluorescent sensor constructs[J].Org Lett,2009,11:3638-3641.
[8]Choi S H,Kim K,Jeon J,et al.Optical effects of S-oxida⁃tion and Mn+Binding in meso-thienyl dipyrrin systems and of stepwise bromination of 4,4-difluoro-8-(2,5-dibromo-3-thienyl)-4-bora-3a,4a-diaza-s-indacene[J].Inorg Chem,2008,47:11071-11083
[9]Lu H,Shimizu S,Mack J,et al.Synthesis and spectroscopic properties of fused-ring-expanded aza-BODIPYs[J].Chem Asian J,2011,6:1026-1037.
责任编辑:刘红
Synthesis,Characterization,Spectroscopy Properties and Ions responses of Aza-dipyromethene Derivatives
BIAN Yongjun,QU Xingyu*
(Department of Chemistry and Chemical Engineering,Jinzhong University,Jinzhong 030600,China)
Aza-dipyromethene 1a and 1b were successfully synthesized by the reaction between dinitrile and Grignard re⁃agent,which were characterized by MALDI-TOF MS,1H NMR and UV-Vis absorption spectrum.The absorption maxima of compounds 1a and 1b are centered at approximately 712 nm and 647 nm,respectively.Compared with the compound 1a,the absorption maxima of compounds 1b is red shifted about 65 nm,and the compound 1b can respond with Ca2+and Zn2+.
aza-dipyromethene;Ca2+response;Zn2+response
O 626
A
1674-4942(2015)04-0396-04
2015-10-19
山西省高等学校科技创新项目(2015176);晋中学院博士科研启动金(bsjj2015213,bsjj2015214)
