酸/碱溶解-等电点沉淀法回收罗非鱼蛋白的工艺优化及蛋白组成分析
2015-10-26周春霞刘诗长王瑛郑惠娜洪鹏志
周春霞,刘诗长,王瑛,郑惠娜,洪鹏志
(广东海洋大学食品科技学院广东省水产品加工与安全重点实验室,水产品深加工广东普通高等学校重点实验室,广东湛江524088)
酸/碱溶解-等电点沉淀法回收罗非鱼蛋白的工艺优化及蛋白组成分析
周春霞,刘诗长,王瑛,郑惠娜,洪鹏志*
(广东海洋大学食品科技学院广东省水产品加工与安全重点实验室,
水产品深加工广东普通高等学校重点实验室,广东湛江524088)
以罗非鱼(Oreochromis niloticus)肉为原料,采用酸/碱溶解-等电点沉淀法回收罗非鱼肌肉蛋白,主要探讨溶解pH值、料液比和溶解时间对可溶性蛋白得率以及沉淀pH值对可溶性蛋白沉淀得率及蛋白亚基组成的影响.结果表明,酸/碱溶解回收罗非鱼肉可溶性蛋白的最佳pH值为pH 2.0、3.0、11.0和12.0,料液比1∶9(ω/v),溶解时间10 min,可溶性蛋白种类齐全,包含了典型的鱼蛋白电泳条带;酸/碱可溶性蛋白的最佳沉淀条件为pH 5.5,在此条件下,溶解-沉淀过程的蛋白得率分别为61.59%-64.95%.与鱼肉蛋白相比,四种分离蛋白中盐溶性蛋白的比例均升高,水溶性蛋白的比例均降低(p<0.05).比较而言,碱溶-等电点沉淀过程中鱼蛋白的变性程度较小,其水溶性组分和盐溶性组分所占的比例均较高,组成相对比较齐全,而酸提蛋白中肌球蛋白重链部分降解,少量肌浆蛋白损失.因此,碱溶-等电点沉淀法更有利于回收鱼肉分离蛋白.
罗非鱼肉;酸碱溶解-等电点沉淀;提取工艺;分离蛋白;蛋白组成
到目前为止,有关酸碱处理的工艺流程、分离蛋白的得率、凝胶性、白度、脂肪氧化、冻藏稳定性及其在全鱼和鱼品加工下脚料蛋白提取中的应用等都有了广泛研究[2-3].酸/碱溶解-等电点沉淀法已用于提取鲱鱼[4]、岩鱼[5]、鲶鱼[6]、鳕鱼[7]、罗非鱼[8-10]、鲢鱼[11-12]肌肉蛋白、回收虹鳟鱼鱼片加工下脚料蛋白[13-14]及鱼糜加工废水的肌浆蛋白[15]等.但与传统的鱼糜加工过程相比,极端酸/碱处理会使蛋白质发生变性,且通常认为化学变性对蛋白质的功能特性可能有不利的影响.因此,从理论的角度分析,酸碱调节处理制备的分离蛋白很可能功能特性较差.与传统水洗法制备的罗非鱼鱼糜比较,酸碱法提取的分离蛋白凝胶强度较差,酸溶-等电点沉淀蛋白中肌原纤维蛋白部分降解[9].然而,有研究显示,与传统的水洗鱼糜相比,酸碱处理肌原纤维蛋白可以改善其凝胶形成能力,且碱处理改善色泽和凝胶特性的效果更加明显[4-5,7-8,10],而关于功能特性改善的机理及变化规律研究相对较少.为此,本研究以大宗养殖罗非鱼为原料,采用酸/碱溶解-等电点沉淀法回收罗非鱼肌肉蛋白,探讨其高效回收鱼蛋白的工艺条件、回收蛋白的组成及变化,为低值鱼蛋白资源的高值化利用提供理论依据.
1 材料与方法
1.1材料与试剂
罗非鱼,湛江东风水产市场购买,在实验室去内脏、取背部白肉、清洗、沥干、绞碎、分装(150 g/袋),于-18℃冷冻保存,一个星期内使用,凯氏定氮法检测其粗蛋白含量为(16.40±0.06)%.
1.2酸/碱溶解-等电点沉淀法提取蛋白的工艺流程
罗非鱼肉→取样解冻→按一定比例加冰水→高速均质(2 min)→调节pH值→低温搅拌(400r/min)溶解一定时间→离心(10000 r/min,20 min,4℃)→取上清液→调节pH值使其沉淀→离心(10000 r/ min,20 min,4℃)→取沉淀.整个提取分离过程均在10℃以下进行,提取时间控制在90 min内.
1.3pH溶解曲线试验
按照上述提取流程,固定料液比1∶9(ω/v),调pH值2~12(变化区间为0.5或1个pH单位),溶解离心后收集上清液,采用双缩脲法测定上清液蛋白含量.以pH值-上清液中可溶性蛋白含量作图.
1.4罗非鱼肉蛋白最适溶解条件试验
在确定的最佳酸溶和碱溶pH值范围内,考察不同溶解pH值、料液比(1∶3、1∶6、1∶9和1∶12)和溶解时间(10~60 min)对罗非鱼肉可溶性蛋白得率的影响.溶解过程的蛋白得率用上清液中粗蛋白含量占原料粗蛋白含量的百分比来表示,其蛋白含量采用凯氏定氮法检测.
1.5可溶性蛋白最佳沉淀条件试验
训练过程中,程序遇到被勿分类的点,会沿着梯度下降的方向重新修改超平面的权重w1,w2和阈值b以适应新的环境[19].训练反复迭代,直到所有样本都被分类正确.感知机模型训练程序流程图见图4.
在确定的最佳提取条件下提取罗非鱼肉可溶性蛋白,考察沉淀pH值对可溶性蛋白沉淀得率的影响.沉淀过程的蛋白得率用沉淀中粗蛋白含量占可溶性蛋白总量的百分比来表示,其蛋白含量采用凯氏定氮法检测.
1.6SDS-PAGE电泳
对不同溶解条件下的可溶性蛋白(等体积)和不同沉淀条件下的沉淀蛋白(等蛋白量)进行SDSPAGE电泳[7]分析.实验所用分离胶浓度为10%,浓缩胶浓度为5%.
1.7水溶性和盐溶性组分的分离
绞碎后的罗非鱼肉及分离蛋白分散于4倍体积的去离子水中,高速匀浆5 min后离心(10000 r/min,20 min,4℃),收集上清液,将沉淀分散于4倍体积的去离子水中,重复上述操作,合并两次上清液即为水溶性蛋白;提取水溶性蛋白后的沉淀分散于4倍体积的磷酸盐缓冲液(0.1 mol/L,pH 7.4,0.6 mol/L Na⁃Cl)中,高速组织匀浆机匀浆5 min,4℃下浸提18 h(不时搅拌),离心(10000 r/min,20 min,4℃),所得上清液即为盐溶性蛋白,沉淀为不溶性蛋白.
2 结果与讨论
2.1罗非鱼肉蛋白酸/碱溶解条件的确定
2.1.1pH溶解曲线的确定

图1 罗非鱼肉蛋白pH溶解曲线图Fig.1Solubility profiles of tilapia muslce protein at a various pH
2.1.2酸/碱可溶性蛋白的SDS-PAGE分析
上述各pH条件下提取的罗非鱼肉可溶性蛋白,分别取等体积的蛋白溶液进行SDS-PAGE分析,结果如图2.由图可知,在pH 2.0~4.0或10.0~12.0条件下,在分子量为200kDa、44.3kDa、44.3kDa~29.0kDa和14.3kDa处均出现明显的蛋白条带,分别对应肌球蛋白重链、肌动蛋白、肌浆蛋白和小分子水溶性蛋白[16],表明酸/碱提取过程中可溶性蛋白含量高,种类齐全,且随着pH值的升高或降低,可溶性蛋白含量逐渐增大.而在pH 5.0~6.0范围内,等体积的蛋白溶液在电泳图上几乎没有明显的蛋白条带,表明上清液中蛋白含量极少,蛋白溶出率低.总的分析结果与pH溶解曲线的变化趋势大致相同,由此进一步确定罗非鱼蛋白溶解的最佳条件在pH≤3.0或pH≥10.0,而最佳沉淀条件在pH 5.0~6.0.
2.1.3溶解pH值对可溶性蛋白得率的影响
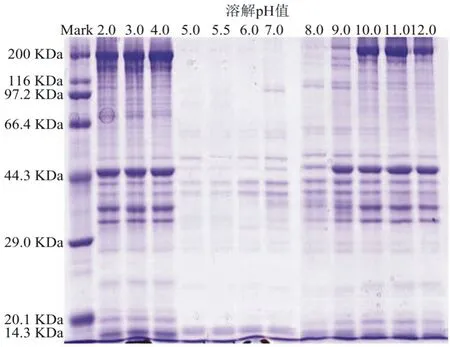
图2 不同pH条件下可溶性蛋白的SDS-PAGE图Fig.2SDS-PAGE patterns of soluble protein at various pH
以罗非鱼鱼肉为原料,在料液比1∶9,pH 2.0、3.0和11.0、12.0条件下低温溶解10min,其可溶性蛋白得率见图3.由图可知,在四种偏离等电点的极端pH值条件下,可溶性蛋白得率较高,达62.89%~75.86%.比较而言,碱性条件下的得率更高,pH 12.0时可溶性蛋白得率达75.86%.碱性处理回收蛋白质的效果很可能优于酸性处理[8,10],酸处理在相当大的程度上引起硫醇氧化和蛋白质疏水基团的外露,导致蛋白的聚集而导致溶解性降低[9].但总体而言,四个pH值条件下可溶性蛋白得率差异不明显(p>0.05),因此,选择这四种溶解pH值进一步试验.
2.1.4料液比对可溶性蛋白得率的影响
在pH 2.0、3.0和11.0、12.0条件下低温溶解10 min,试验料液比对罗非鱼肉可溶性蛋白得率的影响,结果如图4所示.由图可知,在实验范围内,随着料液比的降低,可溶性蛋白得率增大(p<0.05),而当料液比达到1∶9后,随着溶液体积的增加,可溶性蛋白得率增加幅度很小,料液比对鱼肉蛋白溶解性的影响主要与蛋白质分子表面亲水基团和水化层的形成有关,蛋白质分子表面有许多亲水基团,使其表面形成一个水化层,使蛋白质颗粒彼此不容易接近[12],因此,溶剂量越大,蛋白质溶液的稳定性越好,溶解度越高,但溶剂量增加到一定程度后,溶解度的增加不明显.综合得率和实际操作及成本,确定进一步实验的料液比为1∶9.
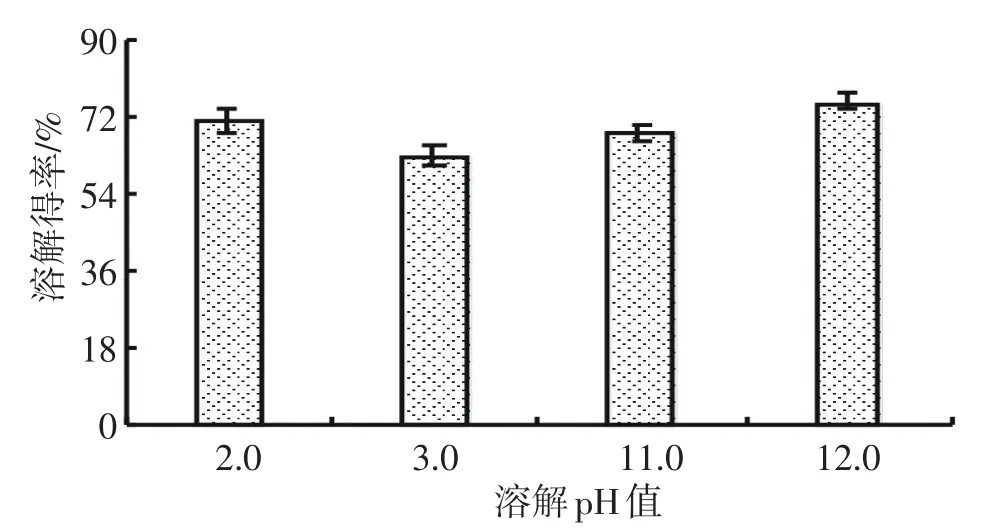
图3 溶解pH值对罗非鱼肉可溶性蛋白得率的影响Fig.3Effect of dissolved pH value on solubleprotein yield from tilapia muscle
2.1.5溶解时间对可溶性蛋白得率的影响
酸/碱溶解时间对罗非鱼肉可溶性蛋白得率的影响如图5所示.由图可知,在实验时间范围下,随着溶解时间的延长,鱼蛋白的溶解度略有增大,但整体变化不明显(p>0.05),由此表明鱼蛋白在极端酸性和碱性条件下的展开和溶解很可能在快速进行.另外,为了尽可能的避免鱼蛋白的水解变性,溶解时间确定为10 min,整个实验处理时间控制在90 min以内.综合分析,酸/碱溶解-等电点沉淀法提取罗非鱼肉蛋白的最佳溶解条件为:pH值为2.0、3.0、11.0和12.0、料液比为1∶9、溶解时间10 min.

图4 料液比对罗非鱼肉可溶性蛋白得率的影响Fig.4Effect of ratio of raw material to extracting madia on soluble protein yield from tilapia muscle

图5 提取时间对罗非鱼肉可溶性蛋白得率的影响Fig.5Effect of extracting time on soluble protein yield from tilapia muscle
2.2罗非鱼肉酸/碱可溶性蛋白沉淀条件的确定
以罗非鱼肉为原料,在最佳提取条件下提取酸/碱可溶性蛋白,将可溶性蛋白溶液调至pH 5.0、5.5、6.0使其沉淀,其可溶性蛋白沉淀得率如图6所示.由图可知,四种可溶性蛋白溶液均在pH=5.5条件下沉淀得率最高,接近90%,由此确定酸/碱可溶性蛋白最适沉淀pH值为5.5,也进一步表明酸/碱可溶性蛋白的等电点很可能在pH=5.5左右;比较而言,在pH= 5.5条件下,酸溶蛋白比碱溶蛋白的沉淀得率稍高,但差异并不明显(p>0.05).总体分析,在pH调节法法提取蛋白的酸/碱溶解过程中,极端酸性条件引起蛋白变性和聚集[9],导致酸溶蛋白的得率比碱溶蛋白的得率要低,而在沉淀过程中,也正因为酸性条件下引起蛋白的变性和聚集,导致酸溶蛋白的沉淀得率较高.由此导致整个提取(溶解-沉淀)过程蛋白得率差异不明显.

图6 沉淀pH值对罗非鱼肉酸/碱可溶性蛋白沉淀得率的影响Fig.6Effect of pH value on precipitating yield of acid/alkali-soluble protein from tilapia muscle
综上分析,确定酸/碱溶解-等电点沉淀法提取罗非鱼肉分离蛋白的溶解pH值为pH 2.0、3.0、11.0和12.0,料液比1∶9,溶解时间10min,酸/碱可溶性蛋白的最佳沉淀条件为pH 5.5,其提取蛋白得率分别为61.59%、56.06%、56.53%和64.95%.
2.3罗非鱼肉分离蛋白的制备及组成分析
2.3.1分离蛋白水溶性和盐溶性蛋白的比例
分别在极端酸性(pH 2.0和3.0)和碱性(pH 11.0和12.0)条件下溶解,然后pH 5.5条件下沉淀,冷冻干燥制备了四种分离蛋白粉,其干基蛋白含量在95%以上(数据未列出),灰分和脂肪含量低.进一步对四种分离蛋白的水溶性和盐溶性蛋白进行提取和检测,结果如图7所示.由图可知,各分离蛋白中盐溶性蛋白含量均明显高于水溶性蛋白含量(p<0.05),由此表明酸/碱溶解-等电点沉淀法可以有效回收鱼肉中的盐溶性蛋白及部分水溶性蛋白;比较而言,碱溶-等电点沉淀蛋白中水溶性和盐溶性蛋白的含量均高于酸溶-等电点沉淀蛋白,尤其是pH 11.0-5.5条件下提取的分离蛋白中盐溶性蛋白含量超过80%.由此进一步表明碱法提取过程中鱼蛋白的变性程度较小,回收蛋白质的性质较好.另外,与鱼肉蛋白相比,四种分离蛋白中水溶性组分的含量均降低(p<0.05),表明在等电点沉淀过程中部分水溶性蛋白成分损失或变性为不溶性组分,使沉淀后的上清液中小分子蛋白含量减少;分离蛋白的不溶性蛋白组分均高于鱼肉蛋白,这可能与可溶性蛋白提取过程的变性聚集有关,且酸提蛋白的不溶性组分比例更告,进一步表明酸溶-等电点沉淀过程中蛋白质变性更为明显.
2.3.2分离蛋白的SDS-PAGE电泳分析
分别提取四种分离蛋白的水溶性和盐溶性组分进行SDS-PAGE电泳分析,结果如图8所示.由图可知,在实验范围内,分离蛋白中盐溶性组分的条带明显较多,并且在分子量200kDa、44.3kDa、20kDa和14.3kDa附近等处均出现明显的蛋白条带,分别对应肌球蛋白重链、肌动蛋白、肌球蛋白轻链和小分子水溶性蛋白[16],表明酸/碱溶解-等电点沉淀法提取的分离蛋白基本上包括了鱼肉中大部分的盐溶性和水溶性蛋白;比较而言,酸溶-等电点沉淀蛋白盐溶性组分的蛋白条带明显较浅,且肌球蛋白重链的变化尤为明显,由此表明极端pH条件影响蛋白质的亚基组成和构象,尤其是肌球蛋白重链的降解[2,7];水溶性组分的条带主要分布在分子量44.3~29.0 kDa和20.1~14.3 kDa范围内,为肌浆蛋白和小分子水溶性蛋白等[16];比较而言,pH 2.0-5.5提取的蛋白水溶性组分的条带明显较少,可能与酸提过程中鱼肉内源酶的破坏有关.总体分析,pH 11.0-5.5条件下提取的分离蛋白变性程度较小,蛋白组分比较齐全.
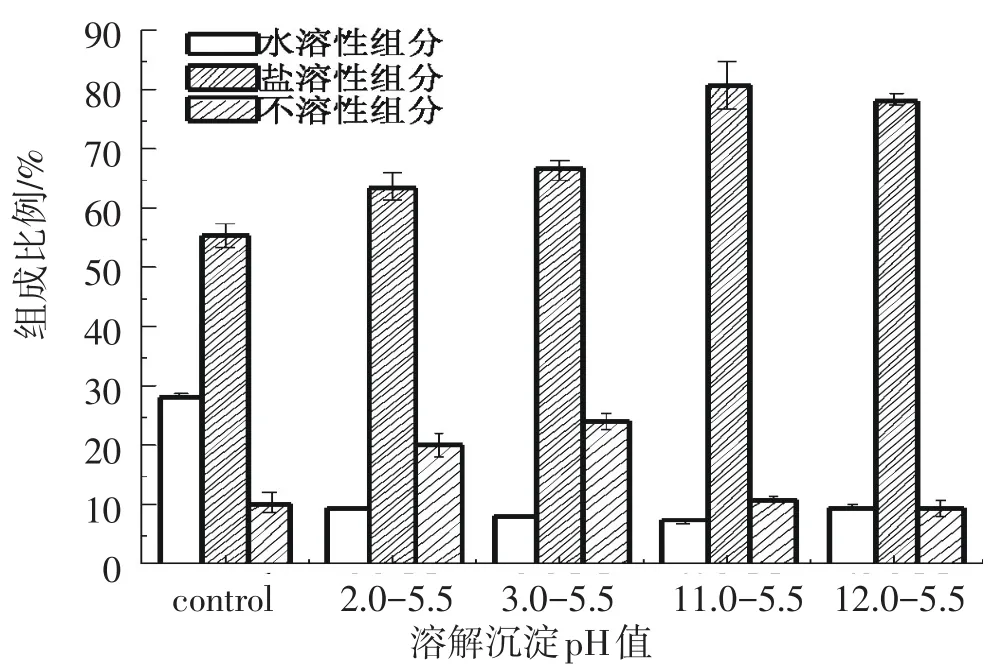
图7 罗非鱼肉及其分离蛋白中水溶性和盐溶性蛋白的比例Fig.7Water-soluble and salt-soluble protein proportion in tilapia muscle and protein isolate

图8 罗非鱼肉分离蛋白水溶性和盐溶性组分的SDS-PAGE图Fig.8SDS-PAGE patterns of water-soluble and salt-soluble fraction in protein isolate from tilapia muscle
3 结论
酸/碱溶解-等电点沉淀法提取罗非鱼肉蛋白的最佳溶解条件为:pH值2.0、3.0、11.0和12.0、料液比1:9、溶解时间10min;酸/碱可溶性蛋白的最佳沉淀条件为pH 5.5;在此条件下,溶解-沉淀过程的蛋白得率分别为61.59%、56.06%、56.53%和64.95%;分离蛋白组成齐全,显示了肌球蛋白重链、肌动蛋白、肌球蛋白轻链和小分子的水溶性蛋白条带;比较而言,碱溶-等电点沉淀法提取的蛋白组成相对比较齐全,而碱溶-等电点沉淀提取过程中变性程度较大,肌球蛋白重链部分降解,少量肌浆蛋白损失,不溶性组分的比例提高.因此,碱溶-等电点沉淀法更适于回收鱼肉分离蛋白.
[1]Hultin H O,Kelleher S D.Process for isolating a protein composition from a muscle source and protein composition[P]:USA,6005073.1999-12-21.
[2]Nolsoe H,Undeland I.The acid and alkaline solubilization process for the isolation of muscle proteins:state of the art[J]. Food Bioprocess Technology,2009,2(1):1-27.
[3]Gehring C K,Gigliotti J C,Moritz J S.Functional and nutri⁃tional characteristics of proteins and lipids recovered by iso⁃electric processing of fish by-products and low-value fish:A review[J].Food Chemistry,2011,124(2):422-431.
[4]Undeland I,Kelleher S D,Hultin H O.Recovery of func⁃tional proteins from herring(Clupea harengus)light muscle by an acid or alkaline solubilization process[J].Journal of Agricultural and Food Chemistry,2002,50(25):7371-7379.
[5]Yongsawatdigul J,Park J W.Effects of alkali and acid solubi⁃lization on gelation characteristics of rockfish muscle proteins[J].Journal of Food Science,2004,69(7):499-505.
[6]Mireles DeWitt C A,Nabors R L,Kleinholz C W.Pilot pant scale production of protein from catfish treated by acid solubilization/isoelectric precipitation[J].Journal of Food Science,2007,72(6):E351-E355.
[7]Brenner T,Johannsson R,Nicolai T.Characterisation and thermo-reversible gelation of cod muscle protein isolates[J]. Food Chemistry,2009,115(1):26-31.
[8]Kristinsson H,Ingadottir B.Recovery and properties of mus⁃cle proteins extracted from tilapia(Oreochromis niloticus)light muscle by pH shift processing[J].Journal of Food Sci⁃ence,2006,71(3):132-141.
[9]Rawdkuen S,Sai-Ut S,Khamsorn S.Biochemical and gell⁃ing properties of tilapia surimi and protein recovered using an acid-alkaline process[J].Food Chemistry,2009,112(1):112-119.
[10]刘俊荣,贺凌,汪涛,等.不同pH条件下罗非鱼肌肉蛋白分离效果及其功能特性的研究[J].水产科学,2010,29(6):317-320.
[11]Taskaya L,Chen Y C,Jaczynski J.Functional properties of proteins recovered from silver carp(Hypophthalmichthys molitrix)by isoelectric solubilization/precipitation[J].LW T-Food Science and Technology,2009,42(6):1082-1089.
[12]陈申如,张其标,倪辉.酸法提取鲢鱼鱼肉蛋白质技术的研究[J].海洋水产研究,2004,25(5):61-64.
[13]Chen Y C,Jaczynski J.Protein recovery from rainbow trout(Oncorhynchus mykiss)processing byproducts via iso⁃electric solubilization/precipitation and its gelation proper⁃ties as affected by functional additives[J].Journal of Agri⁃cultural and Food Chemistry,2007,55(22):9079-9088.
[14]Taskaya L,Jaczynski J.Flocculation-enhanced protein re⁃covery from fish processing by-products by isoelectric solu⁃bilization/precipitation[J].Food Science and Technology,2009,42(2):570-575.
[15]Krasaechol N,Sanguandeekul R,Duangmal K,et al.Struc⁃ture and functional properties of modified threadfin bream sarcoplasmic protein[J].Food Chemistry,2008,107(1):1-10.
[16]鸿巢章二,桥本周久.水产利用化学[M].郭晓风,邹胜祥译.北京:中国农业出版社,1994.
责任编辑:刘红
Optimizing Recovery and Composition Analysis of Tilapia Protein by Acid/Alkaline Solubilization-isoelectric Precipitation
ZHOU Chunxia,LIU Shichang,WANG Ying,ZHENG Huina,HONG Pengzhi*
(College of Food Science and Technology,Guangdong Ocean University,Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety,Key Laboratory of Advanced Processing of Aquatic Products of Guangdong Higher Education Institution,Zhanjiang 524088,China)
Protein isolates was prepared from tilapia(Oreochromis niloticus)muscle by acid/alkaline solubilization-isoelec⁃tric precipitation processing in this study.Effect of pH value,ratio of raw material to extracting media and extracting time on soluble protein yield were examined in the extraction process.And then effect of pH value on precipitated protein yield from acid-soluble and alkali-soluble protein and subunit composition was determined as well.Results showed that the optimum dissolution conditions of protein recovery from tilapia muscle were pH 2.0,3.0,11.0,and 12.0,ratio of raw material to ex⁃tracting media of 1∶9(ω/v),and extraction time of 10 min.The soluble proteins strips included the typical fish protein elec⁃trophoresis pattern.The optimum precipitation condition of acid-soluble and alkali-soluble protein was pH 5.5.In the above four conditions,the recovered protein yields from Tilapia muscle were 61.59%-64.95%by acid/alkaline solubilization and precipitation processing.Compared with tilapia muscle protein,the higher salt-soluble protein proportion and lower watersoluble protein proportion(p<0.05)in four protein isolates were obtained.Comparatively,the protein isolates prepared by al⁃kaline solubilization-isoelectric precipitation has less denaturation and more complete composition,and the water-soluble and salt-soluble protein proportion were higher than those of protein isolates by acid solubilization-isoelectric precipitation. However,partial degradation of myosin and loss of sarcoplasmic protein were observed during acid solubilization-isoelectric precipitation treatment.Therefore,alkali solubilization-isoelectric precipitation process was more suitable for recovery of fish protein isolates.
tilapia muscle;acid/alkaline solubilization-isoelectric precipitation;extraction technology;protein isolates;protein composition酸/碱溶解-等电点沉淀法(acid/alkaline solubili⁃zation-isoelectric precipitation),也称pH值调节法(pH-shifting)或酸碱法(acidic/alkaline solublization process),是上世纪90年代末美国学者Hultin和Kelleher[1]研究出的一种提取动物肌肉蛋白的方法.在低温偏离蛋白质等电点的酸性(pH<3.5)或碱性(pH>10.5)条件下使蛋白充分溶解,高速离心除去脂肪和不溶性杂质制备可溶性蛋白溶液,然后在等电点条件下使蛋白沉淀,制备分离蛋白.与传统的鱼糜加工相比具有明显的优点:加工处理前不必预先采肉,不必进行骨肉分离,原料绞碎均质后即可直接使用;第二,可以有效提取可溶性肌浆蛋白,蛋白质回收率高;第三,极端pH条件下蛋白和油脂充分分离,高速离心可以有效去除中性脂肪和膜脂,降低鱼蛋白储藏过程中的脂肪氧化;第四,酸碱处理提取蛋白过程中,有机废水中有机质含量低,对环境的污染小[2].酸/碱溶解-等电点沉淀法也正是在回收蛋白质的效率和优良功能特性方面表现出的巨大优势,引起相关研究学者的广泛关注.
TS 254.2
A
1674-4942(2015)04-0390-06
2015-10-19
国家自然科学基金项目(31201389);广东省高等学校优秀青年教师培养计划资助项目(Yq2013090)
