泊那替尼纳米混悬剂冻干粉的制备及其质量评价
2015-10-26魏丹芸武汉大学人民医院药学部湖北武汉430060
彭 锐 张 洪 张 英 魏丹芸武汉大学人民医院药学部,湖北武汉430060
泊那替尼纳米混悬剂冻干粉的制备及其质量评价
彭锐张洪张英魏丹芸
武汉大学人民医院药学部,湖北武汉430060
目的制备泊那替尼纳米混悬剂冻干粉,并对其冻干保护剂、载药量及稳定性进行考察。方法采用溶剂蒸发技术制备泊那替尼纳米混悬剂冻干粉,利用激光纳米粒度仪、透射电镜对其粒径及形态进行表征,筛选最佳冻干保护剂,利用高效液相色谱法对其载药量和稳定性进行考察。结果泊那替尼纳米混悬剂冻干粉复溶后平均粒径为(92.2±5.6)nm,多分散指数为0.29±0.65,且形态圆整,分布均匀;以10%乳糖为冻干保护剂制得冻干粉的性质最佳;高效液相色谱法测得泊那替尼平均载药量为(16.3±0.8)%,稳定性较好。结论泊那替尼纳米混悬剂冻干粉制备方法简便,有望成为泊那替尼的新型纳米给药系统。
泊那替尼;纳米混悬剂;冻干粉;载药量;稳定性
泊那替尼是酪氨酸激酶抑制剂,对费城染色体和酶蛋白激发生成的所有野生和突变形式的酪氨酸激酶均有阻断作用。对第一代和第二代酪氨酸激酶抑制剂均能产生抵抗或耐药,如伊马替尼、达沙替尼、尼莫替尼等,其中效果最显著的是对T315I基因突变型有直接的抵抗作用[1]。慢性粒细胞白血病患者,无论处于慢性期还是急性期服用泊那替尼后疗效均明显。研究发现,泊那替尼的药理作用主要是对BCR-ABL基因的抑制作用,并且作用范围广泛[2]。这一突破性的发现在很大程度上促使泊那替尼成为治疗慢性粒细胞白血病和费城染色体阳性的急性淋巴细胞白血病的一线药物。鉴于泊那替尼难溶于水的物理性质,患者口服用药时首关效应明显,可降低其疗效。于是,研究开发稳定性好、安全性高、靶向治疗效果较好的新剂型显得迫切,这样不仅可以降低泊那替尼的给药量,而且可以提高泊那替尼的治疗效果。
利用表面活性剂的稳定作用可以将纯的药物颗粒均匀分散在水相中,然后进一步形成一种亚微米胶体分散体系,即纳米混悬剂,而且此体系中表面活性剂的含量比较少[3]。这种制剂可大大提高水难溶性或油难溶性药物的溶解性问题[4],为难溶性药物的给药途径(特别是注射给药)提供了一种新的研究思路。纳米混悬制剂处方中辅料(主要是表面活性剂)所占比例较低,大大增加了制剂的安全性,如减少了辅料对患者的刺激性和毒副作用;另外,制剂中药物纳米颗粒粒径小且不会引起毛细血管的阻塞,大大改善了用药的安全性。已上市的纳米混悬剂种类较多,如醋酸氢化钠可的松纳米混悬剂[5],不仅解决了醋酸氢化钠可的松的水难溶性问题,还提高了患者体内的生物利用度;格列本脲纳米混悬剂[6]是采用活塞-裂缝均质机的方法制备,通过此方法制备的纳米混悬剂颗粒大小均一,方法简便,对所有药物都适用,而且不会对产品带来任何污染,安全性高,但是不适宜于高浓度和高黏度的药物[7]。纳米混悬剂相对混悬剂而言,药物颗粒大小减小,比表面积增大,增大了与胃肠道黏膜的接触面积,加快了溶解,增加了黏附性,可明显提高其生物利用度。由于纳米混悬剂粒径大小均一,大大改善了其物理稳定性,于是粒径的大小成为评价制剂稳定性的主要因素之一[8]。但根据实验室条件及泊那替尼理化性质,本试验采用溶剂蒸发技术制备泊那替尼纳米混悬剂(PON-NPs)冻干粉,并对其理化性质、冻干保护剂及稳定性进行考察。
1 材料与方法
1.1材料
磁力搅拌器(常州博远实验分析仪器厂),分析天平(Sartorius CPA225D,德国),pH计(pHS-25型,上海仪电科学仪器股份有限公司),高剪切分散乳化机(上海弗鲁克流体机械制造有限公司),高效液相色谱仪(Aglilent 1100,美国),Zetasizer Nano 2S90激光纳米粒度仪(英国马尔文公司),电子透射显微镜(Hitachi HV-C20A),旋转蒸发仪(RE52CS,上海亚荣生化仪器厂),UV-1800分光光度计(A11635100694,日本)。
泊那替尼对照品(≥99%,武汉国奥连新生物技术有限公司),泊那替尼(2014-03-04,武汉国奥连新生物技术有限公司),Eudragit RS100(武汉国奥连新生物技术有限公司),聚乙烯吡咯烷酮K30(武汉国奥连新生物技术有限公司),10%甘露醇,10%乳糖,10%蔗糖,甲醇、乙腈均为色谱纯,其他试剂为分析纯。
1.2方法
1.2.1PON-NPs的制备及理化性质考察
采用溶剂蒸发法制备PON-NPs,有机相的形成是泊那替尼原料药0.05 g和Eudragit RS100 0.4 g溶于有机溶剂甲醇-丙酮(1∶3)。另取聚乙烯吡咯烷酮K30溶于适量双蒸水中形成0.75%聚乙烯吡咯烷酮K30水相;再用注射器吸取有机相后匀速缓慢滴入水相中,0.5 h磁力搅拌后形成初乳;然后剪切超声(85 W)5 min后得到微乳液;最后将微乳液中的有机溶剂通过旋转蒸发仪除去,即得PON-NPs。为了进一步确定所得PON-NPs的各种理化指标,利用电子透射显微镜考察其形态,采用激光粒径分析仪和Zeta电位测定仪测定泊那替尼纳米粒粒径、多分散指数(PDI)值及Zeta电位。
1.2.2PON-NPs冻干粉的制备
将前面所制备PON-NPs液体于-20℃冰箱预冷冻24 h,然后冷冻干燥24 h,待全部干燥后便得PON-NPs冻干粉。
1.2.3PON-NPs冻干粉复溶后理化性质考察
采用电子透射显微镜观察PON-NPs冻干粉复溶后制剂形态,激光粒径分析仪和Zeta电位测定仪测量药物纳米粒粒径、PDI值及Zeta电位。
1.2.4PON-NPs冻干保护剂的筛选
将“1.2.1”项下制备的纳米混悬液分别加入10%甘露醇、10%乳糖、10%蔗糖,摇匀后于-20℃冰箱预冻2 h,转移至-80℃冰箱冷冻24 h,冷冻干燥机中冷冻干燥48 h,得到添加冻干保护剂的PON-NPs。以PON-NPs冻干后的外观、水化难易程度及复溶后粒径的大小为指标进行筛选。
1.2.5泊那替尼含量的测定方法
1.2.5.1最大吸收波长的测定试验中以无水乙醇作溶剂溶解原料药,因为它对泊那替尼的吸收峰没有干扰。然后利用紫外分光光度计在200~600 nm波长范围内扫描泊那替尼紫外吸收曲线,泊那替尼在270 nm处出现最大吸收峰,于是确定泊那替尼紫外检测波长为270 nm。
1.2.5.2色谱条件AgilentExtend-C18柱(4.6mm×250mm,5 μm),流动相为乙腈-0.2%三乙胺(乙酸调pH为7,85∶15,V/V),检测波长为270 nm,色谱柱温度30℃,进样流速为1 mL/min,进样量为20 μL。
1.2.5.3泊那替尼标准曲线的绘制精密称取泊那替尼对照品2 mg,用无水乙醇溶解定容于25 mL容量瓶中,即得80 μg/mL的泊那替尼对照品储备液。准确移取储备液适量,分别稀释成1~50 μg/mL范围内9个不同质量浓度的储备液,按“1.2.5.2”项下方法操作。以泊那替尼对照品质量浓度(C)为横坐标,泊那替尼对照品所测峰面积(A)为纵坐标,得泊那替尼直线回归方程A=52.083C-1.8524(r=0.9997)。结果表明泊那替尼对照品质量浓度在1~50 μg/mL范围内线性关系良好。
1.2.5.4日内、日间精密度测定取3种不同质量浓度(20、15、5 μg/mL)的泊那替尼对照品储备液,按“1.2.5.2”项下条件测定其峰面积,日内精密度测定时1 d内连续进样6次,日间精密度测定时连续进样5 d,然后计算日内及日间精密度(RSD)。
1.2.5.5回收率测定取3种不同质量浓度(20、15、5 μg/mL)的泊那替尼对照品储备液,按“1.2.5.2”项下条件进样测定其峰面积,计算样品回收率。
1.2.6高效液相色谱法专属性考察
将空白纳米混悬剂按“1.2.5.2”项下色谱条件进样分析,考察混悬剂中其他成分对泊那替尼的检测方法是否有影响。
1.2.7载药量测定
采用“1.2.5.2”项下色谱条件测定纳米混悬剂冻干粉中泊那替尼含量。精密称取9.7 mg PON-NPs冻干粉于10 mL容量瓶,用适量无水乙醇复溶后定容至刻度,轻轻颠倒混匀。再用无水乙醇将其稀释至某一浓度,高效液相色谱法测定泊那替尼含量,按下列公式计算PON-NPs冻干粉中载药量:载药量(%)=纳米混悬剂冻干粉中药物量×100/纳米混悬剂冻干粉总量。
1.2.8泊那替尼降解曲线
对PON-NPs的降解考察条件为室温见光或者避光,静置后每隔时间点取样1次,过微孔滤膜后进样分析泊那替尼含量,并绘制其降解曲线。
2 结果
2.1PON-NPs及其冻干粉的表征
由溶剂蒸发法制备的PON-NPs冻干粉呈多孔、疏松、针状,复溶后测得药物纳米粒平均粒径为(92.2± 5.6)nm,见图1,PDI为0.29±0.65,说明药物颗粒大小分布较集中;Zeta电位为15.6 mV,见图2。
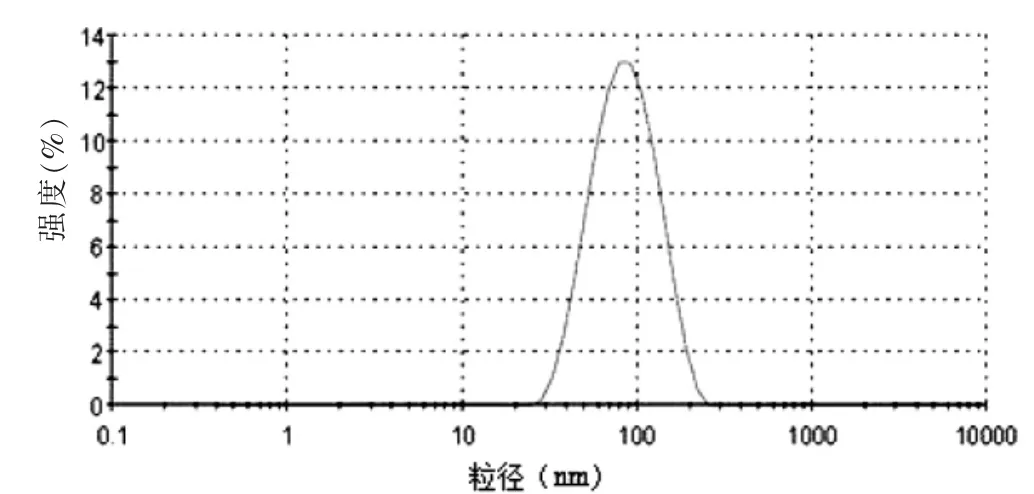
图1 PON-NPs冻干粉复溶后纳米粒粒径分布
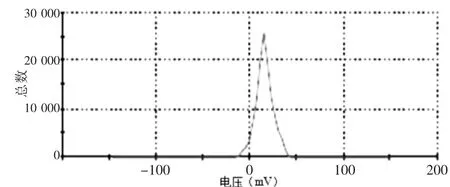
图2 PON-NPs冻干粉复溶后Zeta电位
2.2形态学考察
PON-NPs冻干粉复溶后通过透射电子显微镜观察,其形态圆整,分布较均匀,无粘连,见图3。由表1可知,冻干粉复溶后理化性质的测定结果与PON-NPs比较,差异无统计学意义(P>0.05),说明冻干效果较好。

图3 PON-NPs冻干粉复溶后的透射电子显微镜结果
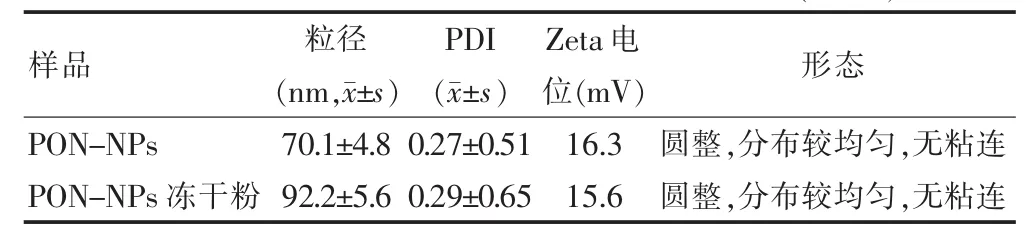
表1 PON-NPs及其冻干粉理化性质的比较(n=3)
2.3回收率和日内、日间精密度测定
3种不同质量浓度(20、15、5 μg/mL)泊那替尼的回收率分别是(101.7±0.2)%、(99.7±0.2)%、(100.3± 0.4)%,平均回收率为(100.6±0.3)%;3种不同质量浓度(20、15、5 μg/mL)药物所测的日内精密度(RSD)分别为0.43%、0.56%、0.82%,日间精密度分别为1.04%、0.94%、1.11%,均<2%,符合含量测定要求。
2.4专属性试验
由图4~6可知,混悬剂中其他成分对泊那替尼的检测没有干扰,说明此方法可用于PON-NPs的含量测定。
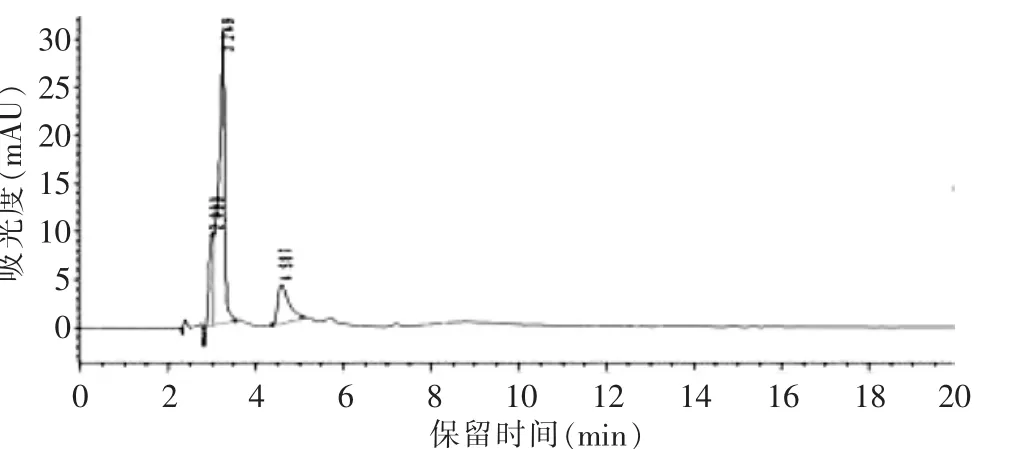
图4 空白混悬剂色谱图
图5 PON-NPs色谱图
图6 泊那替尼对照品色谱图
2.5PON-NPs冻干保护剂的筛选
添加冻干保护剂制备PON-NPs冻干粉,以冻干粉的外观、水化难易程度及复溶后粒径的大小为指标进行筛选,结果见表2。添加10%乳糖为冻干保护剂制备的冻干粉的形态外观、水化难易度与未加冻干保护剂制备冻干粉相近,但前者加水重分散后粒径与冻干前最接近。因此,本试验PON-NPs的冻干粉制备过程中可添加10%乳糖冻干保护剂,使冻干产品不仅具有良好的外观,而且具有长期稳定性。

表2 不同冻干保护剂制备PON-NPs的冻干粉针
2.6泊那替尼载药量测定
采用上述色谱条件,高效液相色谱法测得3种不同质量浓度冻干粉载药量分别是14.5%、16.9%、17.4%,平均载药量为(16.3±0.8)%。
2.7PON-NPs冻干粉复溶后稳定性考察
试验设置为3组,即混悬剂室温见光组(PON-NPs冻干粉,见光)、混悬剂室温避光组(PON-NPs冻干粉,避光)和原料药见光组(空白混悬剂冻干粉,见光)。利用高效液相色谱法对不同时间段的样品进行处理分析,检测出混悬剂中泊那替尼的含量(图7),并绘制出3组样品中泊那替尼的降解曲线。结果表明,泊那替尼混于空白混悬剂冻干粉中时,降解速度明显高于PON-NPs冻干粉,说明药物颗粒以纳米形式存在于混悬液中的稳定性显著高于溶解状态下的药物。尤其在避光条件下,PON-NPs冻干粉中药物在8 d内降解了1.87%;PON-NPs在见光条件下4 d内降解了1.84%;溶解形式的原料药泊那替尼在4 d内降解量是前2组试验的15倍。经过46 d取样测定发现,3组样品中泊那替尼的降解率分别为2.43%、15.63%、 93.61%,说明PON-NPs冻干粉在室温避光条件下稳定性较好,适合储存。
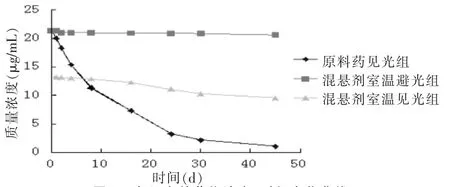
图7 各组有效药物浓度-时间变化曲线
3 讨论
药物颗粒在溶液状态下的饱和溶解度与颗粒药物粒径的大小相关,尤其当药物颗粒粒径<1 μm的临界状态时。药物颗粒粒径越小,其表面积越大,与溶剂接触面积也就越大,从而可提升其溶解度。大粒子的药物颗粒溶解度小,会引起粒径较大的药物颗粒逐渐聚集成团,而小粒径颗粒则会溶解越多的现象,叫奥氏熟化现象[9-11]。制备过程中,为了避免奥氏熟化现象,所制备的最终产品必须要求较窄的粒径分布(即较小的PDI值)。试验中采用聚乙烯吡咯烷酮K30作为制备PON-NPs的药物载体,对混悬剂的理化性质考查发现,在溶液中,泊那替尼纳米颗粒有较小的粒径和较小的PDI值,可较好地避免奥氏熟化现象。这也许是在制剂中,药物与表面活性有着较强的结合能力,且表面活性剂的稳定作用体现在将混悬液中纳米级药物粒子表面的界面张力降低,于是泊那替尼药物颗粒表面会形成致密界面,这一致密界面将药物颗粒紧紧地包裹住,防止其往溶液中扩散[12]。聚乙烯吡咯烷酮K30有与表面活性剂相似的稳定作用,在抑制药物粒子之间相互聚结成团方面发挥出重大作用,保证PON-NPs冻干粉具有极好的稳定性。以10%乳糖为冻干保护剂制备PON-NPs冻干粉,复溶后其理化性质与冻干前比较差异无统计学意义(P>0.05),说明10%乳糖能促进PON-NPs的稳定性。谢威等[13]研究表明,实验组所制备的奈韦拉平纳米混悬剂,制剂各项指标检测符合要求后,在大鼠体内进行药动学实验,结果说明奈韦拉平纳米混悬液能够明显改善大鼠体内奈韦拉平的药动学行为,与奈韦拉平混悬液相比,可显著提高奈韦拉平在大鼠体内的有效药物浓度,改善生物利用度。钟荣玲等[14]研制的姜黄素纳米混悬剂,处方是主药、胡椒碱和玉米醇溶蛋白,它们质量比例为5∶3∶1,然后利用大鼠为动物模型进行姜黄素纳米混悬剂药动学实验,结果与对照组姜黄素原料药相比,其AUC和Cmax明显得到升高,纳米混悬剂能有效地提高姜黄素的吸收、改善生物利用度。
PON-NPs冻干粉稳定性试验中冻干粉复溶后取样进样分析,并与泊那替尼原料药相比,前者的降解速率显著低于溶解状态下的泊那替尼,说明纳米级药物颗粒的稳定性显著高于原料药,可以长期储存。纳米混悬剂可以有效地解决药物的难溶解性问题,明显改善药物的生物利用度,提高疗效和治疗安全性,有望成为新型治疗费城染色体阳性的急性淋巴细胞白血病和慢性粒细胞白血病[15-16]的给药体系。将PON-NPs制成冻干粉,有利于药物的包装及运输,可为泊那替尼新的给药方式提供参考价值。
[1]Melkus M,Bennaceur-Griscelli A,Valogne Y,et al.Biological effects of T315I-mutated BCR-ABL in an embryonic stem cell-derived hematopoiesis model[J].Exp Hematol,2013,41(4):335-345.
[2]Gozgit J,Chen T,Schrock A,et al.A broad tumor cell line panel screen of ponatinib,a Pan-BCR-ABL and multitargeted kinase inhibitor[J].Sign Transd Modul,2012,11(8):407-409.
[3]朱建芬,吴祥根.纳米混悬剂的制备方法及在药剂学中应用的研究进展[J].中国医药工业杂志,2006,37(3):196-200.
[4]Muller RH,Jacobs C,Kayser O.Nanosuspensions as particulate drug formulations in therapy rationale for development and what we can expect for the future[J].Adv Drug Deliv Revi,2001,47(1):3-19.
[5]Möschwitzer JP,Müller RH.Factors influencing the release kinetics of drug nanocrystal-loaded pellet formulations[J].Drug Dev Ind Pharm,2013,39(5):762-769.
[6]Rai M,Ingle A.Role of nanotechnology in agriculture with special reference to management of insect pests[J].Appl Microbiol Biotechnol,2012,94(2):287-293.
[7]Salazar J,Mller RH,Mschwitzer JP.Application of the combinative particle size reduction technology H42 to produce fast dissolving glibenclamide tablets[J].Euro J Pharm Sci,2013,49(4):565-577.
[8]宋扬,王晶珂,彭冲.药物纳米混悬剂制备研究进展[J].河北化工,2013,36(2):13-16.
[9]Lindfors L,Skantze P,Skantze U,et al.Amorphous drug nanosuspensions.1.Inhibition of Ostwald ripening[J]. Langmuir,2006,22(3):906-911.
[10]Lindfors L,Forssen S,Skantze P,et al.Amorphous drug nanosuspensions.2.Experimental determination of bulk monomer concentrations[J].Langmuir,2006,22(3):911-916.
[11]Lindfors L,Skantze P,Skantze U,et al.Amorphous drug nanosuspensions.3.Particledissolutionandcrystal growth[J].Langmuir,2007,23(19):9866-9874.
[12]Moschwitzer J,Achleitner G,Pomper H,et al.Development of an intravenously injectable chemically stable aqueous omep razole formulation using nanosuspension technology[J].Eur J Pharm Biopharm,2004,58(3):6185-6191.
[13]谢威,郭嘉.奈韦拉平纳米混悬液的制备及大鼠体内药动学研究[J].中国药师,2015,18(1):23-27.
[14]钟荣玲,夏智,武洁,等.姜黄素纳米混悬剂在大鼠体内药代动力学考察[J].中国实验方剂学杂志,2013,19(20):137-139.
[15]Javier PI,Ian F.The expanding options for front-line treatment in patients with newly diagnosed CML[J].Crit Rev Oncol Hematol,2012,84(1):287-299.
[16]Wendy W.Ariad pharmaceutical′s ninja cancer drug inhibits armies of mutants:ariad′s ponatinib,a synthetic oral TKI,inhibits all the known Bcr-Abl mutations,including T315I as well as Ph+ALL[J].Chem Biol,2012,9(19):1075-1076.
Preparation and quality evaluation of Ponatinib Nanosuspension Lyophilized Powder
PENG RuiZHANG HongZHANG YingWEI Danyun
Department of Pharmacy,People′s Hospital of Wuhan University,Hubei Province,Wuhan430060,China
Objective To prepare Ponatinib Nanosuspension Lyophilized Power and investigate the cryoprotector,drug loading and stability.Methods Ponatinib Nanosuspension Lyophilized Power was prepared by solvent evaporation technology,the particle size and morphology were characterized by laser nanometer particle sizer and transmission electron microscopy(TEM).The optimal cryoprotector was selected,the drug loading and stability of Ponatinib Nanosuspension Lyophilized Power were determined by HPLC.Results The mean diameter of redissolved Ponatinib Nanosuspension Lyophilized Power was(92.2±5.6)nm,with polydisperse index of 0.29±0.65.TEM images showed spherical shape and uniform distribution.The nanosuspension which was lyophilized with 10%lactose presented optimal properties.The mean drug loading of Ponatinib Nanosuspension Lyophilized Power determined by HPLC was(16.3±0.8)%,with a good stability.Conclusion The preparation method of Ponatinib Nanosuspension Lyophilized Power is simple,which promises to be a novel nanometer drug delivery system for injection of Ponatinib.
Ponatinib;Nanosuspension;Lyophilized power;Drug loading;Stability
R927.1
A
1673-7210(2015)09(a)-0031-05
2015-02-09本文编辑:李亚聪)
彭锐(1989.10-),男,武汉大学2013级药剂学专业在读硕士研究生;研究方向:个体化用药。
张洪(1952.5-),男,博士,教授,主任药师;研究方向:消化系统疾病治疗药物的药剂学与药理学研究。
