新疆雪莲水孔蛋白sikPIP1基因的克隆与功能分析
2015-10-25黎玉顺刘逸泠刘步仓穆建强祝建波
黎玉顺 刘逸泠 刘步仓 穆建强 祝建波
(石河子大学生命科学学院 农业生物技术重点实验室,石河子 8320003)
新疆雪莲水孔蛋白sikPIP1基因的克隆与功能分析
黎玉顺 刘逸泠 刘步仓 穆建强 祝建波
(石河子大学生命科学学院农业生物技术重点实验室,石河子8320003)
利用PCR技术从已建立的新疆雪莲cDNA文库中克隆雪莲水孔蛋白基因sikPIP1,构建植物表达载体pBI121-sikPIP1,利用农杆菌介导法获得转基因烟草,PCR和RT-PCR检测证明该基因成功导入并得以转录,并对检测结果均为阳性的植株通过水分胁迫和温度胁迫进行抗旱性和抗寒性分析。结果显示:(1)克隆得到长为880 bp,具有水孔蛋白特性的sikPIP1基因,完整ORF为840 bp。(2)水分胁迫中,断水7 d后转基因烟草生长表型明显优于野生型烟草,生理指标测定结果显示,转基因烟草的相对电导率和丙二醛含量均低于野生型烟草,相对含水量高于野生型烟草。(3)不同温度胁迫处理,转基因烟草表型显著优于野生型,特别是0℃以下低温胁迫,野生型烟草出现严重的萎蔫,而转基因烟草受伤害程度较轻;生理指标结果显示转基因烟草相对电导率、丙二醛含量低于野生型烟草。结果表明,转sikPIP1基因提高了烟草抗旱能力和抗寒能力。
新疆雪莲;水孔蛋白;sikPIP1基因;烟草;抗寒性;抗旱性
水分是限制陆地生态系统生产力的主要环境因子,而植物自身对水分的调节能力决定了它们对环境压力的耐受性,很多环境因子如干旱、盐碱和极端温度都将影响植物各种生理过程中对水分的吸收、转运、储存和利用。水孔蛋白(Aquaporins,AQPs)是广泛存在于动物、植物、微生物细胞膜上转运水分子的特异通道蛋白,属于MIP(Major intrinsic protein)家族。人们最早在动物中发现并命名为AQP[1],主要是研究它的水通道作用。然而在对植物AQP的研究中发现AQPs不仅能特异性的转运水分子[2,3],还能转运甘油、H2O2、尿素、NH3、CO2等多种物质[4-8],并且对植物的生长、发育、适应环境变化等方面[9-12]也有着重要的作用。在植物基因组研究中发现,拟南芥中有35个AQPs、水稻有33个AQPs、玉米36个AQPs,苔藓23个AQPs,番茄37个AQPs、白杨55个AQPs[13-15]根据氨基酸序列的同源性及结构特征,植物AQP通常分为5类:质膜内在蛋白(Plasma membrane intrinsic proteins,PIPs);液泡膜内在蛋白(Tonoplast intrinsic proteins,TIPs);类 Nod26 膜内在蛋白(Nodulin 26-like intrinsic proteins,NIPs)存在于根瘤菌和豆科植物的共生膜上;小分子碱性膜内在蛋白(Small and basic intrinsic proteins,SIPs); 以及类 GlpF(Glycerolfacilitator) 膜 内 蛋 白(GlpF-like intrinsic proteins,GIPs)[16]。质膜内在蛋白(PIPs)作为AQP家族中的重要成员之一,包含PIP1和PIP2两个子类。研究表明,它们不仅参与细胞对外界水分的选择性运输,而且对植物生长过程中的干旱、低温等胁迫都有重要的作用[17-20]。Zhang等[21]研究发现在酵母细胞和拟南芥中过表达棉花GhPIP2;7基因能显著提高其对干旱的耐受能力。李嵘等[22]在水稻中过表达 OsPIP2;6,在干旱、低氧、高盐等逆境胁迫下转基因植株耐受能力均显著高于野生型,植株中OsPIP2;6的表达量也明显增高。Matsumoto等[23]发现PIP1过表达水稻植株比野生型对寒冷有更强的耐受。
新疆雪莲(Sasussured involucrata Kar. et Kir),属菊科(Compositae)菜蓟族(Trib. Cynareae Less.)凤毛菊属(Saussurea DC.)雪莲亚属;多年生一次性开花结实的高山冰缘宿根草本植物。主要生长在海拔2 400-4 100 m的高山冰渍石、流石滩、石隙、悬崖峭壁以及沙质湿地中[24,25]。新疆雪莲能在常年低温、低氧、强紫外且气候复杂多变的情况下完成生活史,其自身形成了一套与环境相适应的响应机制,并且在抵抗的过程中自身也具有与之有关的抗逆基因[26-28],从而使雪莲得以适应环境。因此,对天山雪莲基因功能的研究,不仅可以了解天山雪莲特殊的生理机能,而且通过基因工程手段将天山雪莲的基因转入农作物中,对培育抗逆作物也提供了一种有效的途径。
目前,针对PIPs的研究大多是关注其水分运输以及逆境胁迫下的内源表达,对单个基因的功能,以及外源表达研究较少。为进一步研究质膜内在蛋白基因PIPs与低温、干旱的关系,本研究从新疆雪莲cDNA文库中克隆质膜内在蛋白基因sikPIP1,构建植物表达载体pBI121-sikPIP1,通过农杆菌介导转化烟草,水分胁迫进行抗旱性分析和冷冻胁迫进行抗寒性分析,旨在进一步了解sikPIP1基因对逆境的耐受性,从而为水孔蛋白研究和利用提供理论依据与奠定实验基础。
1 材料与方法
1.1 材料
大肠杆菌(Escherichia coli)DH5α、农杆菌GV3101、植物表达载体pBI121、‘NC89’野生型烟草(Nicotiana tabacum L.)由石河子大学生命科学学院农业生物技术重点实验室保存。克隆载体pGM-T Easy购自天根生物公司。其它试剂均为国产或进口分析纯试剂,引物合成、测序均由上海生物工程公司进行。
1.2 方法
1.2.1 sikPIP1基因的克隆 从已建立的天山雪莲cDNA文库中随机挑取单克隆,采取通用引物M13进行PCR扩增并测序。选择与水孔蛋白基因同源的序列作为模板,利用Primer5.0设计PCR引物PP1和PP2。PP1:5'-TGCTCTAGAGCATGAGTTTTAGAG AGAGAAATGTCG-3'(Xba I),PP2:5'-TGCGAGCTCATTAATTTGTAGCATTGCTTCTGA-3'(Sac I)。采用Tiangen公司的Trizol总RNA提取试剂,提取天山雪莲的总RNA,以Oligo dT为引物将RNA反转录成cDNA,以PP1和PP2为引物进行PCR扩增。PCR反应程序为:94℃预变性5 min;94℃变性45 s,61℃复性30 s,72℃延伸45 s,35个循环;72℃延伸7 min;4℃保温。PCR产物经1.0%的琼脂糖凝胶电泳分离后,目的片段命名为sikPIP1;使用琼脂糖凝胶回收试剂盒回收目的基因;将回收的目的片段连接至载体pGM-T Easy,将阳性克隆命名为pGM-sikPIP1;酶切鉴定后送上海生工测序。利用DNAman软件分析测序结果序列,确定开放阅读框,推导相应的多肽序列。蛋白质氨基酸比对在NCBI的BlastT中分析;运用Mega软件对推导的多肽序列与已知报道的植物氨基酸序列进行系统进化分析。
1.2.2 植物表达载体的构建与转化 用Xba I/Sac I双酶切重组质粒pGM-sikPIP1和植物表达载体pBI121,1%的琼脂糖凝胶电泳后,使用琼脂糖凝胶回收试剂盒回收目的基因和载体大片段。两片段经T4 DNA连接酶16℃连接过夜,重组子转化大肠杆菌感受态细胞DH5α,含卡那霉素(60 mg/L)的平板培养过夜,挑选单菌落培养,PCR检测,提取PCR检测为阳性质粒并进行酶切鉴定。鉴定为双阳性的质粒即是pBI121-sikPIP1,将重组质粒用电击法转入农杆菌GV3101。
1.2.3 转基因烟草的获得及鉴定 经农杆菌pBI121-sikPIP1/GV3101介导叶盘法转化烟草‘NC89’,获得再生植株,移栽入营养土中。采用CTAB法提取再生烟草植株的基因组DNA,以pBI121-sikPIP1质粒为阳性对照,野生型受体DNA 为阴性对照,对目的基因进行PCR检测。用TRIzol法提取PCR检测结果为阳性的烟草植株以及受体烟草的总RNA,采用RT-PCR检测目的基因的转录水平。
1.2.4 转基因烟草水分胁迫实验 选择室内培养2个月,长势相近的野生型烟草和来自不同株系的转sikPIP1烟草各3株。实验前充分浇水,待底部托盘无水分进出时开始计时,进行自然干旱处理。停止供水13 d,第14天复水,实验共进行16 d。从第1天断水开始,每隔3 d根据李合生[29]的方法测量一次相对电导率、丙二醛、叶片相对含水量,实验重复3次,并记录烟草形态变化。
1.2.5 转基因烟草冷冻胁迫实验 整体植株的冷冻处理,选择室内培养2个月,长势相近的野生型烟草和来自不同株系的转sikPIP1烟草各3株,分别放入4℃、0℃、-2℃和-4℃的生化培养箱进行冷冻胁迫,4℃处理12 h,0℃、-2℃和-4℃处理4 h。记录各阶段烟草形态变化,测定烟草相对电导率和丙二醛含量,实验重复3次。
1.2.6 数据分析 所有数据处理均用Excel2003和SPSS Statistics软件分析处理,氨基酸序列分析用DNAman、Mega以及在线工具完成。
2 结果
2.1 s ikPIP1基因的克隆与分析
以天山雪莲cDNA为模板,利用设计好PCR引物PP1和PP2进行RT-PCR扩增,获得大小约为880 bp DNA片段,将目的片段sikPIP1克隆于pGM-T Easy载体,获得pGM-sikPIP1,用Xba I/Sac I双酶切鉴定,证明新疆雪莲水孔蛋白基因sikPIP1克隆成功。测序结果分析表明,sikPIP1基因的最大开放阅读框为840 bp,编码279个氨基酸,分子量为29.01 kD,pI为9.26。

图1 sikPIP1的氨基酸序列
目前研究发现在PIP、TIP、NIM和SIP四个亚家族中都具有共同的特征,即都有6个跨膜区、较短的保守AA基序PA和信号序列SGXHXNPAVT[30]。序列分析(图1)表明,sikPIP1不但具有MIP家族信号序列GGGANXXXXGY和TGI/TNPAR-SI/FGAAI/VI/VF/YN[12]。此外,序列分析还表明sik-PIP1具有一个PKA磷酸化位点(Ser113)和一个PKC的磷酸化位点(Ser186)。
根据推定的天山雪莲质膜水孔蛋白基因sikPIP1多肽序列在NCBI进行BLAST比对,挑选同源性高的比对结果,利用Mega软件构建不同物种间植物水孔蛋白基因的分子进化树(图2)发现,该蛋白与葡萄(Vitis vinifera)、无梗花栎(Quercus petraea)、甜菜(Beta vulgaris)亲缘关系最近,此外还与拟南芥(Arabidopsis thaliana)、陆地棉(Gossypium hirsutum)、胡桃(Juglans regia)等不同科属间植物亲缘关系较近,说明水孔蛋白基因在物种间进化比较保守,比对发现这些基因多为PIP2亚家族,因此可推测雪莲水孔蛋白基因sikPIP1也应属于PIP2亚家族。

图2 sikPIP1蛋白系统发育树
2.2 植物表达载体pBI121-sikPIP1的构建
用Xba I/Sac I双酶切植物表达载体pBI121和阳性克隆载体pGM-sikPIP1,构建植物表达载体pBI121-sikPIP1。提取PCR鉴定为阳性菌落的质粒,用Xba I/Sac I进行双酶切鉴定(图3),证明植物表达载体pBI121-sikPIP1构建成功。构建成功的植物表达载体通过电击法转化农杆菌GV3101,挑选单菌落进行PCR鉴定(图4)。
2.3 转基因烟草的获得及鉴定
以野生型烟草“NC89”为受体,用农杆菌pBI121-sikPIP1/GV3101介导转化,经卡那霉素筛选获得抗性再生植株,移栽入营养钵。对移栽烟草植株进行PCR(图5)和RT-PCR鉴定(图6)。将鉴定结果均为阳性的烟草进行进一步的生理指标测定。
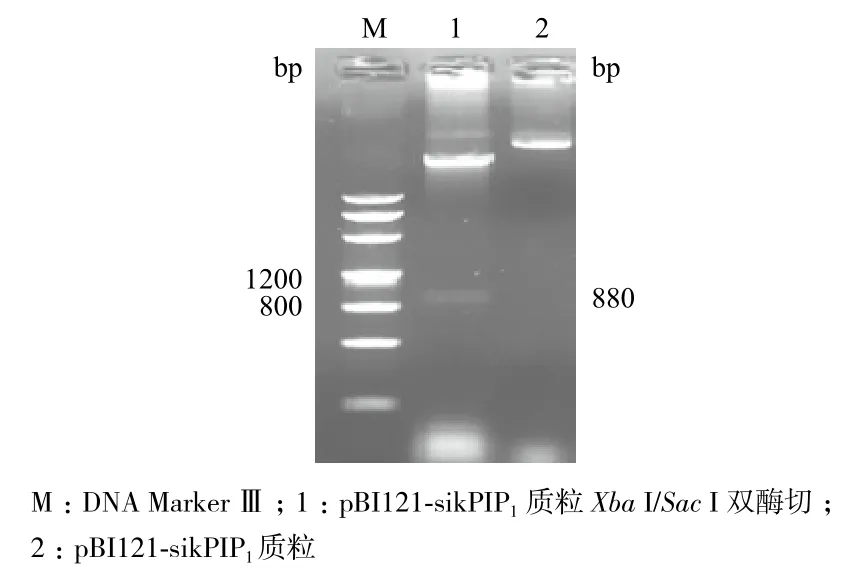
图3 pBI121-sikPIP1质粒酶切鉴定
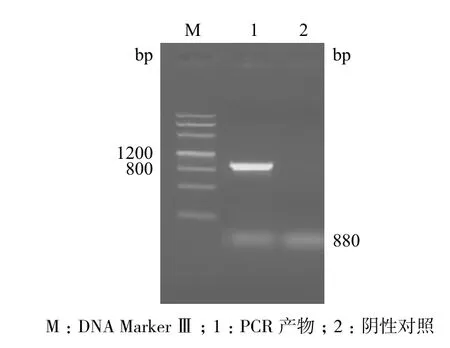
图4 pBI121-sikPIP1/GV3101 PCR检测
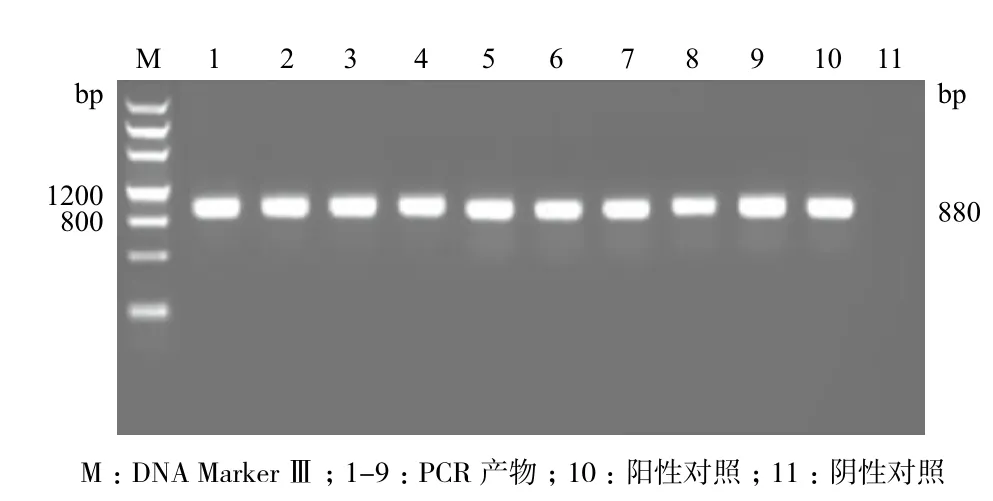
图5 pBI121-sikPIP1转基因烟草PCR检测

图6 pBI121-sikPIP1转基因烟草RT-PCR检测结果
2.4 水分胁迫下转基因烟草的形态特征及生理指标
2.4.1 形态特征 断水后7 d野生型烟草基部开始出现轻度萎蔫,叶片由下而上开始出现黄化,第10天已经严重萎蔫,第13天野生型烟草整株萎蔫;而转基因烟草第10天才出现轻度萎蔫现象,第13天叶片中度萎蔫(图7),复水2 d后转基因烟草恢复情况明显优于野生型烟草。可见,转雪莲sikPIP1基因烟草比对照野生型烟草表现出更强的耐旱性。

图7 水分胁迫下野生型烟草与转sikPIP1基因烟草的形态特征
2.4.2 生理指标 对水分胁迫下各阶段转sikPIP1基因烟草和野生型对照烟草的相对电导率、丙二醛(MDA)含量、相对含水量进行检测,结果(图8)表明,转基因烟草在水分胁迫中表现出较强的抗旱性。除第1天外,转基因烟草的相对电导率和MDA含量均低于野生型烟草,随着胁迫时间的增长,转基因烟草和野生型烟草的相对电导率和MDA含量都呈逐渐上升趋势,但野生型增加幅度和速度均大于转基因烟草,且差异显著(P<0.05)。转基因烟草的叶片相对含水量则高于野生型烟草,随着胁迫时间的延长,转基因烟草和野生型烟草的相对含水量均表现出下降趋势,野生型下降速度和幅度均大于转基因烟草。结果表明,转基因烟草比野生型烟草有更强的耐旱性。生理指标变化与形态特征变化保持一致,表明外源导入雪莲sikPIP1基因,能够提高烟草抗旱性,减少水分亏缺对植物的伤害。
2.5 温度胁迫对转基因烟草形态特征和生理指标的影响
2.5.1 形态特征 4℃处理12 h野生型烟草与转基因烟草表型均无明显变化,0℃处理4 h野生型烟草叶片出现少量伤斑,转基因烟草仍无明显变化;-2℃处理4 h转基因烟草叶片出现伤斑,组织出现轻微疲软,野生型烟草叶片严重萎蔫;-4℃处理4 h转基因烟草出现中度萎蔫,野生型烟草出现整株萎蔫(图9)。表明转入sikPIP1基因能提高烟草对低温的耐受能力。
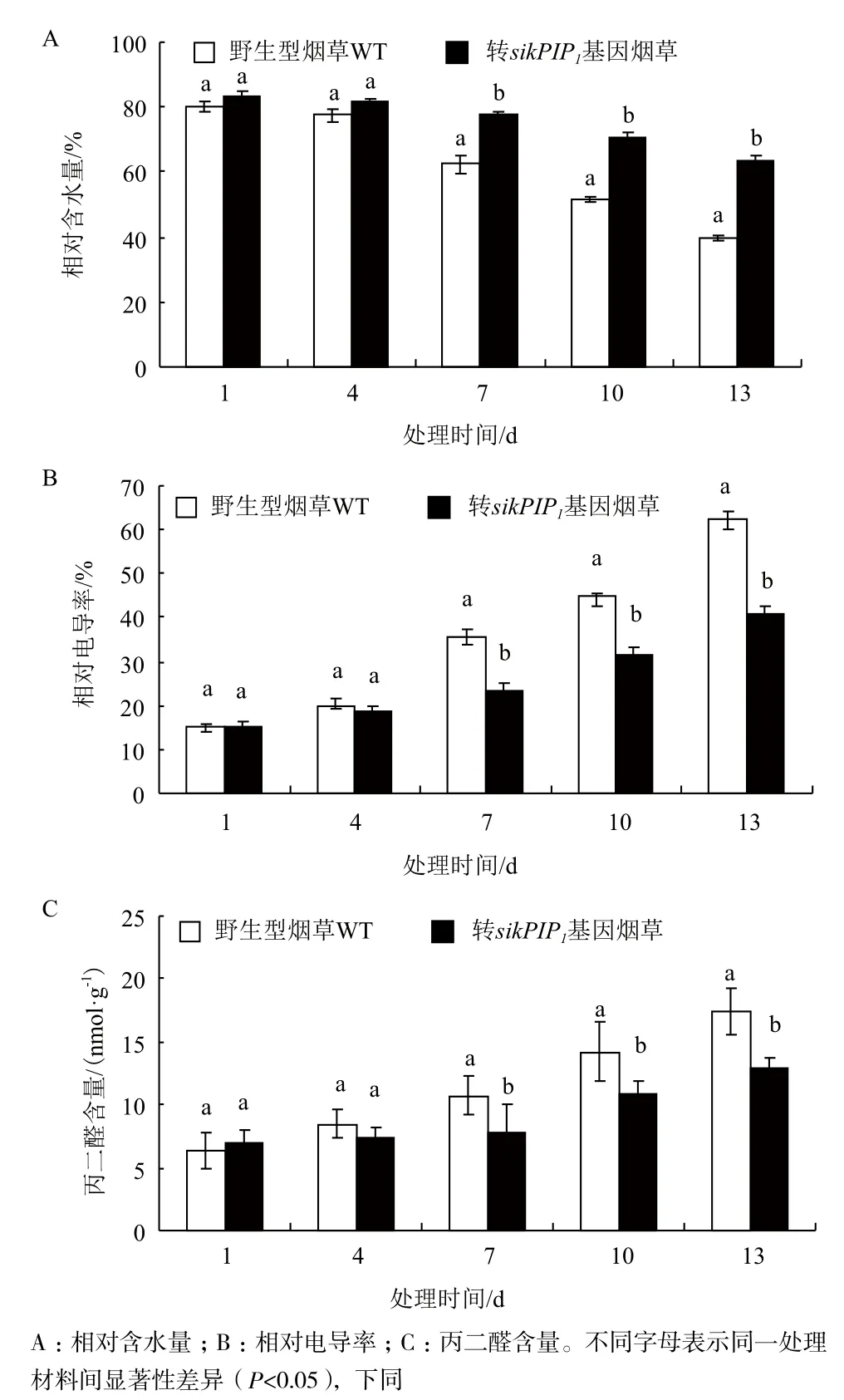
图8 水分胁迫下野生型烟草和转基因烟草植株的生理指标变化

图9 不同温度胁迫下野生型烟草和转sikPIP1基因烟草的形态特征
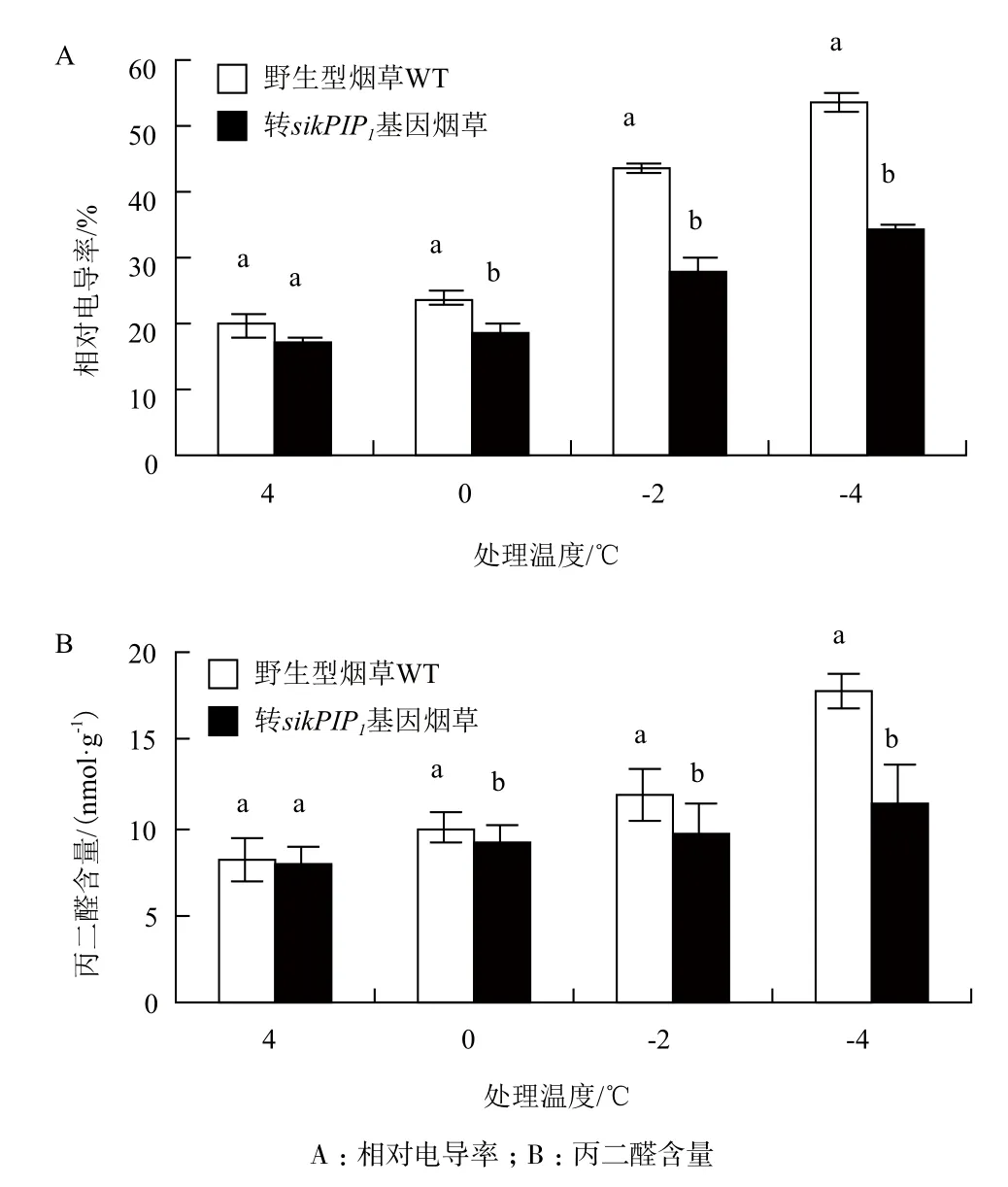
图10 温度胁迫下野生型烟草和转基因烟草植株的生理指标变化
2.5.2 生理指标 在温度胁迫实验中,对不同温度处理的野生型烟草和转基因烟草进行电导率和丙二醛含量的测定(图10)。全过程中野生型烟草的相对电导率和MDA含量都高于转基因烟草,且随着温度的降低野生型烟草和转基因烟草的相对电导率和MDA含量均呈上升趋势;4℃处理下野生型烟草与转基因烟草的相对电导率和MDA差异均不大;但在0℃、-2.0℃和-4.0℃处理下,野生型烟草的电导率和MDA上升速度与幅度均高于转基因烟草,且差异显著(P<0.05)。表明转基因烟草膜脂受伤程度较低,抗寒性相对较高,与形态特征结果保持一致,说明转入雪莲sikPIP1基因能提高烟草对低温的耐受性,降低植物在低温中的伤害。
3 讨论
AQP作为重要的生物膜功能蛋白,参与了多种重要的生理过程。其调节机制主要分为两种:一是通过调节AQP活性进行调节(如磷酸化、激素和Ca2+等);二是改变膜上AQP数量进行调节。近年来植物AQP的相关研究备受关注,越来越多的植物AQP被成功分离、并进行功能分析和调控机理的解析。植物AQP在受到不同环境因子或存在物种差异等因素时,往往表现出不同的反应,因此研究植物AQP在植物对不同环境因子(尤其是对水分和温度)适应中所起的作用就具有重要的意义。
AQP对于植物的最主要作用是水分运输,在水分亏缺情况下,AQP在植物应对水分胁迫的应答机制中起着重要的作用。Aharon等[31]通过对转入拟南芥PIP1b的转基因烟草研究发现,正常情况下,转PIP1b烟草长势优于对照,在干旱胁迫下,PIP1b超表达为负作用,植株萎蔫速度快于对照。本研究对转新疆雪莲sikPIP1基因烟草干旱胁迫发现,转基因植株抗旱能力明显优于对照,这与李嵘等[22]和Zhang等[21]外源表达PIP基因结果一致。说明AQP在植物响应水分胁迫时表现出不同的功能。
目前对植物低温耐受性研究主要集中在冷害(0℃以上低温)的研究中,本研究选择耐寒植物新疆雪莲为材料克隆水孔蛋白sikPIP1基因并转化烟草,结果发现转基因烟草抗寒(冰点以下低温)能力明显增强,这一结果与焦天奇等[26]克隆的雪莲水孔蛋白sikPIP3基因在烟草中表达结果一致,Lin等[32]在拟南芥中表达另一种耐寒植物人参的液泡膜水孔蛋白基因PgTIP1结果发现,过表达PgTIP1基因提高拟南芥的抗盐和抗旱能力,并展示出了更低的耐受温度。干旱和低温主要影响植物对水分的运输,在前人外源表达PIP1与PIP2基因的研究中发现PIP2基因比PIP1基因有更强的水通道特性,而PIP1与PIP2形成的异源四聚体比PIP2形成的同源四聚体也有更高的水透性,这一结果在水稻和玉米中都得以证实,说明PIP1与PIP2基因间存在协同作用[23,33],而雪莲的PIP1基因与PIP2基因间是否也存在这种协同作用,同时外源表达这两个基因能否进一步提高植株的抗逆能力,选择抗逆性强的基因材料来源是否可以表现出内源表达相似的结果,并且sikPIP1基因是否与其他抗逆基因间也存在这种协同作用值得我们进一步研究。
4 结论
本研究克隆了新疆雪莲水孔蛋白基因sikPIP1,并成功转化烟草。对获得的转基因植株进行逆境胁迫实验,结果表明,与野生型相比较,转sikPIP1基因烟草显著增强了对干旱和低温逆境条件的适应性。
[1] Denker BM, Smith BL, Kuhajda FP, et al. Identification, purification,and partial characterization of a novel Mr 28, 000 integral membrane protein from erythrocytes and renal tubules[J]. J Biol Chem,1988, 263(30):15634-15642
[2] Kaldenhoff R, Ribas-Carbo M, Sans JF, et al. . Aquaporins and plant water balance[J]. Plant Cell Environ, 2008, 31(5):658-666.
[3] Chaumont F, Moshelion M, Daniels MJ. Regu lation of plant aquaporin activity[J]. Biol Cell, 2005, 97(10):749-764.
[4] Bienert GP, Heinen RB, Berny MC, et al. Maize p lasma membrane aquaporin ZmPIP2;5, but not ZmPIP1;2, facilitates transmembrane diffusion of hydrogen peroxide[J]. Biochimica et Biophysica Acta, 2014, 1838:216-222.
[5] Hachez C, Besserer A, Chevalier AS, et al. Insights into plant plasma membrane aquaporin trafficking[J]. Plant Sci, 2013, 18(6):344-352.
[6] Schuurmans JA, van Dongen JT, Rutjens BPW, et al. Members of the aquaporin family in the developing pea seed coat include representatives of the PIP, TIP, and NIP subfamilies[J]. Plant Mol Biol, 2003, 53(5):655-667.
[7] Izumi CM, Jiye R, Mineo S, et al. CO2transport by PIP2 aquaporins of barley[J]. Plant Cell Physiol, 2014, 55(2):251-257.
[8] Holm LM, Jahn TP, Moller AL, et al. NH3and NH4+permeability in aquaporin-expressing Xenopus oocytes[J]. Pflugers Arch, 2005,450(6):415-428.
[9] Forrest KL, Bhave M. Major intrinsic proteins(MIPs)in plants:a complex gene family with major impacts on plant phenotype, Funt. Integr[J]. Genomics, 2007, 7(4):263-289.
[10] Aroca R, Ferrante A, Vernieri P, et al. Drought, abscisic acid and transpiration rate effects on the regulation of PIP aquaporin gene expression and abundance in Phaseolus vulgaris plants[J]. Ann Bot, 2006, 98(6):1301-1310.
[11] Heckwolf M, Pater D, Hanson DT, et al. The Arabidopsis thaliana aquaporin AtPIP1;2 is a physiologically relevant CO2trasport facilitator[J]. Plant J, 2011, 67(5):795-804.
[12] 李红梅, 丁岳炼, 黄新敏, 等. 香石竹切花水孔蛋白基因DcPIP2的克隆及特征分析[J]. 园艺学报, 2011, 38(11):2199-2208.
[13] Johanson U, Karlsson M, Johansson I, et al. The complete set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants[J]. Plant Physiol, 2001, 126(4):1358-1369.
[14] Sakurai J, Ishikawa F, Yamaguchi T, et al. Identification of 33 rice aquaporin genes and analysis of their expression and function[J]. Plant Cell Physiol, 2005, 46(9):1568-1577.
[15] Danielson JAH, Johanson U. Unexpected complexity of the aquaporin gene family in the moss Physcomitrella patens[J]. BMC Plant Biol, 2008, 8:45.
[16] Wudick MM, Luu DT, Maurel C. A look inside:localization patterns and functions of intracellular plant aquaporins[J]. New Phytol, 2009, 184(2):289-302.
[17] Jang JY, Lee SH, Rhee JY, et al. Transgenic arabidopsis and tobacco plants overexpressing an aquaporin respond differently to various abiotic stresses[J]. Plant Mol Biol, 2007, 64:621-632.
[18] Lee SH, Chung GC, Jang, JY, et al. Overexpression of PIP2;5 aquaporin alleviates effects of low root temperature on cell hydraulic conductivity and growth in Arabidopsis[J]. Plant Physiology, 2012, 159(1):479-488.
[19] Aroca R, Porcel R, Ruiz-Lozano JM. Regulation of root water uptake under abiotic stress conditions[J]. J Exp Bot, 2012, 63(1):43-57.
[20] Liu CW, Fukumoto T, Matsumoto T, et al . Aquaporin OsPIP1;1 promotes rice salt resistance and seed germination[J]. Plant Physiol Biochem, 2013, 63:151-158.
[21] Zhang J, Li DD, Zou D, et al. A cotton gene encoding a plasma membrane aquaporin is involved in seedling development and in response to drought stress[J]. Acta Biochim Biophys Sin, 2013,45:104-114.
[22] 李嵘, 牛向丽, 苗雁文, 等. 水通道蛋白基因OsPIP2;6的功能分析[J]. 中国农业科学, 2013, 46(15):3079-3086.
[23] Matsumoto T, Lian HL, Su WA, et al. Role of the aquaporin PIP1subfamily in the chilling tolerance of rice[J]. Plant Cell Physiol,2009, 50(2):216-229.
[24] 陈发菊. 我国雪莲植物的种类、生境分布及化学成分的研究进展[J]. 植物学通报, 1999, 16(5):561-566.
[25] 庄丽, 李卫红, 孟丽红. 新疆雪莲资源的利用、研发与保护[J].干旱区资源与环境, 2006, 20(2):195-202.
[26] 焦天奇, 孙辉, 祝建波, 等. 转天山雪莲sikPIP3基因烟草的获得及抗逆性鉴定[J]. 西北植物学报, 2012, 32(3):431-438.
[27] 郭新勇, 程晨, 祝建波, 等. 天山雪莲冷调节蛋白基因siCOR转化烟草植株的抗旱性分析[J]. 植物学报, 2012, 47(2):111-119.
[28] 程晨, 郭新勇, 王爱英, 祝建波. 转新疆雪莲去饱和酶基因sikSAD重组酵母低温和酒精耐受性分析[J]. 微生物学报,2011, 38(11):1647-1656.
[29] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社, 2003:164-263.
[30] Park JH, Saier MH. Phylogenetic characterization of the MIP family of tranmembrare channel protein[J]. Membr Biol, 1996(153):171-180.
[31] Aharon R, Shahak Y, Wininger S, et al. Overexpression of a plasma membrane aquaporin in transgenic tobacco improves plant vigor under favorable growth conditions but not under drought or salt stress[J]. Plant Cell, 2003, 15(2):439-447.
[32] Lin W, Peng Y, Li G, et al. Isolation and functional characterization of PgTIP1, a hormone-autotrophic cells-specific tonoplast aquaporin in ginseng[J]. J Experimental Botany, 2007, 58(5):947-956.
[33] Fetter K, Van Wilder V, Moshelion M, et al. Interactions between plasma membrane aquaporins modulate their water channel activity[J]. Plant Cell, 2004, 16(1):215-228.
(责任编辑 马鑫)
Cloning and Function Analysis of Aquaporin Protein Gene sikPIP1from Saussurea involucrata Kar. et K ir
Li Yushun Liu Yiling Liu Bucang Mu Jianqiang Zhu Jianbo
(Key Laboratory of Agricultural Biotechnology,College of Life Science,Shihezi University,Shihezi8320003)
Saussurea involucrata aquaporin protein gene sikPIP1was cloned from established cDNA library by PCR technique. Then a plant expression vector of pBI121-sikPIP1was constructed and transgenic tobacco plants were obtained by Agrobacterium-mediated method. The analysis by PCR and RT-PCR indicated that the aquaporin protein gene sikPIP1had been integrated and transcribed into the tobacco genome. The drought and cold resistance by water stress and low-temperature stress for the positive plants from above PCR and RT-PCR examination were analyzed. The results showed that:(1)The plasma membrane aquaporin gene sikPIP1was cloned with the length of 880 bp and complete ORF of 840 bp. (2)Under the water stress, the growth phenotype of transgenic tobacco was evidently better than wild-type after 7 days’ waterbreak, the results of physiological index showed that relative conductivity and MDA content of transgenic tobacco were lower than those of wild-type. However, the relative water content of transgenic tobacco was higher than that of wild-type. (3)The growth phenotype of transgenic tobacco was significantly better than that of wild-type under the different temperature stress. Especially below the 0 degree, the wild-type ones were wilting seriously, however, the transgenic tobacco had less damages. The results of physiological index showed that relative conductivity and MDA content of transgenic tobacco were lower than that of wild-type. The testing results showed that sikPIP1gene improved tobacco’s tolerance of drought and cold.
Sasussured involucrate;aquaporin protein;sikPIP1gene;tobacco;drought tolerance;cold tolerance
10.13560/j.cnki.biotech.bull.1985.2015.09.013
2015-01-27
国家自然科学基金项目(C020406,C020407)
黎玉顺,男,硕士研究生,研究方向:植物适应逆境的分子机理;E-mail:liyushunshz@163.com
祝建波,男,研究员,研究方向:植物基因工程;E-mail:zjbshz@163.com
