Cry1Ab/Cry1Ah杂合蛋白构建与功能研究
2015-10-25徐曼蒋健束长龙张杰宋福平
徐曼蒋健束长龙张杰,宋福平,
(1东北农业大学,哈尔滨 150030;2.中国农业科学院植物保护研究所 植物病虫害国家重点实验室,北京 100193)
Cry1Ab/Cry1Ah杂合蛋白构建与功能研究
徐曼1蒋健2束长龙2张杰1,2宋福平1,2
(1东北农业大学,哈尔滨150030;2.中国农业科学院植物保护研究所植物病虫害国家重点实验室,北京100193)
Cry1A类杀虫蛋白是目前应用最为广泛的杀虫蛋白,目前已经报道的Cry1A类杀虫蛋白之间存在普遍的结构域交换现象。针对鳞翅目害虫具有高活性的Cry1Ab与Cry1Ah蛋白开展研究,构建了Cry1Ab、Cry1Ah的杂合蛋白AhAhAb并测定了杀虫活性。结果显示,Cry1Ab、Cry1Ah的结构域交换引起蛋白杀虫活性的显著变化,与出发蛋白相比,杂合蛋白AhAhAb丧失了对棉铃虫杀虫活性,降低了对玉米螟、小菜蛾杀虫活性。利用生物信息学方法对Cry1Ah结构域I建模,并分析其与其他Cry1A蛋白结构及表面性质差异,分析表明Cry1Ah与Cry1Ab的结构域I有相同的碳骨架和二级结构,但是表面电势分布有较大差异。进一步分析杂合蛋白AhAhAb与Cry1Ab、Cry1Ah之间杀虫活性差异的原因对进一步揭示Cry1A类蛋白杀虫特异性进化规律有重要意义。
Cry1Ah;结构域I;杀虫活性
苏云金芽胞杆菌(Bacillus thuringiensis,Bt)是一种广泛分布的革兰氏阳性细菌,在形成芽胞的同时能产生由cry或cyt基因编码的杀虫晶体蛋白(Insecticidal crystal proteins,ICPs),对多种害虫有特异杀虫活性[1,2]。目前,Bt不仅被开发成生物农药在害虫防治中得到应用,表达Bt Cry蛋白的转基因抗虫植物也已经被广泛种植,实现了巨大的经济效益与生态效益。其中,Cry1A是一个对鳞翅目害虫有高活性的杀虫蛋白家族,目前已知的Cry1A类基 因 有 cry1Aa、cry1Ab、cry1Ac、cry1Ad、cry1Ae、cry1Af、cry1Ag、cry1Ah、cry1Ai及cry1Aj等10个模式种类,112个杀虫基因,编码130 kD左右的蛋白(http://www.lifesci.sussex.ac.uk/home/Neil_Crickmore/ Bt/)。这些基因中cry1Ab、cry1Ac应用最为广泛,cry1Ah是中国农业科学院植物保护研究所克隆的具有自主知识产权的杀虫基因(专利号:ZL20041000-9918.9),其编码的 Cry1Ah 蛋白对棉铃虫(Helicoverpa armigera)、亚 洲 玉 米 螟(Ostrinia furnacalis)和水稻二化螟(Chilo suppressalis)等多种鳞翅目害虫具有很高的毒杀活性,超过目前商业化的 cry1Ab、cry1Ac 等基因[3,4],具有巨大的应用前景,目前正在利用其进行转基因抗虫植物研究[5-7]。
Cry1A类蛋白属于典型的3个结构域蛋白(3 Domain,3D)。结构域I由7个α螺旋组成(其中6个两性螺旋围绕1个中心螺旋);结构域II,也称作β“三棱镜”,由3个β折叠片对称折叠形成一个“希腊钥匙”形状的结构;结构域III,是一种两个反平行的β-折叠片包裹在一个类似 “果冻卷”中的结构。研究结果表明,结构域I与蛋白插入细胞膜以及形成穿孔有关,结构域II和III都与受体识别及结合有关,决定杀虫特异性。对目前已经明确杀虫活性蛋白的各结构域进行序列比对聚类发现,部分杀虫活性(特别是Cry1类蛋白)可以由结构域III的重组获得,Cry毒素结构域交换是一种杀虫特异性进化的机制。
通过序列比对发现,Cry1Ab、Cry1Ac、Cry1Ah三个蛋白之间有共同的结构域II(序列一致性大于97%);Cry1Ab、Cry1Ac有共同的结构域I(序列一致性为98%);而Cry1Ac、Cry1Ah有共同的结构域III(序列一致性为100%)。Cry1Ab结构域III与Cry1Ac、Cry1Ah不同,但是在Cry1A家族中比较常见,与Cry1Aa、Cry1Ae、Cry1Af等蛋白结构域III序列一致性大于97%;Cry1Ah结构域I比较独特,不仅与Cry1Ab、Cry1Ac不同,与所有报道的Bt杀虫蛋白的结构域I差异都较大(序列一致性都小于72%)。本研究通过同源建模的方法比较Cry1Ab和Cry1Ah结构域I结构、表面电荷分布特点;进一步构建Cry1Ab和Cry1Ah的杂合蛋白并测定杀虫谱,分析结构交换对Cry1Ab和Cry1Ah杀虫活性的影响,旨在对进一步揭示Cry1A类蛋白杀虫特异性进化规律奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株和质粒 本研究所用到的菌株和质粒,见表1。

表1 菌株与质粒
1.1.2 培养基及生化试剂 LB培养基:1.0% 胰蛋白胨,0.5% 酵母提取物,1.0% 氯化钠,pH7.0。ZYP-5052培养基和50×5052诱导剂。Primer star高保真DNA聚合酶购自宝生物工程大连有限公司(TaKaRa/Japan),限制性内切酶、DNA连接试剂盒、DNA回收试剂盒等购自Axygen公司(Axygen/USA)。
1.1.3 供试昆虫 敏感种群小菜蛾由本实验室提供;棉铃虫、亚洲玉米螟分别由中国农业科学院植物保护研究所棉花害虫组和玉米害虫组提供;甜菜夜蛾由武汉科诺公司提供。
1.2 方法
1.2.1 蛋白质序列与结构分析 首先将要分析蛋白氨基酸序列提交NCBI保守结构与数据库(Conserved Domain Database,CDD)进行比对,获取蛋白中对应Endotoxin_N,Endotoxin_M,Endotoxin_C三个结构域的氨基酸序列,并通过BLAST的方法比较杀虫蛋白氨基酸序列间的一致性。进一步利用SWISS-MODEL(http://swissmodel.expasy.org/)对3个结构域对应氨基酸序列进行自动建模,获得的三维结构进一步用PyMOL软件包进行结构比对与表面特性分析。
1.2.2 杂合蛋白构建 采用无缝克隆的方法构建Cry1Ah与Cry1Ab杂合蛋白AhAhAb,杂合蛋白具备Cry1Ah结构域I和结构域II、Cry1Ab结构域III,引物Cry1AhF和AhAhAbR用于扩增Cry1Ah结构域I和结构域II,引物AhAhAbF和Cry1AbR用于扩增Cry1Ab结构域III,表达载体是pET21b。杂合蛋白载体构建引物序列,见表2。
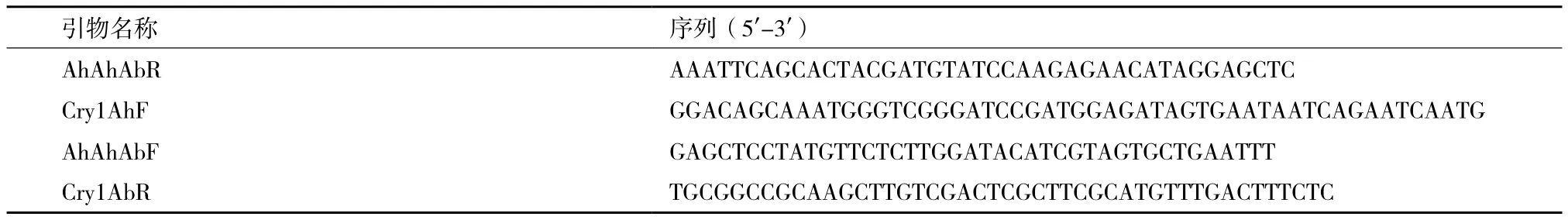
表2 杂合蛋白载体构建引物序列
1.2.3 杂合蛋白表达与分析 方向正确的重组质粒转入表达菌株Rosetta(DE3),进行IPTG诱导表达,诱导表达条件见参考文献[8]。在20 mmol/L Tris·Cl(pH8.0)缓冲液中进行细胞破碎,然后可溶组分和不可溶组份分别进行SDS-PAGE分析,蛋白电泳样品制备与SDS-PAGE分析方法参见文献[9]。蛋白定量后进行活性测定,棉铃虫、亚洲玉米螟、小菜蛾、甜菜夜蛾的生物测定方法参照文献[10-12]。此外,利用Image-J软件包对照片中试虫的身长进行测定,比较发育情况。
2 结果
2.1 Cry1Ah与Cry1Ab、Cry1Ac序列比较
通过NCBI保守结构与数据库(Conserved domain database,CDD)进 行 比 对 分 析 发 现,Cry1Ah1蛋白的结构域I、结构域II、结构域III分别位于第57-275位、第280-481位、第491-629位氨基酸。分别将Cry1Ah1全长蛋白、3个结构域核心活性区及3个独立结构域与Cry1Ab、Cry1Ac进行比较发现,Cry1Ah1的Endotoxin_N结构域与Cry1Ab、Cry1Ac不同,而Cry1Ab的Endotoxin_C与Cry1Ac、Cry1Ah差异较大,3个蛋白的Endotoxin_M一致性大于98%(表3)。

表3 Cry1Ah1与Cry1Ab13、Cry1Ac1序列比较/%
2.2 Cry1Ah与Cry1Ab结构域I比较
由于Cry1Ah1与Cry1Ab13除结构域I差异外,两者结构域III还存在较大差异,因此可以通过构建Cry1Ah1与Cry1Ab13杂合蛋白来分析Cry1Ah1结构域I对Cry1A杀虫蛋白活性的影响。利用SWISS-MODEL自动建模功能分别获得了Cry1Ah1与Cry1Ab13结构域I以及3个结构域核心活性区的结构信息(图1),通过分子叠合比对发现,尽管Cry1Ah1与Cry1Ab13序列存在较大差异(31%),但是两者结构域I的碳骨架没有差异(图1)。进一步分析了结构域I的表面结构与表面静电势分布,结果显示尽管两个蛋白结构域I的碳骨架没有差异,由于氨基酸序列以及氨基酸侧链基团不同,两个蛋白的结构表面以及电势分布都有所不同(图2)。

图1 Cry1Ah1与Cry1Ab13结构域I碳骨架及二级结构比较
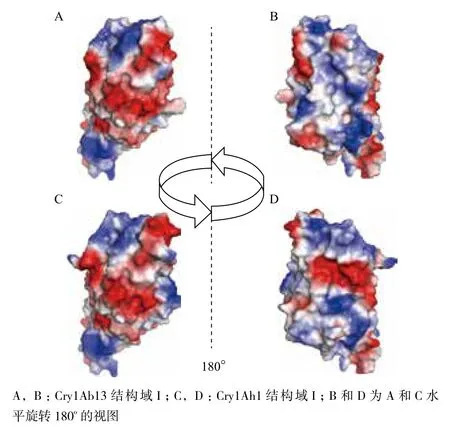
图2 Cry1Ah1与Cry1Ab13结构域I表面结构以及静电势分布比较
2.3 Cry1Ah与Cry1Ab杂合蛋白构建与表达
由于Cry1Ah1与Cry1Ab13结构域I、结构域II、结构域III的氨基酸序列一致性分别为69%、98%和42%,进一步构建了AhAhAb杂合蛋白。图3显示,杂合蛋白AhAhAb含有了源于Cry1Ah1的结构域I、结构域II,源于Cry1Ab13结构域III;进一步将构建好的重组质粒转化BL21 Rosetta(DE3)进行诱导表达,结果(图4)显示AhAhAb细胞不可溶组分明显出现约76 kD的目标蛋白条带,而可溶组分中未检测到目标蛋白条带。

图4 杂合蛋白表达产物的SDS-PAGE分析
2.4 生物活性测定
对AhAhAb蛋白进行了小菜蛾、玉米螟、棉铃虫、甜菜夜蛾的杀虫活性测定,结果(图5)显示,杂合蛋白AhAhAb对棉铃虫在100 ppm时无发育抑制或致死活性;在高浓度(100 ppm)时对甜菜夜蛾有发育抑制活性,处理组存活的试虫平均体长为对照组的79%;对小菜蛾活性较低,LC50为10.99 ppm,95% 置信区间为(4.57-23.38);对玉米螟的活性较低,LC50为13.66 ppm,95% 置信区间为(8.51-27.40),并且主要活性表现为发育抑制,在蛋白浓度为10.00 ppm时,只有7%的试虫有较好的发育。

图5 AhAhAb蛋白对甜菜夜蛾发育抑制活性
3 讨论
Bt不仅可以杀灭多种农业害虫,而且其杀虫活性具有高度的特异性,对非靶标生物安全无害。Bt这种高度特异的杀虫活性主要由其编码的Cry蛋白决定的,因此研究Cry蛋白杀虫特异性及其进化规律对Cry蛋白改良与应用有重要意义。本研究针对鳞翅目害虫高效的Cry1Ab13与Cry1Ah1开展研究,分析杂合蛋白的杀虫谱,对理解Cry1A蛋白杀虫特异性的进化有重要意义。
为了研究Cry蛋白杀虫机制,目前已有多个杀虫蛋白(Cry1[13]、Cry2[14]、Cry3[15]、Cry4[16]以及Cry8[17])的三维结构通过X射线晶体衍射的方法被解析出来,它们的结构非常相似,都有3个结构域。本研究利用同源建模的方法分析Cry1Ab13与Cry1Ah1的结构域I发现,两者具有相同的碳骨架,但是蛋白表面结构和电荷分布都有所不同,这可以为进一步分析杂合蛋白活性变化的原因提供结构信息依据。
对目前已经明确杀虫活性蛋白的各结构域进行序列比对聚类发现,部分杀虫活性多样性(特别是 Cry类蛋白)可以由结构域III的重组获得,Cry毒素结构域交换是一种新的杀虫特异性进化的机制。例如:Cry1Ca和Cry1Cb以及Cry1Ea和Cry1Eb等蛋白的结构域I和II非常相似,而序列分析发现Cry1Ca和Cry1Ea的结构域III有共同的起源,Cry1Cb和Cry1Eb结构域III也由相同的序列变异而来,与Cry1Be的结构域III极为相似。进一步的人工杂合蛋白构建的研究也支持这一结论,一些Cry1蛋白(如Cry1Ab、Cry1Ac、Cry1Ba和Cry1Ea)对甜菜夜蛾低或无活性,当它们的结构域III被Cry1Ca取代后,则变得具有活性[18]。此外,进一步的研究认为,结构域I交换会引起杀虫蛋白在靶标害虫中肠道细胞形成孔洞大小的不同,不会影响蛋白的杀虫特异性[19]。本研究涉及的Cry1Ac、Cry1Ab与Cry1Ah蛋白之间也存在结构域交换的情况(Cry1Ab、Cry1Ac有相似的结构域I和II、不同的结构域III;Cry1Ac、Cry1Ah有相似的结构域II和III、不同的结构域I),这些变化没有影响蛋白对主要农业害虫小菜蛾、玉米螟、棉铃虫的杀虫谱[20]。本研究构建的杂合蛋白AhAhAb与Cry1Ab相比,有相似的结构域II和III、不同的结构域I,杀虫活性测定结果显示,杂合蛋白丧失了对棉铃虫的杀虫活性,改变了对玉米螟活性类型。然而,Cry1Ac与Cry1Ah之间同样有相似的结构域II和III、不同的结构域I,但是两者在这3种试虫的杀虫谱上却没有差异,只是活性强度略有不同。这些数据显示,3D Cry蛋白杀虫特异性不仅可能与结构域II、结构域III有关,还有可能与包括结构域I在内的3个结构域的组合有关。本研究数据显示,尽管Cry1Ah结构域I碳骨架和二级结构其他Cry1A蛋白一致,然而由于氨基酸序列的差异,结构域I的表面基团及电势分布有较大差异[21]。3D Cry蛋白中3个结构域两两之间都有接触,包括结构域I在内的不同的结构域组合都会影响蛋白结构表面微环境的变化,这些变化可能会对Cry蛋白的性质产生影响。进一步分析杂合蛋白AhAhAb与Cry1Ab、Cry1Ah之间杀虫活性变化的原因对进一步揭示Cry1A类蛋白杀虫特异性进化规律有重要意义。
4 结论
本研究针对鳞翅目害虫具有高活性的Cry1A类蛋白开展研究,构建了Cry1Ab、Cry1Ah的杂合蛋白AhAhAb并测定了杀虫谱,结果显示Cry1Ab,Cry1Ah的结构域交换引起蛋白杀虫谱的显著变化。
[1]de Maagd RA, Bravo A, Crickmore N. How Bacillus thuringiensis has evolved specific toxins to colonize the insect world[J]. Trends Genet, 2001, 17(4):193-199.
[2]Bravo A, Gomez I, Porta H, et al. Evolution of Bacillus thuringiensis Cry toxins insecticidal activity[J]. Microb Biotechnol, 2013, 6(1):17-26.
[3]Xue J, Zhou Z, Song F, et al. Identifica tion of the minimal active fragment of the Cry1Ah toxin[J]. Biotechnol Lett, 2011, 33(3):531-537.
[4]Xue J, Liang G, Crickmore N, et al. Cloning and characterization of a novel Cry1A toxin from Bacillus thuringiensis with high toxicity to the Asian corn borer and other lepidopteran insects[J]. FEMS Microbiol Lett, 2008, 280(1):95-101.
[5]Song Y, Liang C, Wang W, et al. Immuno toxicological evaluation of corn genetically modified with Bacillus thuringiensis Cry1Ah gene by a 30-day feeding study in BALB/c mice[J]. PLoS One, 2014, 9(2):78566-78674.
[6]Sun H, Lang Z, Zhu L, et al. Acquiring transgenic tobacco plants with insect resistance and glyphosate tolerance by fusion gene transformation[J]. Plant Cell Rep, 2012, 31(10):1877-1887.
[7]Dai PL, Zhou W, Zhang J, et al. The effects of Bt Cry1Ah toxin on worker honeybees(Apis mellifera ligustica and Apis cerana cerana)[J]. Apidologie, 2012, 43(4):384-391.
[8]Shu C, Liu D, Zhou Z, et al. An improved PCR-restriction fragment length polymorphism(RFLP)method for the identification of cry1-type genes[J]. Appl Environ Microbiol, 2013, 79(21):6706-6711.
[9]Kotik M, Kočanová M, Marešová H, et al. High-level expression of a fungal pyranose oxidase in high cell-density fed-batch cultivations of Escherichia coli using lactose as inducer[J]. Protein Expression and Purification, 2004, 36(1):61-69.
[10]Wu K, Guo Y, Lv N. Geographic variation in susceptibility of Helicoverpa armigera(Lepidoptera:Noctuidae)to Bacillus thuringiensis insecticidal p rotein in China[J]. Journal of Economic Entomology, 1999, 92(2):273-278.
[11]Tabashnik BE, Finson N, Chilcutt CF, et al. Increasing efficiency of bioassays:evaluating resistance to Bacillus thuringiensis in diamondback moth(Lepidoptera:Plutellidae)[J]. Journal of economic entomology, 1993, 86(3):635-644.
[12]Shu C, Su H, Zhang J, et al. Characterization of cry9Da4,cry9Eb2, and cry9Ee1 genes from Bacillus thuringiensis strain T03B001[J]. Appl Microbiol Biotechnol, 2013, 97(22):9705-9713.
[13]Grochulski P, Masson L, Borisova S, et al. Bacillus thuringiensis CryIA(a)insecticidal toxin:crystal structure and channel formation[J]. J Mol Biol, 1995, 254(3):447-464.
[14]Morse RJ, Yamamoto T, Stroud RM. Structure of Cry2Aa suggests an unexpected receptor binding epitope[J]. Structure, 2001, 9(5):409-417.
[15]Galitsky N, Cody V, Wojtczak A, et al. Structure of the insecticidal bacterial delta-endotoxin Cry3Bb1 of Bacillus thuringiensis[J]. Acta Crystallogr D Biol Crystallogr, 2001, 57(Pt8):1101-1109.
[16]Boonserm P, Davis P, Ellar DJ, et al. Crystal structure of the mosquito-larvicidal toxin Cry4Ba and its biological implications[J]. J Mol Biol, 2005, 348(2):363-382.
[17]Guo S, Ye S, Liu Y, et al. Crystal structure of Bacillus thuringiensis Cry8Ea1:An insecticidal toxin toxic to underground pests, the larvae of Holotrichia parallela[J]. J Struct Biol, 2009, 168(2):259-266.
[18]de Maagd RA, Weemen-Hendriks M, Stiekema W, et al. Bacillus thuringiensis delta-endotoxin Cry1C domain III can function as a specificity determinant for Spodoptera exigua in different, but not all, Cry1-Cry1C hybrids[J]. Appl Environ Microbiol, 2000, 66(4):1559-1563.
[19]Rang C, Vachon V, de Maagd RA, et al. Interaction between functional domains of Bacillus thuringiensis insecticidal crystal proteins[J]. Appl Environ Microbiol, 1999, 65(7):2918-2925.
[20]Gouffon C, Van Vliet A, Van Rie J, et al. Binding sites for Bacillus thuringiensis Cry2Ae toxin on heliothine brush border membrane vesicles are not shared with Cry1A, Cry1F, or Vip3A toxin[J]. Appl Environ Microbiol, 2011, 77(10):3182-3188.
[21]Hibi M, Kawashima T, Kodera T, et al. Characterization of Bacillus thuringiensis L-isoleucine dioxygenase for production of useful am ino acids[J]. Appl Environ Microbiol, 2011, 77(19):6926-6930.
(责任编辑 狄艳红)
Creation of Cry1Ab/Cry1Ah Hybrid Proteins and Its Functional Analysis
Xu Man1Jiang Jian2Shu Changlong2Zhang Jie1,2Song Fuping1,2
(1. Northeast Agricultural University,Harbin150030;2. State Key Laboratory of Plant Diseases and Insect Pests,Institute of Plant Protection of Chinese Academy of Agricultural Sciences,Beijing100193)
Cry1A is the most widely used insecticidal protein, and the domain swapping in the reported Cry1A family frequently occurs. In this paper, we investigated the Lepidoptera pests’ highly active protein Cry1Ab and Cry1Ah, and constructed the hybrid protein AhAhAb from Cry1Ab/Cry1Ah and bioassayed the activities. The results showed that the domain swapping of two proteins Cry1Ab and Cry1Ah resulted in the insecticidal activities significantly changed. Compared with the origin proteins, hybrid protein AhAhAb lost the insecticidal activity to Heliothis armigera, caused the insecticidal activity to Ostrinia nubilalis, Plutella xylostella reduced. We then modeled Cry1Ah domain I, and compared the structure and the surface properties with other Cry1A proteins by bioinformatics methods. The results indicated that domain I of Cry1Ah and Cry1Ab had identical carbon skeleton and secondary structure but varied surface and potential distribution. The further studies on the reasons of the activity’s difference between hybrid protein AhAhAb and Cry1Ab or Cry1Ah will give enlightenment for unclosing the evolution pattern of insecticidal specificity of Cry1A family proteins.
Cry1Ah;domain I;insecticidal activity
10.13560/j.cnki.biotech.bull.1985.2015.09.012
2015-03-06
国家转基因专项(2014ZX0800912B,2014ZX08009003-001-004)
徐曼,女,硕士研究生,研究方向:分子遗传学;E-mail:dianxin5@126.com
宋福平,男,研究员,研究方向:苏云金芽胞杆菌;E-mail:fpsong@ippcaas.cn
