反相高效液相色谱法测定盐酸倍他司汀氯化钠注射液中主药含量
2015-10-25逯小萌
逯小萌
(河南省濮阳市食品药品检验所,河南濮阳457000)
反相高效液相色谱法测定盐酸倍他司汀氯化钠注射液中主药含量
逯小萌
(河南省濮阳市食品药品检验所,河南濮阳457000)
目的建立测定盐酸倍他司汀氯化钠注射液中盐酸倍他司汀含量的反相高效液相色谱(RP-HPLC)法。方法色谱柱为Thermo-C18柱(250mm×4.6mm,5μm),流动相为0.01mol/L醋酸钠缓冲液(含0.004mol/L庚烷磺酸钠,0.2%三乙胺,用冰醋酸调节pH= 4.0)-甲醇(70∶30),流速为1.0mL/min,柱温为30℃,检测波长为261 nm。结果盐酸倍他司汀进样量在0.102 3~1.023 0μg范围内与峰面积呈良好线性关系(r=0.999 9),平均回收率为99.61%,RSD=0.21%(n=9)。结论该方法准确度、灵敏度及重复性均较好,可用于盐酸倍他司汀氯化钠注射液中盐酸倍他司汀的含量测定。
盐酸倍他司汀氯化钠注射液;盐酸倍他司汀;反相高效液相色谱法;含量测定
盐酸倍他司汀氯化钠注射液的主要成分为盐酸倍他司汀,辅料为氯化钠与注射用水,主要用于内耳眩晕症,亦可用于动脉硬化、缺血性脑血管疾病及高血压所致体位性眩晕、耳鸣[1]。其国家药品标准[2]中含量测定项使用紫外分光光度法。紫外分析法相对液相色谱法不准确,专属性不强。为此,本试验中建立了反相高效液相色谱(RP-HPLC)法测定盐酸倍他司汀氯化钠注射液中盐酸倍他司汀的含量,现报道如下。
1 仪器与试药
安捷伦Agilent1260型高效液相色谱仪;G1314B型安捷伦Agilent 1260可变波长检测器(安捷伦公司);H4033A色谱工作站;Precisa92SM-202A型电子天平。盐酸倍他司汀对照品(中国食品药品检定研究院,批号为100265-201203,供含量测定用);盐酸倍他司汀氯化钠注射液(河南天方华中药业有限公司,批号分别为F14042403,F14042404,F1404243,每瓶含盐酸倍他司汀0.02 g、氯化钠4.5 g);甲醇为色谱纯,水为超纯水,其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件及系统适用性试验
色谱柱:Thermo-C18柱(250 mm×4.6 mm,5μm);流动相:0.01mol/L醋酸钠缓冲液(含0.004mol/L庚烷磺酸钠,0.2%三乙胺,用冰醋酸调节pH=4.0)-甲醇(70∶30);流速:1.0mL/min;柱温:30℃;检测波长:261 nm;进样量:20μL。理论板数大于2 000,盐酸倍他司汀峰与相邻杂质峰的分离度大于1.5。在此色谱条件下,色谱图见图1。
2.2 溶液制备
精密量取本品20mL,置25mL容量瓶中,用流动相稀释至刻度,即得每1mL中含32μg的供试品溶液。精密称取盐酸倍他司汀对照品17.05 mg,置50 mL容量瓶,用流动相稀释至刻度,再取5mL,置50mL容量瓶中,用流动相稀释至刻度,即得对照品溶液。按供试品溶液制备方法制备不含盐酸倍他司汀的阴性对照品溶液。
2.3 方法学考察
专属性考察:分别精密称取2份盐酸倍他司汀对照品10mg,置150mL容量瓶中,进行破坏性试验。加入0.1mol/L盐酸溶液溶解并稀释至刻度,室温放置30min,进行酸破坏;加入0.1mol/L氢氧化钠溶液溶解并稀释至刻度,室温放置30min,进行碱破坏。按拟订色谱条件进样20μL测定。结果倍他司汀在酸性或碱性条件下均稳定。
线性关系考察:精密吸取对照品溶液3,5,10,15,20,25,30μL注入高效液相色谱仪,以对照品进样量(X)为横坐标、峰面积(Y)为纵坐标绘制标准曲线,得回归方程Y=30.852X-1.537 3,r= 0.999 9(n=7)。结果表明,盐酸倍他司汀进样量在0.102 3~1.023 0μg范围内与峰面积线性关系良好。
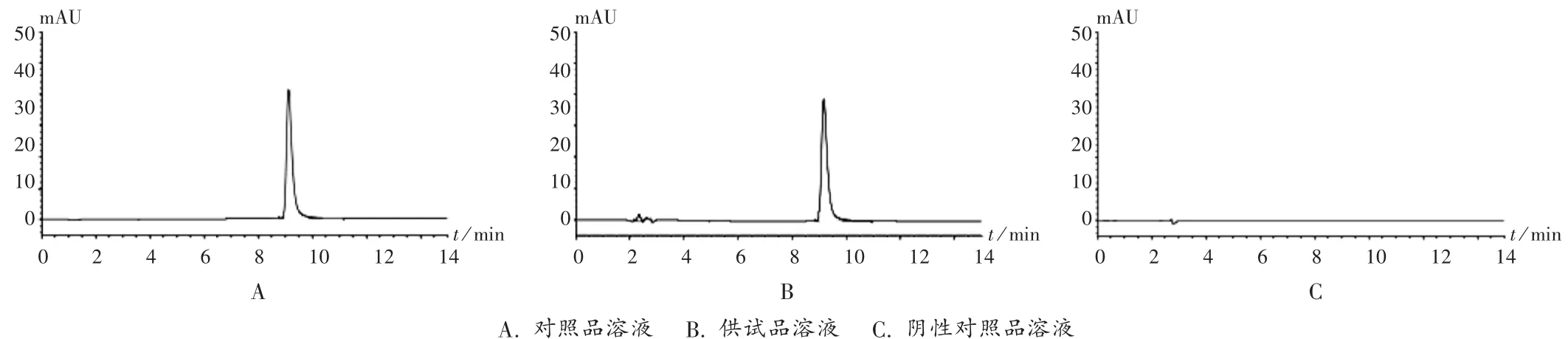
图1 高效液相色谱图
精密度试验:精密吸取同一对照品溶液20μL,重复进样6次。结果峰面积平均值为616.83,RSD=0.20%(n=6),表明仪器精密度良好。
稳定性试验:精密吸取同一供试品溶液,分别于0,2,4,6,8,10,12,24 h时进样测定。结果峰面积的平均值为617.09,RSD= 0.41%(n=8),表明供试品溶液在24 h内基本稳定。
重复性试验:取同一批样品,按拟订方法平行制备6份供试品溶液,分别进样测定。结果的RSD=0.23%(n=6),表明该方法重复性良好。
加样回收试验:精密量取已知含量的同一批样品6份各2mL,分别加入0.8,1.0,1.2mL质量浓度为0.081 g/L的对照品溶液,用流动相定容至5mL,配成高(120%)、中(100%)、低(80%)3个量级的待测溶液,按拟订色谱条件进样测定,计算回收率。结果见表1。
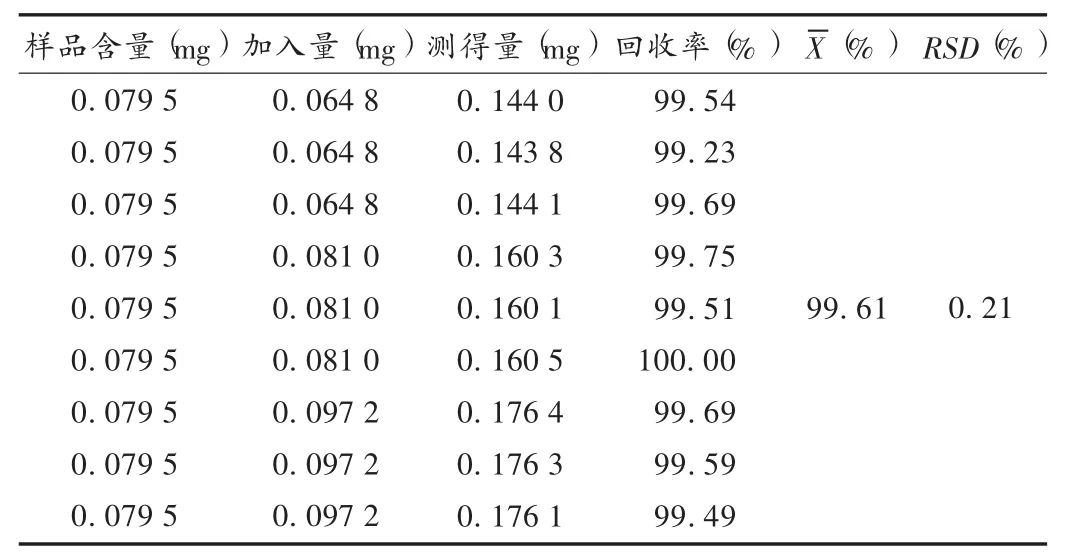
表1 盐酸倍他司汀加样回收试验结果(n=9)
2.4 样品含量测定
分别精密量取3批样品,依法制备供试品溶液并进样测定,用外标法计算含量。结果批号为F14042403,F14042404,F1404243的盐酸倍他司汀氯化钠注射液中盐酸倍他司汀的含量分别为99.71%,100.07%,100.02%,其RSD分别为0.16%,0.21%,0.19%(n=2)。
3 讨论
本品的现行药品标准采用紫外分光光度法,按原标准检验过程中试验数据有时不稳定,对试验结果造成影响,放置时间的延长及室温等客观原因造成溶剂的挥发也是影响试验数据的因素[3-6]。本试验中采用RP-HPLC法,选定最大吸收波长261 nm和流动相pH调节至4.0等色谱条件对样品进行测定。结果表明,样品主成分峰与相邻溶剂及杂质峰达到基线分离,且阴性对照品溶液峰对其无干扰,分离效果满意。此外,方法学考察的内容均达到了相应的标准要求,说明该方法准确、专属性强,受客观因素的影响较小,可用于盐酸倍他司汀氯化钠注射液中盐酸倍他司汀的含量测定。
[1]国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010:768-769.
[2]国家药典委员会.国家药品标准化学药品地方标准上升国家标准第七册[M].北京:中国医药科技出版社,2002:227.
[3]唐坤.反相高效液相色谱法测定倍他司汀的含量[J].药物分析杂志,2006,26(4):502-504.
[4]郭宇鹏,王克柳,夏方亮.HPLC法测定盐酸倍他司汀氯化钠注射液的含量[J].齐鲁药学,2005,24(8):469-470.
[5]宋毓.反相高效液相色谱法测定倍他司汀片的含量[J].黑龙江科技信息,2014(7):14.
[6]代广会,张锦,周定利,等.HPLC法测定盐酸倍他司汀氯化钠注射液主药及其有关物质的含量[J].中国药房,2008,19(4):296-297.
Content Determination of Betahistine Hydrochloride in Betahistine Hydrochloride Sodium Chloride Injection by RP-HPLC
Lu Xiaomeng
(Puyang Municipal Institute for Food and Drug Control,Puyang,Henan,China 457000)
Objective To establish an RP-HPLC method for the Content Determination of betahistine hydrochloride in Betahistine Hydrochloride Sodium Chloride Injection.Methods The chromatographic column was Thermo-C18column(250 mm×4.6 mm,5μm);the mobile phase was 0.01 mol/L sodium acetate buffer(containing 0.004 mol/L heptane sulfonic acid sodium salt,0.2%triethylamine,regulated to pH 4.0 glacial acetic acid)-methanol(70∶30);the flow rate was 1.0 mL/min;the column temperature was 30℃;the detection wavelength was 261 nm.Results Betahistine hydrochloride showed good linear relationship with the peak area in the range of 0.102 3-1.023 00μg(r=0.999 9),the average recovery was 99.61%,RSD=0.21%(n=9).Conclusion This method is accurate,sensitive and repeatable,and can be used as the content determination of betahistine hydrochloride in Betahistine Hydrochloride Sodium Chloride Injection.
Betahistine Hydrochloride Sodium Chloride Injection;betahistine hydrochloride;RP-HPLC;content determination
R927.2;R987
A
1006-4931(2015)22-0121-02
2015-02-05;
2015-05-20)
