植物WUSCHEL-related homeobox(WOX)家族研究进展
2015-10-24高丽孙祎敏邵铁梅孔卫娜崔润丽卢楠仵陶
高丽 孙祎敏 邵铁梅 孔卫娜 崔润丽 卢楠 仵陶
(河北化工医药职业技术学院制药工程系,石家庄 050026)
植物WUSCHEL-related homeobox(WOX)家族研究进展
高丽 孙祎敏 邵铁梅 孔卫娜 崔润丽 卢楠 仵陶
(河北化工医药职业技术学院制药工程系,石家庄050026)
WUSCHEL相关的同源异型盒(WUSCHEL-related homeobox,WOX)转录因子家族,在植物发育的众多阶段(茎和根顶端分生区的建成、侧生器官的发育、花器官的形成和胚的发育),尤其是在细胞增殖和分化较为旺盛的区域发挥重要的调控作用,即促进细胞的增殖或抑制细胞的分化。就WOX同源异型盒转录因子家族的系统进化分析、WOX家族成员的分子特征、WOX基因的生物学功能及其作用机制进行综述,并对本领域未来的发展方向作出展望。
同源异型盒转录因子;WOX家族;植物
真核生物体内的同源异型盒(homeobox,HB)转录因子超家族,因含有一段由60-66个氨基酸构成的同源异型结构域(homeodomain,HD)而得名,HD能够特异地结合DNA序列[1]。HB转录因子作为重要的调节因子在动植物生长发育中发挥作用:HB超家族中典型的代表HOX家族,最初在果蝇中发现的HOX,突变会导致果蝇第3胸节变成第2胸节(野生果蝇翅膀长在第2胸节,突变后会长出两对翅膀)等表型[2];植物特有的WUSCHEL(WUS)相关的同源异型盒(WUSCHEL related homeobox,WOX)转录因子家族,在拟南芥中含有WUS和 WOX1-WOX14,共计15个成员,其在茎和根顶端分生区干细胞的维持、侧生器官的发育、花器官的形成和胚发育等方面担当重任[3-6]。
依据WOX家族在植物中的分布和系统进化分析,可将其分成3个进化支:现代进化支(即WUS进化支)包含WUS、WOX1-7,以及它们在种子植物中的直系同源蛋白;中间进化支作为WUS进化支的姐妹分支,含有WOX8-9、WOX11-12,以及其在维管植物中的直系同源蛋白;古老进化支包含WOX10、WOX13-14及其在维管和非维管植物(包括苔藓和绿藻)中的直系同源蛋白[7]。
1 WOX家族成员的分子特征
WOX家族中只有WUS进化支中的成员含有典型的WUS-box基序(T-L-X-L-F-P-X-X,X可以是任意氨基酸)[8](图1),这是WOX区别于其他同源异型盒转录因子的典型标志,而中间进化支和古老进化支中的所有成员均不含有WUS-box基序。研究表明,WUS-box基序在WUS调控拟南芥茎顶端分生区(shoot apical meristem,SAM)干细胞增殖和花发育过程发挥决定作用[9]。
若干WOX蛋白含有一段由酸性氨基酸构成的序列,即酸性区域(图1),位于HD结构域和WUS-box基序之间,具有激活下游基因表达的功能。若干WOX蛋白含有一个靠近羧基端的EAR基序(图1),具有抑制下游基因表达的功能。因EAR基序需与辅阻遏物TOPLESS相互作用,所以含有EAR基序的转录因子阻遏下游基因表达的功能依赖于与TOPLESS的相互作用[10]。严格意义上的EAR基序为L-X-L-X-L,WOX家族中仅WUS、WOX5和WOX7的羧基端含有,而类似于EAR基序的EAR类结构域:[LVI]-X-[LVI]-X-[LVI]广泛存在于WOX蛋白的3个分支中。在拟南芥叶片瞬时表达系统中,利用GAL4荧光素酶报告基因验证WUS转录因子中各结构域对下游基因转录表达的调控作用发现,WUS-box基序和EAR基序均抑制荧光素酶基因的表达,而酸性区域激活酶基因的表达[9]。
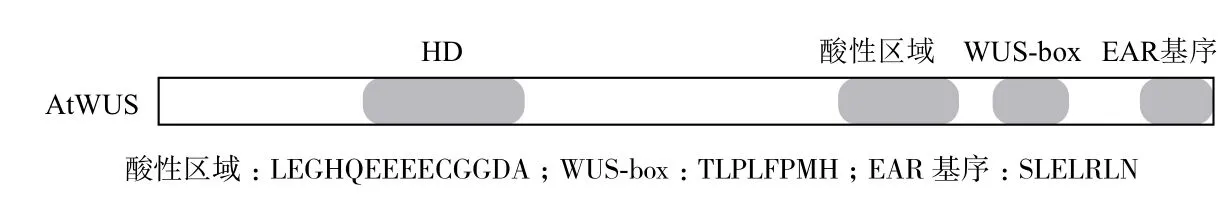
图1 WUS转录因子分子结构示意图
2 WOX基因的生物学功能
2.1 现代进化支
WUS基因在拟南芥SAM中表达,调控干细胞增殖与分化间的平衡。研究WUS及其在金鱼草中的直系同源基因ROSULATA(ROA)功能缺失突变体的表型,发现器官数量明显减少,SAM中干细胞增殖受到抑制,并提前进入终分化阶段[3,11],WUS在禾本科植物水稻和玉米中的直系同源基因OsWUS和ZmWUS也具有类似的功能[12]。WUS还参与调控拟南芥胚珠和花药的发育过程[13,14]。
矮牵牛心皮和花瓣的融合以及叶片的发育受到MAEWEST(MAW)基因的调控,maw无效突变体的心皮不能正常融合,导致雌蕊发育受限,并出现花瓣和叶子狭长等表型。MAW是WOX家族成员,其在拟南芥中的直系同源基因是WOX1,但wox1无效突变体没有出现类似maw的表型,暗示存在与WOX1功能相似的WOX基因。wox1 wox3双突花瓣和叶子狭长的表型与maw相似,说明WOX1和WOX3/PRESSED FLOWER(PRS)冗余调控拟南芥花瓣和叶片的发育[15]。STENOFOLIA(STF)是WOX1在蒺藜苜蓿中的同源基因,调控花瓣和叶、叶维管的发育,stf无效突变体的花瓣和叶片狭长、叶维管系统发育紊乱。STF在美花烟草中的直系同源基因是LAM1,lam1无效突变体的叶片亦狭长,扫描电镜观察叶片的横切面发现,叶狭长是由于叶肉细胞增殖和伸长受到抑制所致[16]。STF能将lam1突变体的表型恢复为野生型,将STF中WUS-box基序突变后得到的STFm1基因不能将lam1的表型恢复为野生型,说明WUS-box基序对于STF和LAM1行使生物学功能起决定性作用[17]。以上实验表明WOX家族中的成员MAW、WOX1、WOX3、STF和LAM1在调控植物旁侧器官发育方面具有保守性[16,18]。
胚胎发育期间,WOX2 基因仅在早期(受精卵到早期球形胚)的顶端细胞内表达。观察wox2无效突变体产生的胚发现,近50%的胚胎顶端发育异常(细胞丧失分裂能力或畸形倾斜地分裂),说明WOX2在胚早期顶端区域的形成过程中发挥作用[8]。利用RT-PCR分析WOX2在欧洲云杉(Picea abies)中的同源基因PaWOX2的表达模式发现,在胚发育早期阶段有较高水平的表达,当胚发育成熟时其表达量明显降低,幼苗体内PaWOX2的表达量已降到较低水平[19]。
WOX3/PRS基因在拟南芥茎分生区的旁侧外围区(peripheral zone,PZ)表达,负责调控旁侧器官(叶和花等)发育,其无效突变体prs因为PZ区细胞增殖受到抑制,而造成植株矮小的表型,同时托叶、萼片及雄蕊均缺失,说明WOX3具有抑制PZ区细胞分化并促进其增殖的功能[5,20,21]。WOX3在玉米中的直系同源基因NARROW SHEATH1(NS1)和NS2也具有类似的功能,ns1 ns2双突呈现出叶子边缘缺失的表型[21]。WOX4基因在拟南芥维管原形成层和形成层表达,wox4突变体形成层细胞数量明显减少,表明WOX4对于维持维管形成层干细胞数量和形成层的形态是必须的,随后的分子遗传学分析表明WOX4具有促进维管形成层干细胞增殖的作用[22,23]。WOX5基因在拟南芥根顶端分生区(root apical meristem,RAM)中表达,具有促进RAM中干细胞增殖的功能[4]。WOX5在小麦(Triticum aestivum)中的同源基因TaWOX5在小麦根中亦有大量表达[24]。WOX6/ PRETTY FEW SEEDS2(PFS2)/ HOS9(HIGH EXPRESSION OF OSMOTICALLY RESPONSIVE GENES)基因调控拟南芥胚珠的发育,pfs2-1突变体有95%的胚囊不能正常发育,致使种子产量大幅降低;与野生型的珠被细胞相比较,pfs2-1珠被细胞较短,可能是珠被原基过早分化造成的,暗示WOX6具有抑制珠被细胞分化的能力[25]。另外,在低温条件下hos9-1表现出生长缓慢、开花时间延迟和对寒冷更加敏感的表型,暗示WOX6在植株应答冷胁迫的过程中发挥作用[26]。
2.2 中间进化支
WOX8/STIMPY-LIKE(STPL)基因仅在拟南芥胚早期发育阶段表达[8]。stpl-1和wox2突变体的幼苗均没有明显的表型缺陷,而stpl-1 wox2双突子叶发育存在缺陷(不对称或部分融合),但双突在胚后期发育阶段未见异于野生型的表型,说明WOX8和WOX2冗余调控胚早期顶端(即子叶原基)发育[27]。拟南芥3个CUP-SHAPED COTYLEDON(CUC)基因CUC1-3冗余调控胚早期发育的子叶边界区域的建立和维持,CUC的缺失,导致子叶分离(cuc突变体产生杯状子叶)以及SAM的形成发生缺陷。最近发现WOX2和STPL冗余调控CUC的转录,即促进CUC2和CUC3的转录,而抑制CUC1的转录,致使stpl-1 wox2双突子叶出现融合现象[28]。
WOX9/STIMPY(STIP)基因在拟南芥胚和胚后期器官发育阶段发挥作用,其在胚早期发育阶段大量表达,随着胚不断成熟,表达量逐渐减少,stip突变体因细胞无法分裂而使胚发育停止,说明WOX9具有促进胚内细胞增殖的功能[27]。野生型SAM形态为圆拱形,而wox9平坦的SAM与wus平坦的SAM表型一致,说明SAM中干细胞均已分化,并且wox9中检测不到WUS表达,说明WOX9具有维持WUS表达的功能。wox9根发育亦受到严重地抑制,且没有侧根发生。利用原位杂交技术检测细胞增殖标志性蛋白histone H4的表达量发现,其在野生型SAM和RAM中均高效表达,而在wox9中的表达大幅减少,甚至检测不到,说明WOX9具有维持茎和根分生区干细胞增殖的功能[29]。WOX8是WOX9的旁系同源基因,构建融合基因WOX9∷WOX8并转入stip中发现,WOX8能够将stip中胚停止发育的表型恢复至野生型,说明在胚发育时期WOX8能够行使类似于WOX9促进细胞增殖的功能,从而调控早期胚的生长发育。并且WOX8和WOX2冗余调控子叶的分离,说明在胚发育时期,WOX家族若干成员来调控组织细胞的增殖过程[27]。
OsWOX11基因调控水稻冠根的萌发激活和生长发育。亚细胞定位显示融合基因OsWOX11∷GFP(green fluorescent protein)表达于细胞核内,原位杂交和OsWOX11启动子融合GUS(β-glucuronidase)的表达分析均表明,在根(主根、冠根和侧根)和茎顶端细胞增殖较旺盛的区域(RAM、SAM和叶原基)表达。OsWOX11缺失突变体的主根长度不及野生型的一半,冠根数目锐减,由于根发育的严重缺陷,大部分突变体在发育后期死亡;OsWOX11超表达突变体中,冠根数量增多且生长速率明显加快,并出现早熟现象,说明OsWOX11在水稻根发育过程中发挥重要作用[30]。
2.3 古老进化支
亚细胞定位显示融合基因WOX13∷GUS在拟南芥发育早期阶段的主根(尤其是RAM)和侧根内高效表达,而在发育后期的主根和侧根中检测不到GUS,暗示WOX13在根发育的早期阶段发挥作用。在地上部分发育过程中,WOX13∷GUS在子叶和维管系统、叶原基、花发育阶段中的雌蕊和雄蕊、受精后的胚珠及发育中的胚中高效表达,而在成熟的器官中检测不到GUS,说明WOX13在增殖旺盛的器官中发挥作用[31]。WOX14基因在拟南芥主根、侧根原基和花器官(雄蕊中高效表达,表达量随着雄蕊的成熟而减少)中表达,具有抑制细胞分化的功能。wox14突变体花发育阶段,雄蕊细胞的增殖受到抑制,雄蕊发育较短,无法完成正常的受精过程。通过分子遗传学分析发现WOX13和WOX14冗余调控拟南芥的开花转换过程[31]。
3 作用机制
WOX家族成员作为细胞核内的转录因子发挥作用,但是使用预测核定位序列(nuclear localization signal,NLS)的相关软件(PSORT和PredictNLS)未在WOX中发现NLS的存在[32]。针对WOX蛋白亚细胞的定位,仅有少数WOX家族成员:WUS[33]、OsWOX3[34]、WOX6[25]和OsWOX11[30]定位于核内。推测WOX存在不能够被软件识别的NLS,或不含NLS的WOX能与其他含有NLS的蛋白质相互作用,借助于后者NLS的引导而共同进入细胞核内。通过对wox突变体的研究发现,WOX具有非细胞自主性的功能:SAM中特异表达的WUS赋予该区域干细胞的特征,异位超表达的WUS也可促进某区域细胞的增殖并保持未分化状态[35],说明异位表达的WUS能够将处于营养生长状态的组织转变为具有胚胎干细胞特征的组织。分别在SAM的PZ区和RAM的静止中心(quiescent center,QC)表达的WOX3和WOX5,也具有非细胞自主性的能力来促进PZ区和QC区细胞的增殖[5,36]。WOX8和WOX9亦具有非细胞自主性的能力,来调控胚胎顶端区域的发育[37]。以上实验暗示,WOX能通过激活下游相应的可在细胞间移动的非细胞自主性因子的表达来发挥作用。
SAM组织中心表达的WUS运动到其上方区域,结合CLAVATA3(CLV3)启动子并诱导其表达,CLV3与受体CLAVATA1(CLV1)结合后,激活下游信号转导途径,最终抑制WUS表达,从而形成CLV3-WUS反馈环路来调控SAM干细胞增殖与分化间的平衡[38]。根尖柱状细胞分泌的CLE40与未分化的柱状干细胞上的受体ACR4结合后,激活下游信号途径来抑制WOX5的表达,由此形成了一个类似于CLV3-WUS的CLE40-WOX5反馈调节环路来维持RAM干细胞增殖与分化间的平衡[4]。2013年,在水稻中也发现了一个类似的信号途径FCP2p-QHB调控RAM中干细胞的发育,其中QHB是WOX5的直系同源蛋白[39]。以上研究表明,在不同物种的不同分生组织中,均有相类似的信号转导途径来维持干细胞增殖和分化间的平衡。
拟南芥韧皮部分泌的CLE41和CLE44其受体PXY/TDR分布于维管形成层。cle41和pxy/tdr突变体因形成层干细胞分化为木质部细胞,造成形成层细胞数量减少[40]。在维管形成层表达的WOX4具有促进干细胞增殖的作用,CLE41和CLE44也促进WOX4表达来进一步增强干细胞的增殖,而WOX4则不对CLE41和CLE44的表达产生影响[22,23]。CLE41/CLE44-WOX4对于维管形成层发育的调控机制,与CLV3-WUS对于SAM和CLE40-WOX5对于RAM的调控机制不同,表明在维管形成层和顶端分生区中干细胞增殖与分化的调控过程中,具有成员构成上相似,但调控机制不同的特点。WOX家族众多成员的表达局限在细胞增殖较旺盛的不同区域(胚、侧根原基和花器官等),暗示它们也可能受到某些发育信号分子的调控,新的CLE-WOX信号途径正等待着被发现。
位于WUS羧基端的EAR基序对于WUS的转录抑制作用不是必须的,可能在增强WUS的转录抑制作用方面发挥作用[9],并且TOPLESS通过与EAR基序相互作用来调控WUS的转录抑制[11,41]。体外实验表明WOX5的WUS-box基序和EAR基序均能够发挥转录抑制的作用[9]。尽管不含有EAR基序,OsWOX3和OsWOX11也具有转录抑制的能力:水稻叶片发育过程中,YABBY3(YAB3)基因在叶片细胞增殖和分化过程中发挥作用,OsWOX3通过抑制YAB3的转录来调控叶片的发育[34]。水稻RR2基因编码A型ARR(Arabidopsis response regulator)蛋白,负调控细胞分裂素信号转导途径,OsWOX11直接抑制RR2的转录,从而与RR2共同调控细胞分裂素在植物体内的转导过程[30]。因此,转录抑制作用是WOX蛋白发挥作用的一个普遍模式。但是WOX抑制的目的基因,以及参与转录抑制的结构域不尽相同,今后还需要发现更多的受WOX调控的基因,并且从中确定WOX参与转录调控的结构域。
WUS能够直接抑制A型ARR基因的表达,从而介入细胞分裂素信号途径,协同调控植物SAM的发育[42]。利用RT-PCR技术分析诱导和分化培养基中生长的愈伤组织发现,TaWOX5的表达受到植物激素的调控,在细胞增殖阶段生长素能够诱导其表达,而在细胞分化阶段细胞分裂素则抑制其表达,生长素亦能诱导拟南芥WOX5的表达[24],暗示在根分生区表达的WOX5,可能与植物激素协同调控根发育。生长素对于胚发育的调控依赖于其浓度梯度的建立,生长素外输载体PIN蛋白家族对于生长素浓度梯度的建立起决定性作用。研究表明,STPL能够促进PIN7表达,利用生长素响应原件DR5构建DR5∷GFP,在其转基因植株中原位实时测定生长素的分布发现,stpl突变体的胚柄内有大量生长素积累(野生型胚柄内无生长素),说明STPL通过对PIN转录的调节,影响胚发育过程中生长素浓度梯度的建立[28]。在OsWOX11超表达和缺失突变体中,应答植物生长素和细胞分裂素的基因表达均受到影响,表明OsWOX11可能是一个生长素和细胞分裂素信号转导途径中的整合者来调控根的发育[30],今后还要研究其他的WOX家族成员是否介入植物激素对植物发育的调控过程,并从中发现WOX与植物激素协同调控植物发育的机制。
[1]Gehring WJ, Qian YQ, Billeter M, et al. Homeodomain-DNA recognition[J]. Cell, 1994, 78(2):211-223.
[2]Gehring WJ. Exploring the homeobox[J]. Gene, 1993, 135(1-2):215-221.
[3]Yadav RK, Reddy GV. WUSCHEL protein movement and stem cell homeostasis[J]. Plant Signal Behav, 2012, 7(5):592-594.
[4]Stahl Y, Wink RH, Ingram GC, et al. A signaling module controlling the stem cell niche in Arabidopsis root meristems[J]. Curr Biol,2009, 19(11):909-914.
[5]Shimizu R, Ji J, Kelsey E, et al. Tissue specificity and evolution of meristematic WOX3 function[J]. Plant Physiol, 2009, 149(2):841-850.
[6] Ueda M, Zhang Z, Laux T. Transcriptional activation of Arabidopsis axis patterning genes WOX8/9 links zygote polarity to embryo development[J]. Dev Cell, 2011, 20(2):264-270.
[7] Lian GB, Ding ZW, Wang Q, et al. Origins and evolution of WUSCHEL-related homeobox protein family in plant kingdom[J]. Scientific World Journal, 2014, ID:534140.
[8] Haecker A, Gross-Hardt R, Geiges B, et al. Expression dynamics of WOX genes mark cell fate decisions during early embryonic patterning in Arabidopsis thaliana[J]. Development, 2004, 131(3):657-668.
[9] Ikeda M, Mitsuda N, Ohme-Takagi M. Arabidopsis WUSCHEL is a bifunctional transcription factor that acts as a repressor in stem cell regulation and as a activator in floral patterning[J]. Plant Cell,2009, 21(11):3493-3505.
[10]Paponov IA, Teale W, Lang D, et al. The evolution of nuclear auxin signaling[J]. BMC Evol Biol, 2009, 9:126.
[11] Kieffer M, Stern Y, Cook H, et al. Analysis of the transcription factor WUSCHEL and its functional homologue in Antirrhinum reveals a potential mechanism for their roles in meristem maintenance[J]. Plant Cell, 2006, 18(3):560-573.
[12]Nardmann J, Werr W. The shoot stem cell niche in angiosperms:expression patterns of WUS orthologues in rice and maize imply major modifications in the course of mono-and dicot evolution[J]. Mol Biol Evol, 2006, 23(12):2492-2504.
[13]Gross-Hardt R, Lenhard M, Laux T. WUSCHEL signaling functions in interregional communication during Arabidopsis ovule development[J]. Genes Dev, 2002, 16(9):1129-1138.
[14]Deyhle F, Sarkar AK, Tucker EJ, et al. WUSCHEL regulates cell differentiation during anther development[J]. Dev Biol, 2007,302(1):154-159.
[15] Vandenbussche M, Horstman A, Zethof J, et al. Differential recruitment of WOX transcription factors for lateral development and organ fusion in petunia and Arabidopsis[J]. Plant Cell, 2009, 21(8):2269-2283.
[16] Tadege M, Lin H, Bedair M, et al. STENOFOLIA regulates blade outgrowth and leaf vascular patterning in Medicago truncatula and Nicotiana sylvestris[J]. Plant Cell, 2011, 23(6):2125-2142.
[17] Lin H, Niu LF, McHale NA, et al. Evolutionarily conserved repressive activity of WOX proteins mediates leaf blade outgrowth and floral organ development in plants[J]. Proc Natl Acad SciUSA, 2013, 110(1):366-371.
[18] Nakata M, Matsumoto N, Tsugeki R, et al. Roles of the middle domain-specific WUSCHEL-RELATED HOMEOBOX genes in early development in Arabidopsis[J]. Plant Cell, 2012, 24:519-535.
[19]Palovaara J, Hakman I. WOX2 and polar auxin transport during spruce embryo pattern formation[J]. Plant Signal Behav, 2009, 4(2):153-155.
[20]Matsumoto N, Okada K. A homeobox gene PRESSED FLOWER regulates lateral axis-dependent development of Arabidopsis flowers[J]. Genes Dev, 2001, 15(24):3355-3364.
[21]Nardmann J, Werr W, Scanlon MJ. The maize duplicate genes narrow sheath1 and narrow sheath2 encode a conserved homeobox gene function in lateral domain of shoot apical meristems[J]. Development, 2004, 131(12):2827-2839.
[22] Hirakawa Y, Kondo Y, Fukuda H. TDIF peptide signaling regulates vascular stem cell proliferation via the WOX4 homeobox gene in Arabidopsis[J]. Plant Cell, 2010, 22(8):2618-2629.
[23] Qiang Y, Wu JB, Han HB, et al. CLE peptides in vascular development[J]. J Integrative Plant Biol, 2013, 55:389-394.
[24]Zhao S, Jiang QT, Ma J, et al. Characterization and expression analysis of WOX5 genes from wheat and its relatives[J]. Gene,2014, 537(1):63-69.
[25] Park SO, Zheng Z, et al. The PRETTY FEW SEEDS2 gene encodes an Arabidopsis homeodomain protein that regulates ovule development[J]. Development, 2005, 132(4):841-849.
[26] Shimizu R, Ji J, Kelsey E, et al. An Arabidopsis homeodomain transcription factor gene, HOS9, mediates cold tolerance through a CBF-independent pathway[J]. Proc Natl Acad Sci USA, 2004,101(26):9873-9878.
[27] Wu X, Chory J, Weigel D. Combinations of WOX activities regulate tissue proliferation during Arabidopsis embryonic development[J]. Dev Biol, 2007, 309(2):306-316.
[28]Lie C, Kelsom C, Wu X. WOX2 and STIMPY-LIKE/WOX8 promote cotyledon boundary formation in Arabidopsis[J]. Plant J, 2012,72(4):674-682.
[29] Wu XL, Dabi T, Weigel D. Requirement of homeobox gene STIMPY/WOX9 for Arabidopsis meristem growth and maintenance[J]. Curr Biol, 2005, 15(5):436-440.
[30] Zhao Y, Hu YF, Dai MQ, et al. The WUSCHEL-Related homeobox gene WOX11 is required to activate shoot-borne crown root development in rice[J]. Plant Cell, 2009, 21(3):736-748.
[31] Deveaux Y, Toffano-Nioche C, Claisse G, et al. Genes of the most conserved WOX clade in plants affect root and flower development in Arabidopsis[J]. BMC Evol Biol, 2008, 8:291.
[32] van der Graaff E, Laux T, Rensing SA. The WUS homeobox-containing(WOX)protein family[J]. Genome Biol, 2009, 10:248.
[33] Mayer KF, Schoof H, Haecker A, et al. Role of WUSCHEL in regulating stem cell fate in the Arabidopsis shtto meristem[J]. Cell, 1998, 95(6):805-815.
[34] Dai M, Hu Y, Zhao Y, et al. A WUSCHEL-LIKE HOMEOBOX gene represses a YABBY gene expression required for rice leaf development[J]. Plant Physiol, 2007, 144(1):380-390.
[35] Schoof H, Lenhard M, Haecker A, et al. The stem cell population of Arabidopsis shoot meristems in maintained by a regulatory loop between the CLAVATA and WUSCHEL genes[J]. Cell, 2000, 100(6):635-644.
[36] Sarkar AK, Luijten M, Miyashima S, et al. Conserved factors regulate signaling in Arabidopsis thaliana shoot and root stem cell organizers[J]. Nature, 2007, 446(7137):811-814.
[37] Breuninger H, Rikirsch E, Hermann M, et al. Differential expression of WOX genes mediates apical-basal axis formation in Arabidopsis embryo[J]. Dev Cell, 2008, 14(6):867-876.
[38] Yadav RK, Perales M, Gruel J, et al. WUSCHEL protein movement mediates stem cell homeostasis in the Arabidopsis shoot apex[J]. Genes Dev, 2011, 25(19):2025-2030.
[39] Chu HW, Liang WQ, Li J, et al. A CLE-WOX signaling module regulates root meristem maintenance and vascular tissue development in rice[J]. J Exper Botany, 2013, 64:5359-5369.
[40]Etchells JP, Turner SR. The PXY-CLE41 receptor ligand pair defines a multifunctional pathway that controls the rate and orientation of vascular cell division[J]. Development, 2010, 137(5):767-774.
[41]Long JA, Ohno C, Smith ZR, et al. TOPLESS regulates apical embryonic fate in Arabidopsis[J]. Science, 2006, 312(5779):1520-1523.
[42]Leibfried A, To JP, Busch W, et al. WUSCHEL controls meristem function by direct regulation of cytokinin-inducible response regulators[J]. Nature, 2005, 438(7071):1172-1175.
(责任编辑 狄艳红)
Studies on WUSCHEL-related Homeobox(WOX)Protein Family
Gao Li Sun Yimin Shao Tiemei Kong Weina Cui Runli Lu Nan Wu Tao
(Department of Pharmaceutical Engineering,Hebei Chemical and Pharmaceutical College,Shijiazhuang050026)
WUSCHEL-related homeobox(WOX)transcription factor, family members are essential in the many stages of plant development(for examples, stem-cell maintenance in shoot and root apical meristem, lateral organ development, floral organ formation and embryonic patterning)by promoting cell proliferation or preventing cell differentiation. We outline the phylogenetic analysis, the molecular characteristics, biological functions and the mechanism of action of WOX gene family members. We also provide prospective vision in this field.
homeobox transcription factor;WOX protein family;plant
10.13560/j.cnki.biotech.bull.1985.2015.05.002
2014-09-19
河北省教育厅高等学校科学研究项目(QN20131012),河北化工医药职业技术学院科研项目(YZ201406),河北化工医药职业技术学院博士科研项目(BQ32013007)
高丽,女,博士,讲师,研究方向:植物发育分子生物学;E-mail:cellgao@126.com
