红笛鲷(Lutjanus sanguineus)C型凝集素基因的克隆与组织表达分析
2015-10-24蔡佳张雪利吴灶和简纪常鲁义善冯东岳焦茂兴
蔡佳张雪利吴灶和简纪常鲁义善冯东岳焦茂兴
(1.广东海洋大学 水产学院,湛江 524088;2.广东省水产经济动物病原生物学及流行病学重点实验室,湛江 524088;3.广东省水产经济动物病害控制重点实验室,湛江 524088;4.农业部全国水产技术推广总站,北京 100125;5.宜春学院,宜春 336000)
红笛鲷(Lutjanus sanguineus)C型凝集素基因的克隆与组织表达分析
蔡佳1,2,3张雪利1,2,3吴灶和2,3简纪常1,2,3鲁义善1,2,3冯东岳4焦茂兴5
(1.广东海洋大学 水产学院,湛江524088;2.广东省水产经济动物病原生物学及流行病学重点实验室,湛江524088;3.广东省水产经济动物病害控制重点实验室,湛江524088;4.农业部全国水产技术推广总站,北京100125;5.宜春学院,宜春336000)
根据已知的海水鱼类C型凝集素基因的核苷酸保守区序列设计一对简并引物,先后通过RT-PCR 和RACE PCR法从红笛鲷脾脏中首次克隆获得红笛鲷C型凝集素(CTL)基因的cDNA全长(登录号:AGT37609)。该序列长828 bp,开放阅读框663 bp,编码220个氨基酸。氨基酸序列分析显示,红笛鲷CTL基因氨基酸序列与其他物种CTL的相似性在30%-68%之间。系统进化分析表明,红笛鲷C型凝集素与鳉鱼、条石鲷、斜带石斑鱼 CTL蛋白亲缘关系最近,聚成一支。通过荧光定量PCR 分析红笛鲷基因的组织差异表达,红笛鲷CTL基因在肝、脾以及皮肤中表达水平较高,其次是头肾、肾、胃、肠及肌肉,在心脏与脑中表达量较低。
红笛鲷;C型凝集素;基因克隆;组织表达分析
凝集素是真核生物中一类重要的模式识别受体(pattern recognition receptors,PRRs)。根据不同的结构和功能,凝集素大致可分为calnexin、C型、L型、P型、I型、R型和S型凝集素[1]。其中C型凝集素(C-Type lectins,CTLs)的研究较为广泛。此类蛋白具有相同的结构特征,如具有碳水化合物识别结构域(carbohydrate recognition domain,CRD),二硫化物结合位点以及钙离子结合位点[2-5]。在脊椎动物中,C型凝集素可分为17个亚类,它们大多数都能结合病原相关分子模式(pathogen-associated molecular patterns,PAMPs),也能通过病原微生物表面的糖基(如N-乙酰氨基葡萄糖、甘露糖等)与病原本身结合[6]。
目前,多种鱼类如石斑鱼[7]、虹鳟[8]、鲤鱼[9]、日本牙鲆[10]、大西洋鲑[11]及鳗鲡[12]的C型凝集素相继被鉴定,鱼类CTLs的组织分布各不相同[7,8,11,12],并且在受到病原细菌、真菌以及病毒刺激后的表达量上调[7];此外,鱼类C型凝集素在Ca2+的存在下还能使细菌与真菌发生凝集[7,12],表明鱼类CTLs在鱼体抵御病原侵染的免疫反应中可能发挥着重要的作用。
红笛鲷(Lutjanus sanguineus)是我国南部沿海地区一种重要的海水养殖鱼类。然而随着养殖规模的不断扩大,红笛鲷养殖中弧菌病频发,对其养殖业造成了巨大的损失。但是目前有关红笛鲷免疫防御机制的研究报道相对较少。本研究对红笛鲷C型凝集素基因(CTL)进行克隆鉴定,并对该基因的序列特征及组织分布进行分析,旨在为进一步研究红笛鲷CTL在抵御病原感染过程中的作用奠定基础。
1 材料与方法
1.1 材料
试验用红笛鲷(50-60 g/条)购于湛江东风市场。
1.2 方法
1.2.1 cDNA一链合成 红笛鲷暂养后取皮肤、心脏、肌肉、脑、头肾、胃、肠、肾、脾和肝,采用Trizol(Invitrogen)法分别提取总RNA。分别用M-MLV将提取得到的各组织的总RNA反转成cDNA一链用于后续试验。另取脾的总RNA,利用Clontech公司的SMARTer RACE 试剂盒,按照试剂盒的方法分别合成用于3' RACE与5' RACE扩增的cDNA模板。
1.2.2 红笛鲷CTL基因cDNA全长的扩增
1.2.2.1 红笛鲷CTL基因引物的设计 首先根据已报道的斜带石斑鱼、条石鲷与香港石斑鱼CTL核苷酸序列(登录号分别为:FJ805452、GU097438与FJ392023)的保守区域设计简并引物LsCTL-DF与LsCTL-DR(表1),从脾脏cDNA一链中扩增红笛鲷CTL基因的保守序列,然后根据简并引物扩增得到的序列设计红笛鲷CTL cDNA全长的RACE引物。
1.2.2.2 红笛鲷CTL基因片段的扩增 利用引物LsCTL-DF与LsCTL-DR,通过降落PCR扩增CTL基因的片段。PCR反应条件为:98℃预变性3 min;94℃ 30 s,54℃ 30 s,72℃ 30 s,5个循环;94℃ 30 s,50℃ 30 s,72℃ 30 s,5个循环;94℃ 30 s,50℃30 s,72℃ 30 s,25个循环;72℃延伸10 min,4℃保存。PCR反应产物电泳检测后将目的条带切胶回收。回收产物与pMD18-T Vector连接后转化DH5α感受态,挑克隆进行菌落PCR鉴定,将鉴定的阳性克隆送至深圳华大基因公司测序。
1.2.2.3 红笛鲷CTL基因3'与5'端扩增 利用Ls-CTL3'-F1、LsCTL5'-R1分别与试剂盒自带的UPM Mix引物进行3' RACE与5' RACE PCR的第一轮扩增。反应条件为:98℃预变性3 min;94℃ 30 s,72℃2 min,5个循环;94℃ 30s,70℃ 30 s,72℃ 2 min,5个循环;94℃ 30 s,68℃ 30 s,72℃ 2 min,25个循环;72℃延伸5 min,4℃保存。取第一轮PCR产物稀释10倍作为第二轮的模板,用LsCTL3'-F2、LsCTL5'-R2分别与试剂盒引物NUP进行第二轮PCR,反应条件为:98℃预变性3 min;94℃ 30 s,68℃ 30 s,72℃ 2 min,30个循环;72℃延伸10 min,4℃保存。余下步骤同1.2.2.2。
1.2.3 红笛鲷CTL基因的序列分析 上述测序结果采用DNAMAN5.2软件进行拼接,获得的cDNA序列通过NCBI网站(http://www.ncbi.nlm.nih.gov/ blast)进行比对分析;通过Genetyx 7 软件预测开放阅读框(ORF)以及氨基酸序列;应用 Clustal X2.0及MEGA5软件分别进行序列的多重比对与系统进化树构建。通过ExPASy网站的工具http://web.expasy. org/protparam/在线分析红笛鲷CTL氨基酸序列的组成与理化性质;http://web.expasy.org/protscalel分析红笛鲷CTL蛋白的亲/疏水性。利用SignalP4.1 Serve(http://www.cbs.dtu.dk/services/ SignalIP)分析蛋白的信号肽。跨膜结构通过TMHMM Server v2.0(http://www.cbs.dtu.dk/services/TMHMM/)预测。序列比对所用登录号,见表2。

表1 实验所用引物序列
表2 序列比对所用登录号
1.2.4 红笛鲷CTL基因的组织表达分析 利用CTL引物RT-LsCTL-F、RT-LsCTL-R与内参基因β-actin引物RT-actin-F、RT-actin-R,通过荧光定量PCR分析红笛鲷CTL基因在各个组织中的表达。将各组织的总RNA经DNase I消化后合成cDNA一链,用无菌水稀释后作为荧光定量PCR的模板。以红笛鲷β-actin做为内参基因,利用Bio-Rad iQ5实时荧光定量PCR 仪对红笛鲷CTL基因的表达量进行分析,每个样本进行3个重复。PCR反应条件为:94℃预变性5 min;94℃变性20 s,55℃退火20 s,72℃延伸20 s,进行40个循环;72℃延伸30 s,4℃保存。PCR反应结束后以各组织中最低的mRNA 表达量为基准,通过2-△△Ct方法计算红笛鲷CTL基因在不同组织中的相对表达量。
2 结果
2.1 红笛鲷CTL基因的克隆
红笛鲷CTL cDNA全长828 bp,其中5'非翻译区(5' UTR)37 bp,3'非翻译区(3' UTR)128 bp,开放阅读框663 bp,编码220个氨基酸。3' UTR含有两个加尾信号AATAAA。该基因氨基酸序列具有CTLs家族特有的CRD结构域及关键的功能基序“EPD”,且含有信号肽序列(前31个氨基酸),不具有跨膜结构,为分泌型蛋白(图1-图3)。
2.2 红笛鲷CTL序列分析
2.2.1 红笛鲷CTL氨基酸序列的理化性质 ProtParam在线分析结果显示,红笛鲷CTL蛋白的理论分子量为 24.53 kD,等电点为5.81。推测的氨基酸序列中Glu的含量最高,比例为9.5%;Leu含量次之,为8.2%;Met含量最低,仅为0.9%。带正电荷的氨基酸有20个,带负电荷的氨基酸有35个。不稳定指数为38.55,归类为一个稳定的蛋白。该蛋白总的平均亲水值为-0.469,是亲水性蛋白。ProtScale分析表明红笛鲷CTL蛋白亲水性氨基酸含量较高,亲水区域较大(峰值小于零的为亲水性峰,图4),为亲水性蛋白,与理化分析的结果一致。
2.2.2 红笛鲷CTL蛋白的同源性比对与进化分析 利用Clustal X2.0软件将红笛鲷CTL编码的氨基酸序列与NCBI数据库公布的其他物种CTL蛋白进行序列比较,发现红笛鲷CTL与条石鲷、斜带石斑鱼、鳉鱼CTL相似度较高,分别为68%、61%和58%,与斑马鱼CTL仅为32%,与牛CTL的相似度最低,为30%。红笛鲷CTL与其他的比对的序列具有特征性的CRD结构域,其中含有“EPD”功能基序以及4个完全保守的半胱氨酸残基(图5)。进化分析结果(图6)显示,红笛鲷CTL蛋白与鳉鱼、条石鲷、斜带石斑鱼 CTL蛋白亲缘关系最近,聚为一支,与哺乳类以及甲壳类CTL蛋白的亲缘关系较远。
2.3 红笛鲷CTL基因的组织表达分析
通过荧光定量PCR 检测红笛鲷各组织CTL基因的表达量,结果(图7)显示,红笛鲷CTL基因在肝、脾与皮肤中表达水平较高,其次是头肾、肾、胃、肠及肌肉,在心脏和脑中的表达量较低。

图1 红笛鲷 CTL基因cDNA序列及推导的氨基酸序列
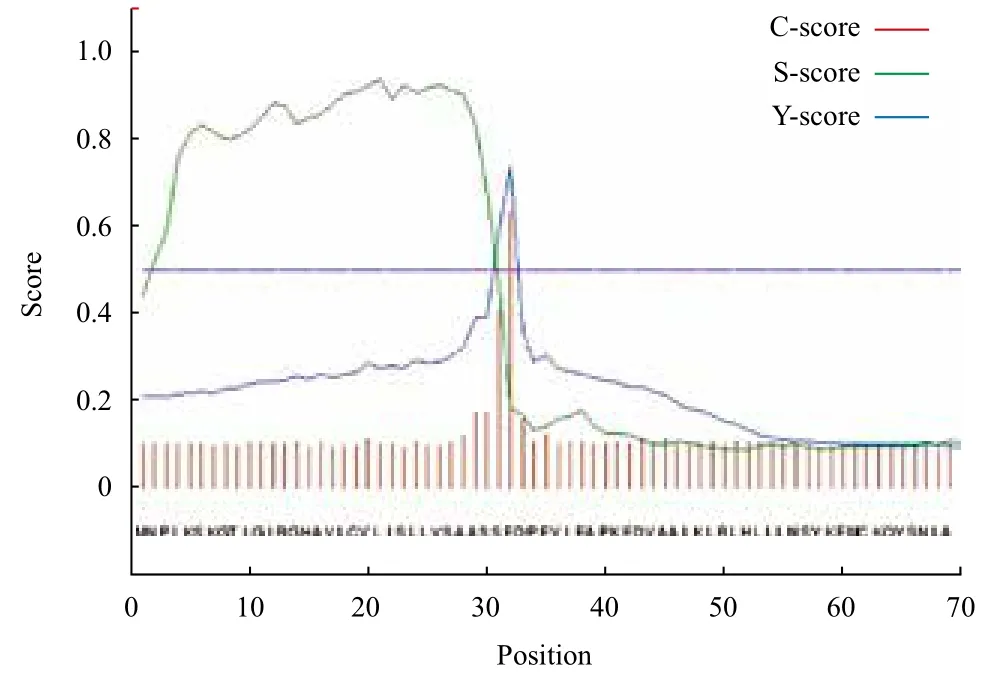
图2 红笛鲷CTL蛋白的信号肽预测分析
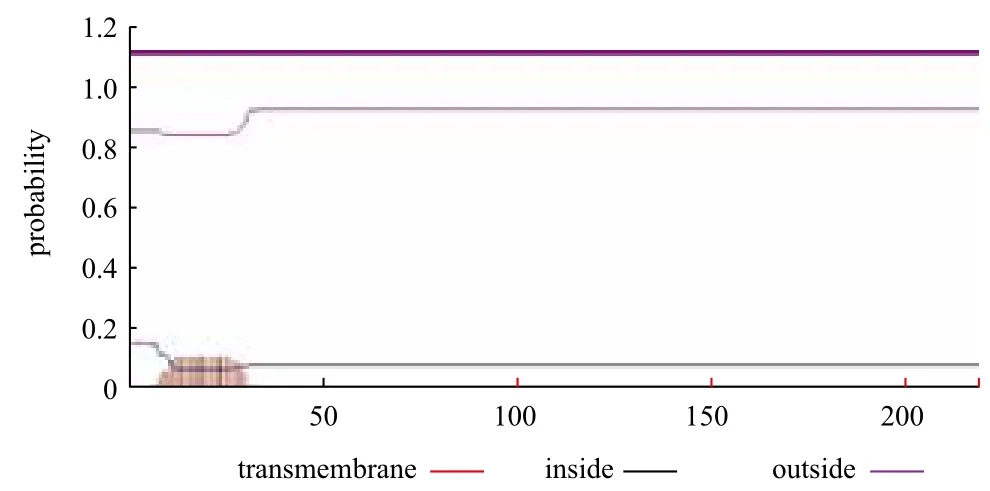
图3 红笛鲷CTL蛋白的跨膜结构分析
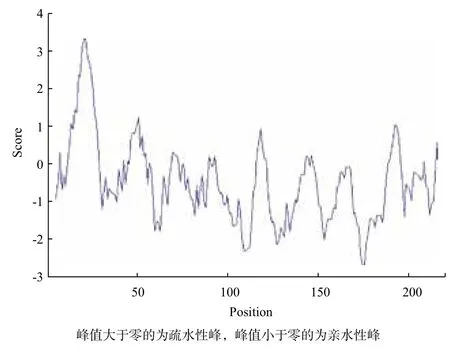
图4 红笛鲷CTL蛋白的亲水性/疏水性分析
3 讨论
C型凝集素广泛存在于所有真核生物中,能通过结合细胞表面特定的碳水化合物促进不同细胞的凝集及调节细胞的吞噬作用,在非己识别与清除侵染微生物中发挥着重要的功能[13-15]。本试验通过同源克隆和RACE PCR技术获得了红笛鲷C型凝集素基因(CTL),该基因cDNA全长828 bp,开放阅读框663 bp,编码220个氨基酸,分子量为 24.53 kD,等电点为 5.81。其编码的氨基酸序列具有C型凝集素家族特征性的CRD结构域,并且其N端具有信号肽,表明红笛鲷CTL为分泌型蛋白。
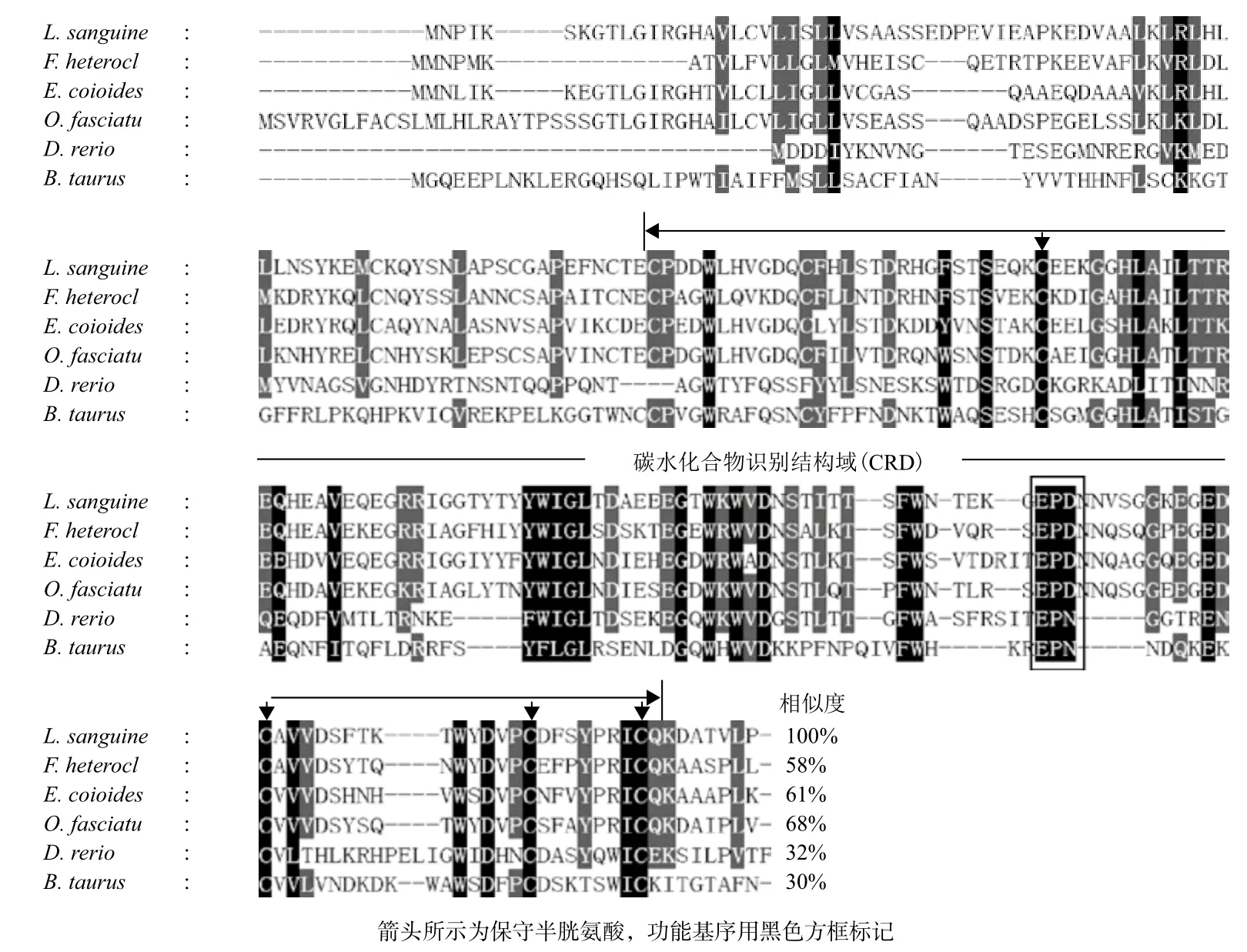
图5 红笛鲷CTL与其他物种CTL氨基酸序列比对
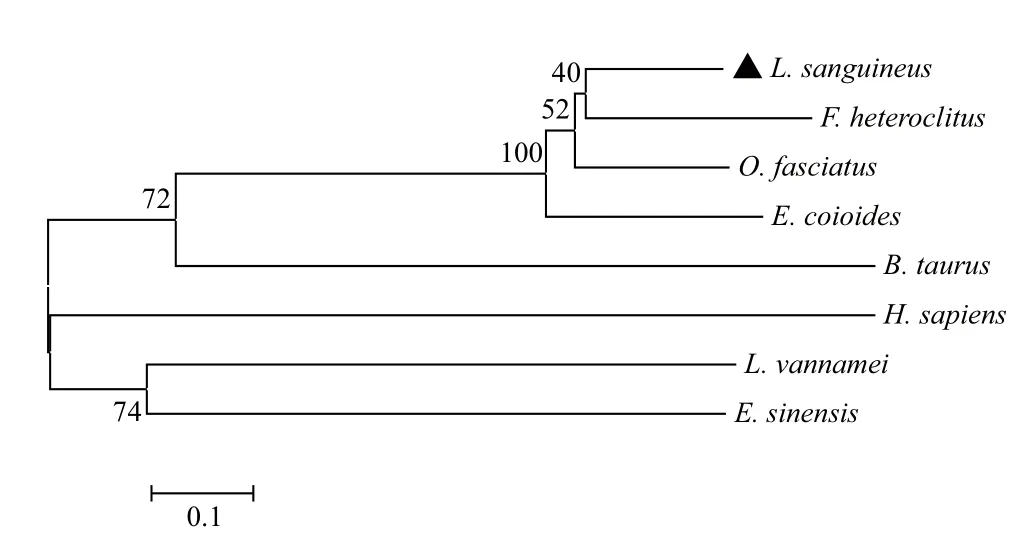
图6 红笛鲷CTL基因的进化分析
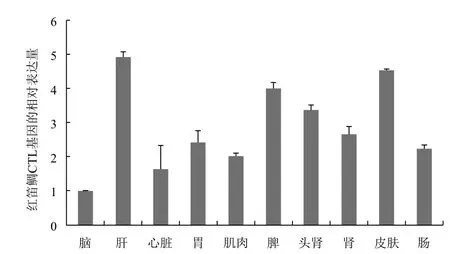
图7 红笛鲷CTL基因的组织表达分析
C 型凝集素含有特异的糖识别结构域(CRD),该类结构域一般由115-130个氨基酸组成,包括14个几乎不变的和18个高度保守的残基具有相似的序列特征,包括保守的疏水残基和4个半胱氨酸残基[16,17]。CDR结构域包含一类重要的功能基序“E/QPN/D/K/S/Q/T”[18],其中EPN基序(Glu-Pro-Asn)主要与甘露糖结合,而QPD(Gln-Pro-Asp)则对半乳糖的结合具有重要作用[16,17]。在红笛鲷CTL序列中该基序为EPD(Glu-Pro-Asp),Asp代替了EPN中第3位的Asn,此特征与石斑鱼CTL的相应序列相同。石斑鱼CTL的研究显示其主要参与半乳糖的结合,与QPD的结合特性一致,并且石斑鱼CTL能使酿酒酵母(真菌)、创伤弧菌(革兰氏阴性菌)与金黄色葡萄球菌(革兰氏阳性菌)产生凝集反应[7]。而在其他水产动物中,凡纳滨对虾CTL3蛋白也含有相同的“EPD”基序,其重组蛋白能使溶藻弧菌、副溶血弧菌(革兰氏阴性菌)以及枯草芽孢杆菌(革兰氏阳性菌)发生凝集,但是对无乳链球菌(革兰氏阳性菌)却没有相同的作用[19]。上述研究表明C型凝集素的凝集特异性可能不仅仅与本身的糖基结合特性及细菌种类相关。此外,C型凝集素 CRD结构域中还具有一段保守的“WIGL”基序,该序列可以作为鉴定C型凝集素的一个有效标志,其中的甘氨酸(Gly)由于其位置的高度保守被推测可能与CRD的折叠以及稳态相关[6]。本研究下一步将通过点突变构建突变体真核表达载体,并对红笛鲷CTL不同突变体的重组蛋白进行结构与特性分析,为深入了解该蛋白的功能机制奠定基础。
目前已报道的不同鱼类CTLs基因表达谱存在差异,且具有较明显的组织分布特异性,在免疫相关组织中均有较高的表达。其中石斑鱼CTL在肝与皮肤中的表达量最高[7],牙鲆和日本鳗鲡CTL分别仅在肝和皮肤中表达[11,12];而虹鳟CTL则分布在脾脏与外周血淋巴细胞中[8]。本研究中,红笛鲷CTL基因在肝、脾以及皮肤中表达水平较高。硬骨鱼类的肝与脾等器官在受到免疫接种后,其黑色素巨噬细胞增多,通过与淋巴细胞和抗体生成细胞的聚集参与体液免疫和炎症反应,并对内源或者外源的异物进行贮存、破坏或脱毒[20]。而鱼类皮肤的上皮组织中分布有大量的黏液细胞,是鱼体与外界环境接触的第一道屏障,对鱼体抵御病原侵染至关重要[21]。尽管不少研究已经证实鱼类CTL蛋白能使多种细菌、真菌发生凝集[7,12,22],并且鱼类CTL结合微球还能显著增强巨噬细胞的吞噬作用[22],但是鱼类CTL相关的作用模式及其在鱼类抵御病原侵染过程中的功能尚不清楚。因此,今后可以从两方面开展红笛鲷CTL基因的研究:一方面,通过原位杂交或者免疫组化技术鉴定分泌CTL的细胞类群,推测其可能的生物学功能;另一方面,分析CTL蛋白在调节免疫细胞功能及抗病原微生物免疫反应中的功能,这些研究结果将为我们进一步了解C型凝集素在鱼类免疫系统中的作用提供新的方向。
4 结论
本试验克隆获得红笛鲷CTL基因cDNA全长,该序列长828 bp,其中开放阅读框663 bp,编码220个氨基酸。组织表达分析表明,红笛鲷CTL基因在多种组织中均有表达,在肝、脾以及皮肤中表达水平较高。
[1] Janeway CA, Medzhitov R. Innate immune recognition[J]. Annu Rev Immunol, 2002, 20:197-216.
[2] Robinson MJ, Sancho D, Slack EC, et al. Myeloid C-type lectins in innate immunity[J]. Nat Immunol, 2006, 7(12):1258-1265.
[3] Ofek I, Crouch E, Keisari Y. The role of C-type lectins in the innate immunity against pulmonary pathogens[J]. Adv Exp Med Biol,2000, 479:27-36.
[4] Drickamer K. C-type lectin-like domains[J]. Curr Opin Struct Biol, 1999, 9(5):585-590.
[5] Vasta GR, Quesenberry M, Ahmed H, et al. C-type lectins and galectins mediate innate and adaptive immune functions:their roles in the complement activation pathway[J]. Dev Comp Immunol,1999, 23(4-5):401-420.
[6] Zelensky A, Gready J. The C-type lectin-like domain superfamily[J]. FEBS J, 2005, 272(24):6179-6217.
[7] Wei J, Xu D, Zhou J, et al. Molecular cloning, characterization and expression analysis of a C-type lectin(Ec-CTL)in orange-spotted grouper, Epinephelus coioides[J]. Fish Shellfish Immunol, 2010,28(1):178-186.
[8] Zhang H, Robison B, Thorgaard GH, et al. Cloning, mapping and genomic organization of a fish C-type lectin gene from homozygous clones of rainbow trout(Oncorhynchus mykiss)[J]. Biochim Biophys Acta(BBA Gene Struct Expr), 2000, 1494:14-22.
[9] Fujiki K, Bayne CJ, Shin DH, et al. Molecular cloning of carp(Cyprinus carpio)C-type lectin and pentraxin by use of suppression subtractive hybridization[J]. Fish Shellfish Immunol, 2001, 11:275-279.
[10] Richards RC, Hudson DM, Thibault P, et al. Cloning and characterization of the Atlantic salmon serum lectin, a long-form C-type lectin expressed in kidney[J]. Biochim Biophys Acta,2003, 1621(1):110-115.
[11] Kondo H, Yeu Tzeh AG, Hirono I, et al. Identification of a novel C-type lectin gene in Japanese flounder, Paralichthys olivaceus[J]. Fish Shellfish Immunol, 2007, 23(5):1089-1094.
[12]Tasumi S, Ohira T, Kawazoe I, et al. Primary structure and characteristics of a lectin from skin mucus of the Japanese eel Anguilla japonica[J]. J Biol Chem, 2002, 277:27305-27311.
[13]Marques MRF, Barracco MA. Lectins, as non-self-recognition factors, in crustaceans[J]. Aquaculture, 2000, 191:23-44.
[14] Dodd RB, Drickamer K. Lectin-like proteins in model organisms:implications for evolution of carbohydrate-binding activity[J]. Glycobiology, 2001, 11:71R-79R.
[15] Vasta GR, Ahmed H, Odom EW. Structural and functional diversity of lectin repertoires in invertebrates, protochordates and ectothermic vertebrates[J]. Curr Opin Struct Biol, 2004, 14:617-630.
[16] Drickamer K, Taylor ME. Biology of animal lectins[J]. Annual Review of Cell Biology, 1993, 9:237-264.
[17] Weis WI, Taylor ME, Drickamer K. The C-type lectin superfamily in the immune system[J]. Immunol Rev, 1998, 163:19-34.
[18] Wang XW, Wang JX. Diversity and multiple functions of lectins in shrimp immunity[J]. Dev Comp Immunol, 2013, 39(1-2):27-38.
[19] Li M, Li C, Ma C, et al. Identification of a C-type lectin with antiviral and antibacterial activity from pacific white shrimp Litopenaeus vannamei[J]. Dev Comp Immunol, 2014, 46(2):231-240.
[20]Fournier-Betz V, Quentel C, Lamour F, et al. Immunocytochemical detection of Ig-positive cells in blood, lymphoid organs and the gut associated lymphoid tissue of the turbot(Scophthalmus maximus)[J]. Fish Shellfish Immunol, 2000, 10(2):187-202.
[21] 黄智慧, 马爱军, 汪岷. 鱼类体表黏液分泌功能与作用研究进展[J]. 海洋科学, 2009, 33(1):90-94.
[22]Tsutsui S, Iwamoto K, Nakamura O, Watanabe T. Yeast-binding C-type lectin with opsonic activity from conger eel(Conger myriaster)skin mucus[J]. Mol Immunol, 2007, 44(5):691-702.
(责任编辑 马鑫)
Cloning and Tissue Expression Analysis of C-type Lectin Gene from Humphead Snapper(Lutjanus sanguineus)
Cai Jia1,2,3Zhang Xueli1,2,3Wu Zaohe2,3Jian Jichang1,2,3Lu Yishan1,2,3Feng Dongyue4Jiao Maoxing5
(1. Fisheries College,Guangdong Ocean University,Zhanjiang524088;2. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Zhanjiang524088;3. Key Laboratory of Control for Diseases of Aquatic Economic Animals of Guangdong Higher Education Institutes,Zhanjiang524088;4. National Fisheries Technical Extension Center,Beijing100125;5. Yichun University,Yichun336000)
According to conservative region of known C-type lectin(CTL)gene, a pair of degenerate primers were designed, and full length cDNA sequence of C-type lectin gene was amplified by RT-PCR and RACE PCR from spleen of humphead snapper, Lutjanus sanguineus(GenBank accession number: AGT37609)for the first time. The total cDNA sequence of the gene was 828 bp, consisting of a 663 bp open reading frame(ORF)and encoding 220 amino acids. The deduced amino acid sequence of humphead snapper CTL shared 30%-68% identities with other species CTLs. Phylogenetic analysis showed that humphead snapper CTL was clustered closely with mummichog, rock bream, and orange-spotted grouper CTL. Moreover, the mRNA expression levels in different tissues were analyzed by real time quantitative PCR. The result showed that humphead snapper CTL gene expressed in all tested tissues with highest level in liver, spleen and skin, moderate level in head kidney, kidney, stomach, intestine and muscle, and lowest level in heart and brain.
Lutjanus sanguineus;C-type lectin;gene cloning;tissue expression analysis
10.13560/j.cnki.biotech.bull.1985.2015.05.028
2014-10-11
广东高校国际合作创新平台项目(2013gjhz0008),十二五国家科技支撑计划(2012BAD17B02),广东教育厅科技创新重点项目(2012CXZD0026)
蔡佳,男,讲师,研究方向:水产动物病害防治;E-mail:matrix924@foxmail.com
鲁义善,教授,研究方向:水产动物免疫学及病害控制;E-mail:fishdis@163.com
