杆菌肽产生菌的分离鉴定及其发酵条件初步研究
2015-10-24张玉明倪志华李宝库
张玉明倪志华李宝库
(1.河北大学生命科学学院,保定 071002;2.河北大学药学院,保定 071002)
杆菌肽产生菌的分离鉴定及其发酵条件初步研究
张玉明1倪志华1李宝库2
(1.河北大学生命科学学院,保定071002;2.河北大学药学院,保定071002)
杆菌肽在畜牧养殖业中应用广泛,开展菌种筛选工作十分必要。以低浓度杆菌肽为筛选方法,分离得到一株杆菌肽产生菌,鉴定并命名为地衣芽孢杆菌Y822(Bacillus licheninformis Y822)。该菌株发酵生产杆菌肽时,最适pH为7.0,溶氧能够促进产物肽积累。将B. licheninformis Y822传代5次,分别进行发酵试验,可得到(783.51±7.34)U/mL杆菌肽,其中A组分占(75.04±0.83)%。B. licheniformis Y822杆菌肽产量较高,生产能力稳定,并且产物中杆菌肽A组分含量高,具有较高的工业应用价值。
地衣芽孢杆菌;杆菌肽;分离;鉴定
杆菌肽是由地衣芽孢杆菌(Bacillus lichnifarimis)或枯草芽孢杆菌(Bacillus subtilis)发酵产生的一种多肽类广谱抗菌素,具有抗菌谱广、不产生耐药性、安全性评估良好等优良特性。并且,杆菌肽在动物保健中具有促进动物生长、提高机体免疫力的作用,是一种在畜牧养殖业广泛应用的饲料添加剂[1]。从分子结构而言,杆菌肽为一类多肽复合体,包括杆菌肽A、A1、B、C、D、E、F1、F2等多种组分,其中杆菌肽A为主要成分,且生物活性最高[2]。
美国雅来药厂(2011年已经并入美国辉瑞公司)是世界上杆菌肽最大的生产企业,目前国内生产企业主要有浦城绿康生化有限公司、华北制药集团华胜公司和天津新星兽药厂。随着我国畜牧业及水产养殖业的迅猛发展,杆菌肽的需求与日俱增,杆菌肽的发酵生产研究得到广泛关注。胡尚勤等[3]通过细胞融合技术得到一株杆菌肽生产菌,使用柠檬酸为碳源发酵,杆菌肽产量可以高达985 U/mL。徐加兵等[4]以一株地衣芽孢杆菌(B. licheniformis SIN-669-3)为出发菌株,经过复合诱变选育和发酵培养基优化,杆菌肽产量优化前提高14.5%。有报道[5]使用固态发酵工艺生产杆菌肽,降低发酵产物中水分,得到了高浓度杆菌肽产品。目前,关于杆菌肽的研究报道多集中于菌种诱变及发酵条件优化方面。而发酵生产时,菌种是技术关键。开展菌种筛选工作,可丰富杆菌肽生产菌种资源,有助于杆菌肽的工业生产,具有重要理论意义和巨大经济效益前景。
本研究首次以低浓度杆菌肽为筛选手段,从自然界中分离杆菌肽抗性菌株,并从中筛选杆菌肽生产菌种,重点选育杆菌肽A组分高产菌株源。对分离得到的优良菌株进行发酵条件初步优化,旨在为其工业开发利用提供必要的技术支持。
1 材料与方法
1.1 材料
1.1.1 菌株 藤黄微球菌(Micrococcus luteus)为本实验室保存,地衣芽孢杆菌(B. licheniformis)Y822为本实验室分离得到。
1.1.2 主要仪器与试剂 722型可见分光光度计(上海菁华科技仪器有限公司);恒温培养振荡器(哈尔滨东联电子技术开发有限公司);北京创通P3000型高效液相色谱仪;Sigma 3K30型高速离心机;KLUP-UV-10型纯水机(成都康宁实验专用纯水设备厂);杆菌肽锌标准品(华北制药华胜有限公司);扫描电子显微镜(Hitachi SU8010型)。
1.1.3 培养基 藤黄微球菌培养基:牛肉膏0.15%,蛋白胨0.6%,酵母膏0.6%,葡萄糖0.1%,pH7.0。Luria-Bertani(LB)培养基:蛋白胨1%,酵母粉0.5%,NaCl 1%,pH7.0。杆菌肽筛选培养基:将杆菌肽锌标准品使用0.01 mol/L盐酸溶液溶解,添加到灭菌后LB固体培养基内,使杆菌肽锌终浓度为10 U/mL,培养基倾倒平板备用。
1.2 方法
1.2.1 发酵方法 杆菌肽发酵方法采用徐加兵等[4]描述的培养基。种子培养基:黄豆饼粉2.2%,淀粉0.8%,碳酸钙0.5%。发酵培养基:淀粉2.5%;豆粕粉7.0%,硫酸铵0.06%,碳酸钙0.6%。上述培养基均在121℃灭菌30 min。种子培养条件为:37℃、150 r/min、pH自然,发酵培养温度为37℃。
1.2.2 杆菌肽含量的测定 以藤黄微球菌为敏感菌株,使用双碟法[3]测定发酵液中杆菌肽效价。使用高效液相色谱法测定发酵液中杆菌肽A的含量[6]。
1.2.3 杆菌肽产生菌的分离筛选 将果园土样、活性污泥、畜牧场周边土样和泡菜汁等样品90℃处理15 min,冷却至室温,取0.2 mL涂布于杆菌肽筛选培养基平板,37℃恒温培养。培养24 h后,挑取在培养基上生长大而饱满菌落斜面保存。制备藤黄微球菌平板,将筛选得到的菌株接种于藤黄微球菌平板,37℃培养24 h,测量抑菌圈直径(H)和菌落直径(C),选取H/C比值大的菌株保存斜面,以备复筛。然后,将上述筛选得到菌株接种于发酵培养基中,37℃ 200 r/min振荡培养48 h,测定发酵液中杆菌肽含量。
1.2.4 菌种的鉴定 将筛选得到的杆菌肽产生菌进行生理生化鉴定,并对其16S rRNA序列扩增测序,测序结果比对分析,并提交至GenBank数据库。
1.2.5 发酵条件的初步研究 使用1.2.1描述的杆菌肽种子培养基和发酵培养基,分别考察种子培养条件(种龄、接种量)和发酵培养条件(pH、装液量)对生产杆菌肽的影响。
2 结果
2.1 杆菌肽产生菌的分离、筛选及鉴定
经平板初筛、藤黄微球菌抑菌试验和发酵培养复筛,共筛选到12株杆菌肽产生菌。其中一株产芽孢细菌Y822,不仅具有较高的杆菌肽生产能力,且杆菌肽产物中A组分含量高。因此,选此菌株进行深入研究。菌株Y822在LB 培养基上菌落呈圆形,边缘不齐,较薄,表面粗糙,不透明,显灰白色。显微镜镜检发现,该菌呈杆状,有中生芽孢,菌体长1.5-3.0 μm,宽0.6-0.8 μm。菌株Y822革兰氏染色呈阳性,其生理生化试验结果如表1所示。进而对菌株Y822的16S rRNA进行测序,测序结果提交GenBank(登录号HQ005269)。根据生理生化试验结果和16S rRNA测序分析结果,菌株Y822鉴定为地衣芽孢杆菌(Bacillus licheniformis),命名为Bacillus licheniformis Y822,图1为其扫描电镜图。
2.2 种子培养条件对发酵生产杆菌肽的影响
将斜面培养的B. licheniformis Y822接种入液体种子培养基,选择6个时间点(图2-A)的种子培养液接种发酵(接种量5%),考察种子液种龄对发酵的影响。发酵培养条件设定为37℃、pH6.0,500 mL三角瓶装液量100 mL,摇床转速200 r/min,发酵48 h后测定杆菌肽含量。

表1 菌株Y822的生理生化特征

图1 B. licheniformis Y822的扫描电镜图
图2-A显示,种子培养10 h后接种发酵,得到268.44 U/mL的杆菌肽。随着种子培养时间的延长,杆菌肽产量不断提高。当种子培养25 h时接种发酵,可以得到最大杆菌肽产量524.54 U/mL。图2-B为接种量对发酵生产杆菌肽的影响,此时,种子培养时间固定为25 h,发酵培养条件同上,发酵48 h后测定杆菌肽产量。本试验共考察了6个不同的接种体积(3%-13%),试验显示9%接种量为最佳值,发酵可得到624.55 U/mL杆菌肽。
2.3 发酵条件对生产杆菌肽的影响
将发酵培养基pH分别调整为6.0、6.5、7.0、7.5和8.0,培养基灭菌后,接种种子培养液进行杆菌肽发酵试验,接种量9%。发酵液置于500 mL三角瓶装中,装液量100 mL,37℃恒温震荡(200 r/min)培养48 h后测定杆菌肽产量。如图3-A所示,培养基初始pH为6.0时,得到杆菌肽620.56 U/mL。当pH值由6.0上升至7.0时,杆菌肽产量逐渐上升。发酵液中杆菌肽浓度在培养基初始pH7.0时达到最大值(712.36 U/mL)。发酵培养基pH高于7.0后,杆菌肽产量反而呈现下降趋势。结果表明,中性环境更适宜菌株B. licheniformis Y822积累杆菌肽。
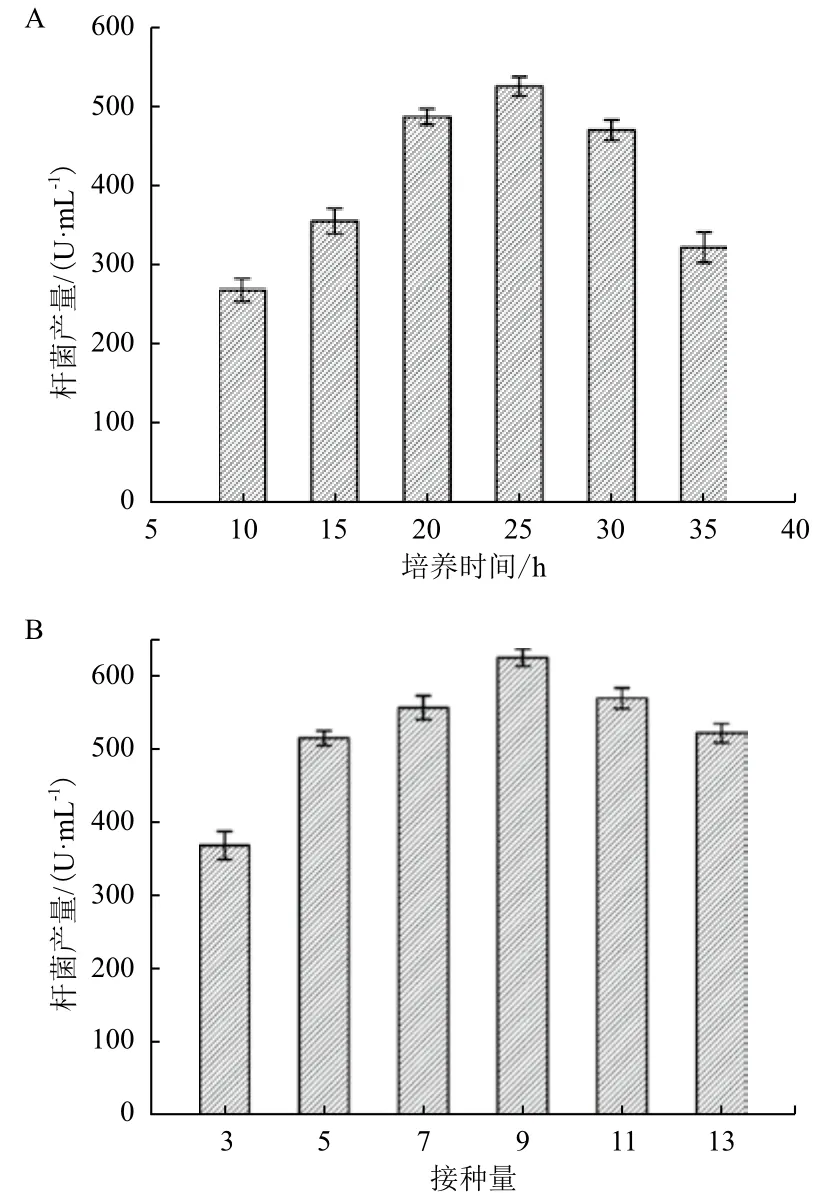
图2 培养条件对B. licheniformis Y822生产杆菌肽的影响
进一步考察通气量对发酵生产杆菌肽的影响。摇床震荡培养时,在相同转速下装液量的大小直接关系到发酵时的通气量。本研究在500 mL三角瓶中分别装入40、60、80、100和120 mL发酵培养基,37℃,摇床200 r/min振荡培养48 h后测定杆菌肽产量,结果(图3-B)显示,当培养基装液量为40 mL时,B. licheniformis Y822发酵得到的杆菌肽浓度最高(779.54 U/mL)。

图3 发酵条件对B. licheniformis Y822生产杆菌肽的影响
2.4 发酵生产杆菌肽稳定性试验
将斜面培养的B. licheniformis Y822菌株连续传代培养,共传5代。将每一传代得到的菌株进行杆菌肽发酵试验,以验证菌株的发酵产量和稳定性。结果(表2)显示,B. licheniformis Y822传代5次的平均产量为(783.51±7.34)U/mL,其中杆菌肽A占(75.04±0.83)%。

表2 B. licheniformis Y822发酵生产杆菌肽的稳定性试验
3 讨论
从自然界样品中分离筛选菌种时,选择合适的筛选方式十分重要。有研究报道[7,8],杆菌肽在细胞内合成后,需要通过位于细胞膜上的转运蛋白将其分泌到胞外。如果胞外杆菌肽浓度超过一定限度,位于细胞膜上的信号蛋白会阻止杆菌肽合成,从而避免杆菌肽产生自身毒害。一般而言,对杆菌肽耐受能力越强的菌株,其自身越有可能具备强大的杆菌肽合成能力。
杆菌肽生产菌株大多分布于芽孢杆菌属[3],本研究对样品90℃处理15 min,目的是为了杀死样品中杂菌(不产芽孢细菌和霉菌)。随后,以低浓度杆菌肽为筛选手段进一步优选杆菌肽生产菌株。本试验共筛选得到了12株杆菌肽产生菌,经过初步鉴定,分别属于地衣芽孢杆菌(Bacillus licheninformis)、枯草芽孢杆菌(Bacillus subtilis)和蜡状芽孢杆菌(Bacillus cereus)。其中,分离并鉴定得到的B. licheniformis Y822生长速度快,对指示菌(藤黄微球菌)抑菌效果最佳,因此主要对其进行深入研究。
发酵前进行种子培养可以达到活化菌种、获得高浓度细胞的目的。并且,种子培养还可诱导微生物产生适用于发酵生产的多种酶类,可提高后续发酵效率。试验发现,当接种培养10 h后,种子培养基开始出现明显液化,即黄豆饼粉和淀粉被酶解利用。因此,从10 h开始考察种子培养基培养时间对发酵生产杆菌肽的影响。种子液培养时间低于25 h时,菌体虽然开始产生淀粉酶和蛋白酶液化培养基,但是还仅限于细胞增殖,与杆菌肽合成相关酶系没有得到诱导表达。此时接种发酵,会导致菌体利用发酵培养基中碳源和氮源大量增殖,导致后期合成杆菌肽时营养不足。种子液培养25 h时,菌体正处于对数生长末期,此时菌体已经开始合成杆菌肽。接种发酵后,菌体利用发酵培养基继续合成杆菌肽,达到了最高产量。种子培养超过25 h后,由于种子培养基中营养匮乏和杆菌肽积累,微生物镜检发现菌体开始产生芽孢,不利于继续接种发酵培养基。工业发酵生产过程中,发酵接种量一般控制在5%-10%之间。接种量过低,发酵培养时没有足够的菌体细胞,会导致延滞期过长,降低发酵产率。接种量过高会导致引入发酵培养基的细胞过多,过度消耗培养基中营养,不利于发酵产物积累。本研究中,过高的接种量还会导致B. licheniformis Y822在种子培养液中积累的杆菌肽引入发酵培养基中,不利于后续发酵过程,因此最佳接种量为9%。
培养条件是发酵过程中的关键因素,本研究考察培养基pH和通气量(装液量)对发酵生产杆菌肽的影响。研究显示,B. licheniformis Y822在中性条件下生产杆菌肽能力最强。雷波[9]研究了pH对B. licheniformis的影响,结果显示7.0和7.4是菌体最佳生长pH和最优抑菌条件,其结果与本研究相一致。本研究中,菌株B. licheniformis Y822发酵产生的杆菌肽浓度与通气量密切相关。邓坤等[10]详细研究了利用地衣芽孢杆菌发酵生产杆菌肽时,培养基中溶氧对产物积累的影响。其研究表明,发酵液中溶氧提高,会显著提高菌体活力,强化菌体的糖酵解和三羧酸循环代谢。并且,高溶氧还会提高培养基中溶解氨基酸浓度,有利于合成杆菌肽[11]。
从自然界筛选得到菌株在多次传代培养过程中容易产生遗传性状退化,影响其工业化应用价值。本研究将B. licheniformis Y822传代5次,菌种生产杆菌肽的能力未发现明显衰减,并且杆菌肽A含量始终保持在75%左右。杆菌肽是一类多肽混合物,其中A组分含量决定着其生物活性高低,筛选高产杆菌肽A组分的菌种更具应用价值[12]。本研究分离筛选得到杆菌肽生产菌(B. licheniformis Y822),菌株遗传性好,产量稳定,并且产物中A组分含量高,具有较好的工业应用潜力。如果进一步对该菌进行深入研究(如优化培养基组分,使用发酵罐培养以提高溶解氧等),相信B. licheniformis Y822会有更好的发酵表现。
4 结论
本研究利用杆菌肽生产菌具备抗自身代谢产物抑制特点,使用低浓度杆菌肽为筛选手段,成功分离得到杆菌肽产生菌B. licheniformis Y822。B. licheniformis Y822发酵生产杆菌肽能力稳定,可得到生产(783.51±7.34)U/mL杆菌肽,其中杆菌肽A占(75.04±0.83)%。
[1]Ravindran V, Thomas DV, Thomas DG, et al. Performance and welfare of broilers as affected by stocking density and zinc bacitracin supplementation[J]. Animal Science Journal, 2006, 77(1):110-116.
[2]Pavli V, KmetecV. Pathways of chemical degradation of polypeptide antibiotic bacitracin[J]. Biological & Pharmaceutical Bulletin,2006, 29(11):2160-2167.
[3]胡尚勤, 王汉臣, 刘天贵. 高产杆菌肽菌株的筛选及培养条件研究[J]. 河南师范大学学报:自然科学版, 2008(1):118-121.
[4]徐加兵, 魏晓东, 那可, 等. 杆菌肽产生菌的诱变育种及培养基优化[J]. 中国医药工业杂志, 2013(5):446-448, 452.
[5]Farzana K, Shah SNH, Butt FB, et al. Biosynthesis of bacitracin in solid-state fermentation by Bacillus licheniformis using defatted oil seed cakes as substrate[J]. Pakistan Journal of Pharmaceutical Sciences, 2005, 18(1):55-57.
[6]张玉明, 倪志华, 李琳, 等. 高效液相色谱法测定发酵液中杆菌肽A[J]. 理化检验(化学分册), 2011(5):592-594.
[7] Podlesek Z, Comino A, Herzog-Velikonja B, et al. The role of the bacitracin ABC transporter in bacitracin resistance and collateral detergent sensitivity[J]. FEMS Microbiol Lett, 2000, 188(1):103-106.
[8] Neumuller AM, Konz D, Marahiel MA. The two-component regulatory system BacRS is associated with bacitracin ‘selfresistance’ of Bacillus licheniformis ATCC 10716[J]. European Journal of Biochemistry, 2001, 268(11):3180-3189.
[9]雷波. 杆菌肽发酵的培养基优化及影响其检测的因素[J]. 食品与生物技术学报, 2006, 26(6):79-82.
[10]邓坤, 冀志霞, 陈守文. 溶氧对地衣芽孢杆菌DW2合成杆菌肽的影响[J]. 中国抗生素杂志, 2009(11):664-668.
[11]Haavik HI. Effects of amino acids upon bacitracin production by Bacillus licheniformis[J]. FEMS Microbiology Letters, 1981, 10(2):111-114.
[12]Murphy T, Roy I, Harrop A, et al. Effect of oligosaccharide elicitors on bacitracin A production and evidence of transcriptional level control[J]. Journal of Biotechnology, 2007, 131(4):397-403.
(责任编辑 马鑫)
Isolation,Identification and Fermentation Characterization of a Bacitracin Producing Bacteria
Zhang Yuming1Ni Zhihua1Li Baoku2
(1. College of Life Science,Hebei University,Baoding071002;2. College of Pharmaceutical Science,Hebei University,Baoding071002)
Bacitracin has been widely utilized in livestock breeding and cultivation, and it is necessary to screen strains for improving bacitracin production. In this study, low concentration of bacitracin was used to screen bacitracin producer, and one strain was isolated and identified as Bacillus licheninformis strain Y822. The optimal culture condition for the strain was pH7.0, and the improvement of oxygen supply was favorable to the production of bacitracin. B. licheninformis Y822 was sub-cultured for 5 generations. Each generation of the strain was used to produce bacitracin using the optimized fermentation condition. The average value of the produced bacitracin from 5 generations of B. licheninformis Y822 was (783.51±7.34)U/mL, and the percentage of bacitracin A was about(75.04±0.83)%. The production of bacitracin by B. licheniformis Y822 was stable and efficient. Therefore, B. licheniformis Y822 was a potential candidate for producing bacitracin in industry.
Bacillus licheninformis;bacitracin;isolation;identification
10.13560/j.cnki.biotech.bull.1985.2015.05.024
2014-09-19
河北省教育厅计划(z2012206),保定市科技局计划(12ZN012)
张玉明,博士,讲师,研究方向:发酵工程、生物化工;E-mail:zhangyuming@hbu.edu.cn
