甲型H1N1流感病毒FAST-LAMP检测方法的建立
2015-10-24吕沁风罗鹏何蕾杨永耀郑伟李莉吴忠华
吕沁风 罗鹏 何蕾 杨永耀 郑伟 李莉 吴忠华
(浙江国际旅行卫生保健中心,杭州 310003)
甲型H1N1流感病毒FAST-LAMP检测方法的建立
吕沁风 罗鹏 何蕾 杨永耀 郑伟 李莉 吴忠华
(浙江国际旅行卫生保健中心,杭州310003)
建立一种新型等温扩增检测方法,用于提高等温扩增反应的检测速度,应用于甲型H1N1流感病毒检测。根据HA基因设计一组引物,包括外引物、内引物、环引物及套内引物,套内引物的加入增加了引物与模板的接触位点,提高扩增效率,缩短检测时间。结果显示,FAST-LAMP检测法比普通LAMP检测法时间缩短45 min左右,比加入环引物的LAMP检测方法缩短20 min,大大缩短了反应的检测时间。检测灵敏度可达到1×102拷贝。FAST-LAMP是一种高效、更快的检测方法。
FAST-LAMP;甲型H1N1流感病毒;检测
环介导等温扩增技术(Loop-mediated isothermal amplification,LAMP)是一种新型的核酸扩增技术,该方法针对靶基因的6个区域设计4种引物,在等温60-65℃条件下利用Bst聚合酶即可进行109-1010倍的核酸扩增[1,2]。LAMP产物通过浊度或者荧光变化可用肉眼观察,具有操作简便、特异性强、灵敏度高等优点[3,4]。自2000年环介导等温扩增技术问世以来,该方法在病原体检测、疾病诊断等领域广泛应用[5-8]。如何在现有的LAMP技术基础上,发掘更高效快速的等温扩增方法,成为重要的研究方向,目前最快速的LAMP反应方法是加入环引物[9,10]。本研究设计一种新型快速的等温扩增方法,改变其现有的引物设计方法,使环介导等温反应扩增完成的时间比加入环引物所用的时间更短。
流行性感冒病毒,属于正黏液病毒科,是一种造成人类及动物患流行性感冒的RNA病毒,它会造成急性上呼吸道感染,并在空气中迅速传播,在世界各地常会有周期性的大流行[11,12]。人流感病毒分为甲(A)、乙(B)、丙(C)三型,其中甲型流感病毒是变异最为频繁的一个类型[13]。2009年起源于墨西哥的的甲型H1N1流感病毒爆发流行造成全球数千万人大流行,死亡人数达到1 800多人[14,15]。在大流行后期,该病毒仍在流行,实验室检测证实该病毒在2013年仍为欧洲、亚洲等地流感的流行株[16-23]。2013年美国、中国内地仍有死亡病例报道[24-27]。本试验以甲型H1N1流感为例研究新型快速等温扩增检测,旨在为了建立新型等温扩增方法,提高检测速度提供帮助。
1 材料与方法
1.1 材料
1.1.1 试剂 RNA提取试剂盒和胶回收试剂盒购用QIAGEN公司,AMV逆转录酶购自Promega公司,Bst-DNA polymerase购自NEB公司。TaKaRa Ex Taq酶和dNTP购自TaKaRa公司,RNase Inhibitor购自Fermentas公司,MgSO4和Betain为Sigma-Aldrich公司产品,EVA Green购自Biotium公司、DNA Marker DL2000和琼脂糖Agrose 购自TaKaRa公司。甲型H1N1流感病毒、甲型H3N2流感病毒、乙型流感病毒、水痘病毒、副流感病毒、人偏肺病毒等为本室保存。
1.1.2 仪器 2720型PCR仪和7500型荧光定量PCR仪购置购自ABI公司,电泳仪购自Bio-Rad公司。
1.2 方法
1.2.1 引物设计 常规LAMP技术含有一对外引物,一对内引物,选择加入一对环引物,可在等温条件下进行核酸扩增。本研究根据甲型H1N1流感病毒血凝素(hemagglutinin,HA)基因保守区设计一组引物族[20,27],引物的设计是在带有环引物的外FIP1和外BIP1的扩增产物区域再次设计内FIP2和内BIP2引物,使得FIP1和BIP1的产物能再次成为FIP2和BIP2的LAMP扩增模板,FIP1和BIP2、FIP2和BIP1也同时形成正常的LAMP扩增系统。即本套引物同时形成了4套独立的LAMP扩增系统,从而使扩增速率增加。引物序列,见表1。

表1 甲型H1N1流感病毒核酸FAST-LAMP扩增引物
1.2.2 病毒RNA的提取 严格按QIAGEN RNA抽提试剂盒说明书提取病毒RNA,溶于100 μL无RNase水中,-70℃保存。
1.2.3 反应体系及反应条件 FAST-LAMP反应体系如下:10×buffer 2.5 μL,引物混合物1 μL(引物混合物中各引物浓度分别如下:F3、B3各1 μmol/L,FIP、BIP各15 μmol/L,Loop-f、Loop-r各5 μmol/L, FNP、BNP各15 μmol/L),模板RNA 1 μL,8 U Bst-DNA聚合酶1 μL,10 U AMV逆转录酶1 μL,甜菜碱(8 mol/L)2 μL,dNTP(10 mmol/L)2 μL,MgSO4(100 mmol/L)1.2 μL,1.25 μL 20× 的 Eva green加入DEPC-H2O补足25 μL。普通RT-LAMP反应体系除引物混合物为(引物混合物中各引物浓度分别如下:F3、B3各 1 μmol/L,FIP、BIP各 15 μmol/L),加入环引物的引物混合物为(F3、B3各1 μmol/L,FIP、BIP各15 μmol/L,Loop-f、Loop-r各5 μmol/L),其他与FAST-LAMP一致,反应条件为:63℃,55 s,荧光采集5 s,100个循环在荧光定量PCR仪(Chromo4-Bio-Rad公司)中进行。引物混合物中各引物浓度,见表2。
1.2.4 灵敏度试验 利用反转录试剂盒中的随机引物法将提取好的RNA反转录成cDNA,以cDNA为模板,用PCR引物进行扩增,将PCR产物纯化回收试剂盒进行纯化回收,对纯化后的PCR产物测定OD值,根据产物长度和OD值进行copies数计算。将cDNA进行10倍递进稀释,取1 μL作为模板加入反应体系中,在63℃恒温条件下,反应60 min。在荧光定量PCR仪上观察实时荧光反应图,并取2 μL反应产物进行1%琼脂糖凝胶电泳。
1.2.5 特异性试验 利用FAST-LAMP反应体系,以H3N2、乙型流感、水痘病毒、人偏肺病毒、副流感病毒等核酸作为待测样品进行检测,观察实时荧光反应,并将扩增产物进行电泳分析。
1.2.6 重复性试验 根据灵敏度试验结果选择阴性、1×102copies/μL、1×104copies/μL和 1×106copies/μL浓度的cDNA模板分别进行FAST-LAMP,每份样本各取1 μL重复3次,采用实时荧光定量PCR仪进行检测,观察反应的Ct值,根据Ct值计算变异系数,对该方法的重复性进行考核。

表2 各反应体系中的引物组成及引物浓度
1.2.7 扩增方法反应时间比较 将普通LAMP、加入环引物LAMP和FAST-LAMP反应采用同一样本同时检测,反应条件为63℃,55 s,荧光采集5 s,100个循环。
1.2.8 产物测序分析 将FAST-LAMP的扩增产物胶回收后进行序列分析,分别采用内引物和套内引物为测序引物。
1.2.9 样本检测 收集浙江口岸机场发热人员鼻咽拭子35份,根据说明书提取RNA,采用FASTLAMP技术进行检测。将检测结果与荧光定量PCR结果进行比对。
2 结果
2.1 不同扩增方法反应时间的比较
根据实时荧光检测的结果(图1)可见,FASTLAMP的反应时间控制在40-45 min左右,加入环引物的LAMP反应时间为65 min左右,普通LAMP反应时间在90 min左右。

图1 甲型H1N1流感病毒不同扩增方式实时荧光检测
2.2 特异性试验结果
采用甲型H1N1流感病毒FAST-LAMP方法进行检测,电泳反应结果(图2)显示,甲型H1N1流感病毒出现与普通LAMP反应相似的阶梯状条带,且条带比普通LAMP反应更多。此外,阴性对照、H3N2病毒、乙型流感病毒、水痘病毒、人偏肺病毒和副流感病毒核酸的检测结果均为阴性,由此显示了该方法具有较好的特异性。
2.3 灵敏度试验结果
在荧光定量PCR仪上观察实时荧光反应图,结果见图2;并取2 μL反应产物进行1%琼脂糖凝胶电泳,结果见图3,1-5泳道均出现细密的阶梯状条带,表示出现有阳性扩增反应。可以判定本方法的检测极限约为1×102copies/μL。

图3 甲型H1N1流感病毒FAST-LAMP灵敏度实时荧光曲线

图4 甲型H1N1流感病毒Fast-LAMP灵敏度电泳结果
2.4 重复性试验结果
根据实时荧光RT-LAMP的结果,记录各次试验的Ct值。根据Ct值计算SD值及变异系数(CV%),见表3。结果表明强阳性及临界值样本的CV值均小于5%,重复性良好。
2.5 产物测序结果
由于产物组成的复杂性,出现了个别碱基错配,各引物检测FAST-LAMP产物序列分析的整体结果表明,套内引物FNP和BNP、内引物FIP和套内引物BNP,套内引物FNP和内引物BIP组合均能扩增出相应的产物,环引物也能与FNP扩展出相应的产物。由此可证明本检测方法中各引物之间确实能各自组合扩增。
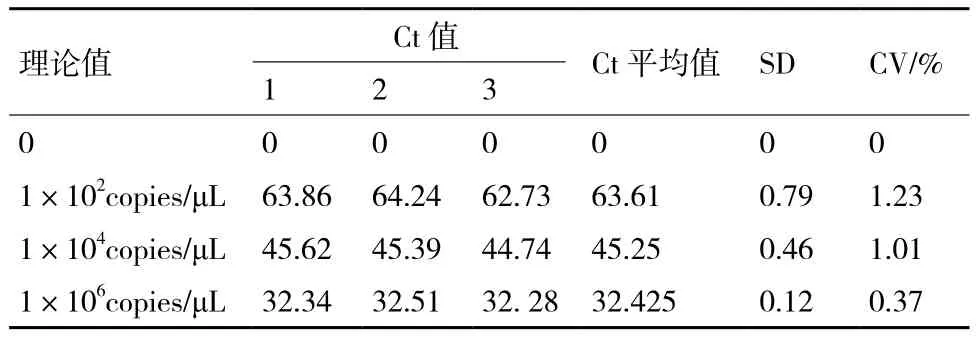
表3 甲型H1N1流感病毒FAST-LAMP重复性实验结果
2.6 临床样本检测
采用FAST-LAMP技术进行检测结果发现,35例机场口岸送检本实验室的鼻咽拭子样本中有8例甲型H1N1流感病毒阳性,与荧光定量PCR检测结果相符。
3 讨论
环介导等温扩增技术由于操作简单,无需昂贵的实验仪器,反应在1-1.5 h内完成,灵敏度高,吸引了大量的研究力量投入到了该领域的研究。目前环介导等温扩增技术仅仅是在该方法建立基础上,利用现有的引物设计方法检测目的基因,或是在产物的检测方式上有所改变,在扩增方式上没有实质性的创新[1-7]。在实时荧光定量PCR扩增仪中观察LAMP的扩增曲线从Ct值到平台期的时间非常短,一般均在2 min之内[28],即潜伏期的长短决定了整个反应时间的长短。LAMP反应是以产物的量为判断依据,在普通LAMP中和模板接触的是一对引物,4个位点决定了LAMP反应的内在扩增效率,除此之外,引物浓度等的条件优化、模板量和酶的量等决定了外在的扩增效率,本研究的创新点在于提高反应的内在扩增效率。在LAMP反应体系中加入环引物增加了两个与核酸模板接触的位点[9],提高了扩增效率,但不改变产物的种类。如果把引物和模板的结合位置由4个变为8个,那么反应的产物将由1种变为4种,理论上能大幅增加扩增效率。
本研究的设计方案:在目的基因内两端设计常规环介导等温扩增引物(一对外引物F3、B3和一对内引物FIP、BIP),并留出设计套内引物FNP、BNP和环引物Loop-f、环引物Loop-r的足够碱基;加入环引物Loop-f、环引物Loop-r,可使LAMP反应中引物和核酸模板接触的位置增加两个,提高了扩增效率。在外侧内引物FIP和BIP之间设计一对套内引物FNP、BNP,此时等温扩增反应不但能用套内引物FNP与BNP根据核酸模板进行扩增,同时也可以和外侧常规LAMP引物扩增的产物结合并扩增,使与核酸模板接触的位置又增加了4个。套内引物FNP 不但可以和套内引物的BNP联合进行扩增反应,同时也能与外侧的常规内引物BIP联合进行扩增,增大了与核酸模板结合和扩增的机会;反之,套内引物BNP也可以与套内引物的FNP联合进行扩增反应,同时也能与外侧的常规内引物FIP联合进行扩增反应。常规LAMP反应和加入环引物的LAMP的扩增产物只有1种产物的循环序列,加入环引物不改变产物的序列;在加入套内引物后,产物就是4种扩增产物的循环序列,即内引物FIP、BIP的扩增产物,套内引物FNP、BNP的扩增产物,内引物FIP和套内引物BNP的扩增产物,套内引物FNP和内引物BIP的扩增产物。
在本次试验中FAST-LAMP的反应时间比普通LAMP反应时间缩短了45 min左右,比加入环引物的LAMP反应时间缩短了15 min左右,在相同条件的情况下大大提高了反应的扩增效率。本方法扩增出的LAMP产物为4种不同LAMP组合的混合物的倍数条带,阳性条带大小的差异很小,条带分布比普通LAMP更加细密,故而梯度状条带不是很清晰。本方法的产物经电泳割胶回收后测序结果符合实验预期,各引物之间能相互扩增。相比用传统的LAMP检测技术,该方法在检测时间上大大缩短,普通LAMP用于检测H1N1病毒仍需在1.5 h左右,且灵敏度与本研究建立的检测方法相当[29,30]。由于受病毒基因的限制,该检测方法的改进在细菌检测、物种鉴定等检测中具有更大的发展前景,可将反应时间控制更短。
4 结论
在相同的检测条件下,本研究建立的改良的环介导等温扩增方法应用于甲型H1N1流感病毒检测,具有更快的扩增速度。检测灵敏度可达到1×102拷贝,特异性与重复性良好;具有简便、高效、准确的特点。
[1] Notom T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acid Research, 2000, 28(12):e63.
[2]Nagamine K, Watanabe K, Ohtsuka K, et al. Loopmediated isothermal amplification reaction using a nondenatured template[J]. Clin Chem, 2001, 47:1742-1743.
[3]Goto M, Honda E, Ogura A, et al. Colorimetric detection of loopmediated isothermal amplification reaction by using hydroxyl naphthol blue[J]. Biotechniques, 2009, 46:167-172.
[4]Mori Y, Nagamine K, Tomita N, Notomi T. Detection of loopmediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation[J]. Biochem Biophys Res Commun, 2001, 289:150-154.
[5] Lyu QF, Che Y, Zhang W, et al. Establishment of reserve transcription loop-mediated isothermal amplification method for Yellow fever virus[J]. Microbiology China, 2014, 41(1):184-190.
[6] Zhao Z, Fan B, Wu G, et al, Development of loop-mediated isothermal amplification assay for specific and rapid detection of differential goat Pox virus and Sheep Pox virus[J]. BMC Microbiol, 2014, 14(1):10.
[7]Su JY, Liu XC, Cui HM, et al, Rapid and simple detection of methicillinresistance staphylococcus aureus by orfX loop-mediated isothermal amplification assay[J]. BMC Biotechnol, 2014, 24;14(1):8.
[8]Tomita N, Mori Y, Kanda H, Notomi T. Loop-mediated isothermal amplification(LAMP)of gene sequences and simple visual detection of products[J]. Nature Protoc, 2008, 3:877-882.
[9]Nagamine K, Hase T, Notomi T. Accelerated reaction by loopmediated isothermal amplification using loop primers[J]. Mol Cell Probes, 2002, 16(3):223-229.
[10]Ihira M, Yoshikawa T, Enomoto Y, et al. Rapid diagnosis of human herpesvirus 6 infection by a novel DNA amplification method, loopmediated isothermal amplification[J]. J Clin Microbiol, 2004, 42(1):140-145.
[11]Valleron AJ, Cori A, Valtat S, et al. Transmissibility and geographic spread of the 1889 influenza pandemic[J]. Proc Natl Acad SciUSA, 2010, 107(19):8778-8781.
[12]Mills CE, Robins JM, Lipsitch M. Transmissibility of 1918 pandemic influenza[J]. Nature, 2004, 432(7019):904-906.
[13]LeBlanc JJ, Li Y, Bastien N, et al. Switching gears for an influenza pandemic:validation of a duplex reverse transcriptase PCR assay for simultaneous detection and confirmatory identification of pandemic(H1N1)2009 Influenza Virus[J]. J Clin Microbiol,2009, 47(12):3805-3813.
[14]Influenza A(H1N1)-update 103. World Health Organization. 2010-06-04 Retrieved 2010-10-16
[15]WHO(2013)Influenza update Nu182. 182:3-4. Available:http://www. who. int/influenza/surveillance_monitoring/ updates/2013-04-02_surveillance_update 182. pdf.
[16]de la Rosa-Zamboni D, Vázquez-Pérez JA, Avila-Ríos S, et al. Molecular characterization of the predominant influenza A(H1N1)pdm09 virus in Mexico, December 2011-February 2012[J]. PLoS One, 2012, 7(11):e50116.
[17] Wu C, Cheng X, Wang X, et al. Clinical and molecular characteristics of the 2009 pandemic influenza H1N1 infection with severe or fatal disease from 2009 to 2011 in Shenzhen, China[J]. J Med Virol, 2013, 85(3):405-412.
[18] Brooke RJ, VAN Lier A, Donker GA, et al. Comparing the impact of two concurrent infectious disease outbreaks on The Netherlands population, 2009, using disability-adjusted life years[J]. Epidemiol Infect, 2014, 24:1-10.
[19] Gomez-Barroso D, Martinez-Beneito MA, Flores V. Geographical spread of influenza incidence in Spain during the 2009 A(H1N1)pandemic wave and the two succeeding influenza seasons[J]. Epidemiol Infect, 2014, 27:1-13.
[20] Dakhave M, Khirwale A, Patil K, et al. Whole-genome sequence analysis of postpandemic influenza A(H1N1)pdm09 virus isol-ates from India[J]. Genome Announc, 2013, 1(5):e00727-13.
[21] Chudasama RK, Patel UV, Verma PB. Characteristics of hospitalized patients with severe and non-severe pandemic influenza A(H1N1)in Saurashtra region, India(two waves analysis)[J]. J Family Med Prim Care, 2013, 2(2):182-187.
[22] Kiertiburanakul S, Morasert T, Sirinavin S, et al. Comparisons of clinical characteristics between adult patients with 2009 H1N1 influenza and those with seasonal influenza during the 2009 Epidemic in Thailand[J]. Jpn J Infect Dis, 2014, 67(1):33-39.
[23]Wang XL, Wong CM, Chan KH, et al. Hospitalization risk of the 2009 H1N1 pandemic cases in Hong Kong[J]. BMC Infect Dis,2014, 14(1):32.
[24]North Texas confirmed 20 flu deaths[Last accessed on 2014-01-08]. Available from:http://news. xinhuanet. com/english/ world/2014-01/08/c_133026240. htm
[25]http://news. sina. com. cn/c/2013-04-03/222126728529. shtml
[26] Ren YY, Yin YY, Li WQ, et al. Risk factors associated with severe manifestations of 2009 pandemic influenza A(H1N1)infection in China:a case-control study[J]. Virol J, 2013, 10:149.
[27] Choi JH, Kim MS, Lee JY, et al. Development and evaluation of multiplex real-time RT-PCR assays for seasonal, pandemic A/H1pdm09 and avian A/H5 influenza viruses detection[J]. J Microbiol, 2013, 51(2):252-257.
[28] Mori Y, Kitao M, Tomita N, Notomi T. Real-time turbidimetry of LAMP reaction for quantifying template DNA[J]. J Biochem Biophys Methods, 2004, 59:145-157.
[29]聂凯, 王大燕, 秦萌, 等. 基于颜色判定的环介导逆转录等温扩增技术检测人甲型H1N1 流感病毒基因[J]. 病毒学报,2010, 26(2):81-87.
[30]王翔, 张骞, 张钫, 等. 甲型H1N1流感病毒HA基因RTLAMP 检测方法的建立与初步应用[J]. 生物技术通讯,2011, 22(5):696-708.
(责任编辑 李楠)
The Establishment of FAST-LAMP Method for Detecting Influenza A(H1N1)Virus
Lü Qinfeng Luo Peng He Lei Yang Yongyao Zheng Wei Li Li Wu Zhonghua
(Zhejiang International Travel Healthcare Center,Hangzhou310003)
It was to establish a new loop-mediated isothermal amplification(FAST-LAMP)for rapidly detecting influenza A(H1N1)virus. A set of primers were designed according to HA gene, including the outer primers, internal primers, loop primers and nest internal primers. The nest internal primers increased the contact sites of primers and nucleic acid template, so that the amplification efficiency could be improved and detection time reduced. The FAST-LAMP method could be 45 less than LAMP method, and 20 minutes less than LAMP method with loop primers, i.e. detection time reduced significantly detecting sensitivity reached 1×102copies cDNA template/tube. It proved that the established FAST-LAMP method is an efficient and reliable method for detecting influenza A(H1N1)virus.
FAST-LAMP;H1N1 influenza virus;detection
10.13560/j.cnki.biotech.bull.1985.2015.05.013
2014-08-14
国家质检公益性行业科研专项项目(201010043),国家质检总局科技项目(2013IK245)
吕沁风,女,硕士,副主任技师,研究方向:传染病检测;E-mail:fionallll@163.com
