荸荠皮总黄酮的纯化及其抗氧化活性研究
2015-10-24李行任罗杨合韦琳韦学丰高志明
李行任,罗杨合,韦琳,韦学丰,高志明
(贺州学院桂东特色资源研究与开发广西高校重点实验室,广西贺州542899)
荸荠皮总黄酮的纯化及其抗氧化活性研究
李行任,罗杨合*,韦琳,韦学丰,高志明
(贺州学院桂东特色资源研究与开发广西高校重点实验室,广西贺州542899)
利用大孔吸附树脂纯化荸荠皮总黄酮,探讨总黄酮的纯化条件,并通过总抗氧化性能试验、ABTS试验和DPPH试验评价了总黄酮抗氧化活性。试验结果表明,用乙醇水溶液梯度洗脱D101大孔吸附树脂,获得纯度高、抗氧化活性好的荸荠皮总黄酮,黄酮收率为58.52%,纯度为70.64%。所得总黄酮具有良好的还原能力,为0.60 mmolTE(Trolox当量)/g,和良好的ABTS·+、DPPH自由基清除活性,IC50分别为1.86、0.49 mmolTE/g,其中ABTS·+自由基清除性能均大于对照物Trolox和芦丁,DPPH自由基清除性能大于芦丁。
荸荠皮;总黄酮;纯化;大孔吸附树脂;抗氧化活性
荸荠(Eleocharis tuberosa)是莎草科荸荠属水生植物的地下球茎,是深受欢迎的药食两用果蔬,在我国大部分地区广泛种植,因其丰富的营养和特别的药用价值而受到广泛的关注[1]。荸荠含有丰富的活性物质,存在荸荠果皮与果肉之间,其果皮的提取物富含黄酮和酚类物质[2-3],也具有良好的抑菌作用[4]和抗氧化活性[5]。目前报道荸荠皮黄酮的文献只局限于荸荠皮提取物及其相关应用的研究[2,4-6],而荸荠皮提取物的成分复杂,除含黄酮外,还含其他的成分[3],鲜有文献报道其黄酮的纯化。随着荸荠产品的需求增加,废弃荸荠皮更容易获得,开发荸荠皮黄酮相关的产品成为可能。黄酮具有的多种活性都与人类的疾病息息相关,其极强的抗氧化性能,使富含黄酮的荸荠皮更受人们的关注,更深入开发和应用荸荠皮黄酮产品成为需要[2]。本课题纯化了荸荠总黄酮,获得纯度高、抗氧化活性好黄酮产品,对荸荠皮活性成分的开发与应用具有重要意义。
1 材料与方法
1.1试剂与仪器
荸荠皮:收集自贺州市市场,剔除腐烂部分,洗净,晾干,粉碎,备用。X-5、D101、NKA-9和AB-8大孔树脂:天津市光伏精细化工研究所;芦丁(为生化试剂):购自中国食品药品检定研究院;6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)、1,1-苯基-2-三硝基苯肼(DPPH)、2,2′-氨基-二(3-乙基苯并噻唑啉-6-磺酸)(ABTS):Sigma-Aldrich公司;其余试剂为分析纯。SP-722分光光度计:上海光谱仪器有限责任公司。
1.2大孔树脂纯化荸荠皮总黄酮
1.2.1大孔树脂预处理
大孔树脂加入锥形瓶中,用无水乙醇浸泡24 h,蒸馏水洗至流出液加水无白色浑浊为止,然后用蒸馏水洗至无醇味,过滤,常温下保存,备用。
1.2.2荸荠皮总黄酮粗液的制备
荸荠皮粉末(20.0 g),加入50%丙酮(700 mL×2),在60℃下提取1.5 h,提取2次。过滤,浓缩至干,获得总黄酮粗品[3]。将粗品溶于10%甲醇,并调节其黄酮含量在0.11 mg/mL~0.88 mg/mL之间,在低温避光保存,2 d内使用。
1.2.3分析与计算
提取液和成品的黄酮含量按文献的方法[6]测定;

1.2.4静态吸附选择大孔树脂
使用不同类型的树脂吸附相同的粗黄酮溶液来评价大孔树脂的吸附性能,通过树脂的静态吸附率来选择吸附较好的树脂。取预处理过的树脂5.00 g,加入含量为0.22 mg/mL的荸荠皮提取液50 mL,在25℃下浸泡24 h。测定上清液的吸光度,计算吸附率。
1.2.5静态吸附动力学
准确称取已选用的大孔树脂5.00 g,装入100 mL具塞磨口锥形瓶中,加入含量为0.22 mg/mL的黄酮粗提液50 mL,在25℃下恒温震荡器上震荡,每20 min取上清夜测定黄酮含量,直到达到平衡为止。作出吸附率-时间曲线。
1.2.6最大吸附量的确定
称取经预处理过的大孔树脂5.00 g,分别置于100 mL锥形瓶中,加入黄酮浓度为0.22 mg/mL的荸荠皮粗提物25、50、75、100 mL,于25℃震荡吸附12 h,测定黄酮含量,总吸附率为最大吸附量。
1.2.7静态解吸考察乙醇浓度的解吸率
各取适量已吸附荸荠皮黄酮的树脂,分别加入10体积的不同浓度的乙醇水溶液(0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%),震荡12 h后过滤,取滤液测定黄酮含量。考察不同浓度乙醇的解吸率。
1.2.8动态等度洗脱
取适当活化的树脂装柱(30 cm×50 cm),将荸荠皮黄酮原液按最大吸附量上柱,静态吸附6 h后水洗至FeCl3显色不明显,按最大解吸率的乙醇浓度洗至吸光度至FeCl3显色不明显。考察树脂的解吸率与时间的关系。
1.2.9动态梯度洗脱
取适当活化的树脂装柱(30 cm*70 cm),将荸荠皮黄酮原液按最大吸附量上柱,静态吸附6 h后水洗至FeCl3显色不明显,按不同的乙醇浓度(10%、30%、50%、70%和100%)洗至吸光度至FeCl3显色不明显,换下一浓度。洗脱液浓缩,测定黄酮含量,计算回收率。
1.3抗氧化活性测定
1.3.1ABTS阳离子自由基清除活性的测定(TECA)
荸荠皮黄酮的ABTS阳离子自由基清除活性通过文献[7]描述的方法评价。含2.45 mmol/L过硫酸钾的ABTS水溶液(7 mmol/L)在室温下放置12 h~16 h,然后用磷酸缓冲溶液PBS(pH 7.4)稀释至在734 nm的吸光度为0.7(±0.02)。不同浓度的样品(0.1 mL)或Trolox的乙醇溶液(最终浓度为0 μmol/L~15 μmol/L)或PBS溶液加入到1.9 mL ABTS·+溶液,摇匀,30℃水浴中加热6 min后,测定溶液在734 nm处的吸光度。芦丁乙醇溶液为正相控制。ABTS清除率(%):I%=[1-(Asample/Ablank)]×100。黄酮的清除活性用mmol/gTrolox当量表示。
1.3.2DPPH自由基清除活性的测定
清除DPPH能力根据Rodrigo Scherer和Helena Teixeira Godoy[8]描述的方法测定。在不同浓度0.1 mL样品溶液或空白(乙醇)中,加入3.9 mL DPPH乙醇溶液(0.080 mmol/L),摇匀,在37℃水浴中避光加热30 min,在517 nm下测定吸光度。Trolox和芦丁为参考。清除率:I%=[1-(Asample/Ablank)]×100,作出曲线,求得IC50值。样品活性用mmol/g Trolox当量表示。
1.3.3还原能力的测定
荸荠皮黄酮的还原能力测定参考文献[9]描述的方法。样品溶液(1mL,0.1mg/mL60%乙醇溶液),加入磷酸缓冲溶液(PBS,2.5 mL,0.2 mmol/L,pH 6.6)、K3Fe(CN)6(2.5mL,10mg/mL),摇匀,在50℃水浴中加热20min,然后加入2.5mL三氯乙酸(100mg/mL),在转速2000r/min下离心10 min。取2.5 mL上清液,加入蒸馏水(2.5 mL)和FeCl3(0.5 mL,1.0 mg/mL),测定其700 nm处的吸光度。芦丁乙醇溶液(10 μmol/L)和不同浓度的Trolox乙醇溶液(0 mmol/L~0.2 mmol/L)为正相控制。还原能力用mmol/g Trolox当量表示。
2 结果与讨论
2.1荸荠皮总黄酮的纯化
2.1.1静态吸附选择大孔树脂
由于黄酮提取液蒸除乙醇后,有固体颗粒出现,不能完全分散在水中,直接过滤将损失部分黄酮,直接使用后发现解吸后的总黄酮含量高于原液。经试验发现,用10%甲醇溶解后过滤,获得澄清的黄酮粗液,但对吸附率有一定的影响。不同类型的大孔树脂的吸附结果如表1所示。
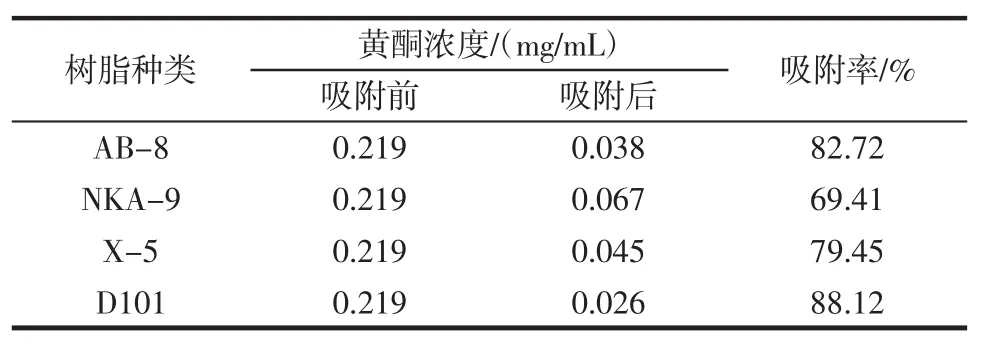
表1 不同树脂对荸荠皮总黄酮的静态吸附结果Table 1The results for resins on static adsorption of chufa peels total flavonoids
由表1可看出D101的吸附率最高,为88.12%,AB-8次之。选择D101为纯化树脂。
2.1.2静态吸附动力学结果
D101大孔树脂对黄酮静态吸附的动力学结果如图1所示。
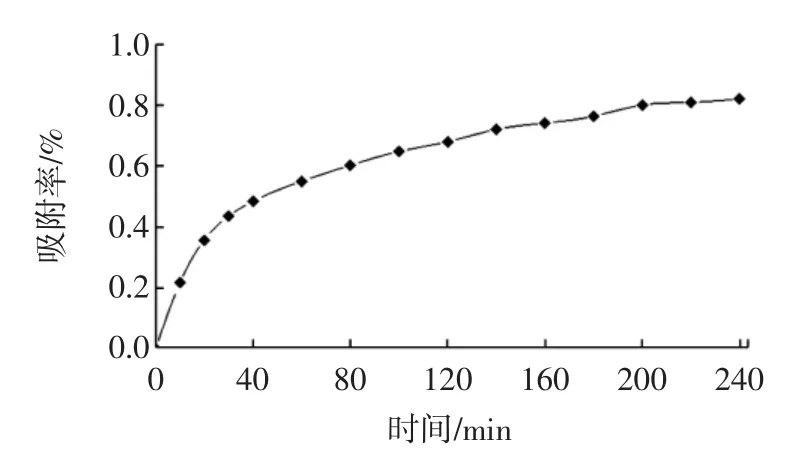
图1 D101对黄酮的静态吸附动力学结果Fig.1The kinetics result for D101 on static adsorption of flavonoids
树脂的吸附速率与黄酮的浓度有关[10];刚开始时,树脂的吸附速度很快,随着黄酮浓度减少和树脂吸附黄酮量的增加,吸附速率下降,30 min后吸附速率开始变缓,200 min后基本不变化,树脂的吸附能力已被消耗。从图可知,D101树脂对荸荠皮黄酮有快速的吸附能力,吸附率达82.06%,在生产上有利于缩短时间,降低生产成本。
2.1.3最大吸附量的测定结果
D101树脂对荸荠皮黄酮的总吸附量结果如图2。

图2 最大吸附量的测定结果Fig.2The result of maximum adsorption content
由图2可知,随着黄酮溶液体积的增大,树脂的吸附量也增加,但是黄酮的吸附率下降。可见,高浓度的黄酮溶液会增大树脂的吸附量;而在实际生产中,低的吸附率会浪费黄酮原料,增加成本。故采用最大吸附率的前提下,增加吸附量是较好的选择。在10 BV时,吸附率最大,为83.87%,总吸附率为1.84 mg/g,黄酮吸附趋于吸附饱和。
2.1.4不同乙醇浓度的静态解吸结果
不同浓度的乙醇对饱和黄酮树脂的静态解吸结果见图3。

图3 不同浓度的乙醇对黄酮的静态解吸结果Fig.3The results for different concentration of ethanol on static desorption of flavonoids
荸荠皮提取物含有黄酮及其苷,乙醇浓度低时,部分黄酮苷被解吸;乙醇浓度过高,解吸能力下降;50%乙醇对荸荠皮黄酮具有最好的解吸效果,解吸率为80.10%。
2.1.5等度洗脱结果
50%乙醇对黄酮的等度洗脱结果如图4所示。

图4 等度洗脱结果Fig.4The result of isocratic elution for flavonoids
由图4可见,该浓度的乙醇在20 min前的解吸率上升较快,黄酮容易洗脱;随后变缓,到100 min后解吸率基本没有发生变化。黄酮的解吸时间短,有利于黄酮的生产,但也降低了树脂的分离效果,得不到高纯度的荸荠皮黄酮。
2.1.6梯度洗脱结果
等度洗脱大孔树脂所得黄酮的纯度低,改用梯度洗脱纯化。梯度洗脱液经浓缩后,测定所得组分的黄酮含量,用回收率表示,结果见表2。

表2 梯度洗脱结果Table 2The results for gradient elution for flavonoids
由表2可知,大部分黄酮集中在50%乙醇洗脱液中,黄酮回收率为50.07%,其质量为0.25 g,黄酮纯度为70.52%;30%乙醇次之,回收率为18.42%,其质量为0.18 g,黄酮纯度为35.13%。将黄酮纯度高的部分合并,获得黄酮产品0.25 g,回收率为58.52%,纯度为70.64%。可见,梯度洗脱时用极性大的洗脱剂,将极性大的糖类物质除去,改用最大解吸率的洗脱剂,能获得纯度高的荸荠皮总黄酮。梯度洗脱,能有针对性地分离不同极性的黄酮,对研究总黄酮的成分和性质、提高黄酮的品质及其开发应用有很大的帮助。
2.2抗氧化活性测定结果
抗氧化活性测定结果见表3。

表3 抗氧化活性试验结果Table 3The results of antioxidant activities assay
2.2.1ABTS·+阳离子自由基清除活性
ABTS·+阳离子自由基在溶液中与抗氧化剂反应迅速,适用于pH范围大的溶液中,且ABTS·+活性测试发生在多种介质中,可测定水溶性、脂溶性的提取物、天然纯化合物和合成的抗氧化剂[11]。荸荠皮提取物和总黄酮的IC50分别为26.24 mg/L和5.89 mg/L,其Trolox当量分别为0.42 mmolTE/g和1.86 mmolTE/g(见表3)。纯化后荸荠皮总黄酮的清除ABTS的能力是纯化前的4.43倍,大于Trolox和芦丁的清除能力,具有较强的ABTS自由基清除活性。
2.2.2DPPH自由基清除活性
DPPH离子在溶液中稳定,反应快速,是通过测定溶液中吸光度的减少来获得抗氧化剂的清除活性,经常用于测定经典抗氧化剂的清除自由基活性[12]。荸荠皮提取物和总黄酮的IC50分别为112.2mg/L和13.08mg/L,其Trolox当量分别为0.058 mmolTE/g和0.49 mmolTE/g(见表3)。总黄酮纯化后清除DPPH的能力大于芦丁的,比Trolox的小,为强的抗氧化剂。
2.2.3还原能力
硫氰化钾还原法用于测定抗氧化剂的总还原能力。K3Fe(CN)6络合物中的Fe3+经抗氧化剂还原,转化为Fe2+的形式,形成布鲁士兰,在700 nm有最大吸收[13]。0.2 mg/mL的荸荠皮提取液和总黄酮的吸光度分别为0.18和0.47,其Trolox当量分别为0.20 mmolTE/g和0.60 mmolTE/g(见表3)。经纯化后,总黄酮的还原能力有较大的提高,具有很强的抗氧化还原能力。
3 结论
通过大孔树脂纯化荸荠皮总黄酮,获得纯度高、抗氧化活性好的黄酮,收率为58.52%。荸荠皮总黄酮经纯化后,抗氧化能力有大幅提高,具有强的还原氧化能力和清除ABTS和DPPH自由基活性。荸荠皮富含不同种类的黄酮化合物,这是由于这些化合物良好的抗氧化能力及其之间的协同作用,使荸荠能防御因氧化剂引起的机体损伤[14]。将荸荠皮黄酮开发成为食品添加剂应用于食品加工,其产品将使人们更容易获得日常摄入量的天然抗氧化剂来抵抗由自由基引起的相关疾病[15]。在国内,荸荠淀粉和罐头的需求越来越大,其附属的副产品荸荠皮更容易获得,大量废弃的荸荠皮本身是一种资源的浪费。因此,开发和生产荸荠皮黄酮相关的产品,将使人们更易获得健康的天然抗氧化剂成为可能。
[1]国家中医药管理局.中华本草(24卷)[M].上海:上海科学技术出版社,1999:566-568
[2]Luo Y H,Li X R,He J,et al.Isolation,characterisation,and antioxidant activities of flavonoids from chufa(Eleocharis tuberosa)peels[J].Food Chemistry,2014,164(1):30-35
[3]李行任,罗杨合,何隽,等.荸荠皮酚性成分及其抗氧化活性研究[J].天然产物研究与开发,2013,25(12):1615-1620
[4]刘晓艳,张伟良,陈海光,等.荸荠皮中黄酮物质的提取及抑菌特性研究[J].广东农业科学,2012(16):109-112
[5]郭艳华,胡思前.荸荠皮提取物的抗氧化活性研究[J].食品与发酵工业,2007,33(10):128-130
[6]罗杨合,韦学丰,解庆林.可见分光光度法测定马蹄皮中总黄酮的含量[J].食品研究与开发,2009,30(6):135-138
[7]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology Medicine,1999,26(9/10):1231-1237
[8]Ssherer R and Godoy H T.Antioxidant activity index(AAI)by the 2,2-diphenyl-1-picryl-hydrazyl method[J].Food Chemistry,2009,112:654-658
[9]Li X,Zhang J Y,Gao W Y,et al.Chemical composition and anti-inflammatory and antioxidant activities of eight pear cultivars[J].Journal of Agricultural and Food Chemistry,2012,60:8738-8744.
[10]李稳宏,唐璇,李新生,等.黄姜黄色素在大孔树脂上的吸附动力学研究[J].离子交换与吸附,2008,24(6):526-534
[11]Awika J M,Rooney L W,Wu X,et al.Screening methods to measure antioxidant activity of sorghum(Sorghum bicolor)and sorghum products[J].Journal of Agricultural and Food Chemistry,2003,51,6657-6662
[12]Nenadis N and Tsimidou M.Observations on the estimation of scavenging activity of phenolic compounds using rapid 1,1-diphenyl-2-picrylhydrazyl(DPPH·)tests[J].Journal of the American Oil Chemists'Society,2002,79(12):1191-1195
[13]Tian L,Zhao Y,Guo C,et al.A comparative study on the antioxidant activities of an acidic polysaccharide and various solvent extracts derived from herbal Houttuynia cordata[J].Carbohydrate Polymers,2011,83:537-544
[14]Hirano R,Sasamoto W,Matsumoto A,et al.Antioxidant ability of various flavonoids against DPPH radicals and LDL oxidation[J]. Journal of Nutritional Science and Vitaminology,2001,47:357-362
[15]Hu C and Kitts D D.Free radical scavenging capacity as related to antioxidant activity and ginsenoside composition of Asian and North American ginseng extracts[J].Journal of the American Oil Chemists' Society,2001,78(3):249-255
Purification and Antioxidant Activities of Total Flavonoids from Chufa(Eleocharis tuberosa)Peels
LI Xing-ren,LUO Yang-he*,WEI Lin,WEI Xue-feng,GAO Zhi-ming
(Guangxi Colleges and Universities Key Laboratory of Characteristic Resources Development and Utilization Research in East Guangxi,Hezhou University,Hezhou 542899,Guangxi,China)
Total flavonoids form chufa(Eleocharis tuberosa)peels were purified by macroporous adsorption resin,their antioxidant activities were evaluated by reducing power assay,ABTS assay and DPPH assay.The fine flavonoids with high purity and strong antioxidant activities were obtained using the D101 macroporous resin washed with gradient aqueous ethanol.The yield of flavonoids was 58.52%,and the purity was 70.64%.The purified flavonoids showed very strong reducing power,which was 0.60 mmol TE/g,and strong free radical scavenging activities against ABTS·+and DPPH,the IC50of which were 1.86 and 0.49 mmolTE/g.Their scavenging ABTS·+capacities were stronger than those of Trolox and rutin,and scavenging DPPH activities were stronger than that of rutin at the same concentrations.
chufa peels;total flavonoids;purification;macroporous adsorption resin;antioxidant activities
10.3969/j.issn.1005-6521.2015.13.001
2014-01-22
国家自然科学基金(21365011);广西自然科学基金(2011GXNSFB018024);广西高校重点资助科研项目(201202ZD092);广西科学研究与技术开发计划项目(桂科攻,11107010-3-9);广西高校科研项目(2013ZL086、YB2014372)
李行任(1982—),男(汉),助理研究员,硕士,从事天然产物的研究与开发。
