SDS/正辛醇/异辛烷反胶束体系萃取葵花籽粕蛋白工艺研究
2015-10-24郭求实
赵 萍,佐 玲,郭求实,王 雅
(兰州理工大学生命科学与工程学院,甘肃兰州730050)
SDS/正辛醇/异辛烷反胶束体系萃取葵花籽粕蛋白工艺研究
赵 萍,佐 玲,郭求实,王 雅*
(兰州理工大学生命科学与工程学院,甘肃兰州730050)
利用SDS(十二烷基磺酸钠)/正辛醇/异辛烷反胶束体系对葵花籽粕蛋白进行萃取,探讨在超声辅助萃取下,W0、缓冲液pH、缓冲液浓度、料液比(g/mL)、温度、时间以及表面活性剂浓度等对蛋白质前萃取率以及后萃取率的影响。结果表明:前萃取工艺的最佳条件SDS浓度为0.07g/mL,料液比为1∶25,盐浓度为0.07mol/L,pH为6.5,W0=27,萃取时间为35min,温度为40℃;后萃取最佳工艺条件为:盐浓度为0.9mol/L、缓冲液pH为7.5、萃取时间为45min、萃取温度为35℃,在此条件下,蛋白质的前萃率为89.93%,后萃率为65.01%,蛋白质提取率为58.46%。
反胶束,葵花蛋白,前萃取,后萃取
葵花籽粕,也称为葵花粕,是葵花籽经预压榨或直接浸出法榨取油脂后的一种副产品,含有丰富的优质蛋白(29%~43%),其中球蛋白占55%~60%,清蛋白占17%~23%,谷蛋白占11%~17%,醇溶谷蛋白占1%~4%,是植物蛋白的重要来源之一[1]。葵花籽蛋白中氨基酸的组成,除赖氨酸的含量较低外,其余必需氨基酸均达到或高于联合国粮农组织推荐的标准[2]。但目前这些高营养价值的葵花籽粕利用率不高,通常主要用作牛的饲料以及其他家禽等的饲料,产品增值太低。反胶束是表面活性剂分散于连续有机相中而自发形成的纳米尺度的聚集体,源于20世纪70年代的液液萃取技术。在反胶束溶液中,表面活性剂的非极性基团在外,而极性基团则排列在内形成一个极性核,此极性核吸收水后形成“水池”,以W0表示其大小[3]。当反胶束溶液与含有蛋白质等组分的水溶液接触后,蛋白质及其他亲水性物质能够进入“水池”内(称为“前萃”),而与其他不能进入反胶束极性核的物质分离开来[4]。由于周围水层形成的水化膜和静电斥力的作用,保证了蛋白质的天然构象不被破坏。再将含有蛋白质的反胶束溶液与反萃取缓冲溶液混合,蛋白质转移到缓冲溶液中,然后将反胶束分离,最终从缓冲液中得到蛋白质(称为“后萃”)。反胶束萃取技术因其萃取率高,污染小,所用溶剂可以回收重复利用等优点日益受到广大学者的关注。目前,已有学者利用反胶束萃取技术进行大豆蛋白[5]、玉米胚芽蛋白[6]、花生蛋白[7]、杏仁蛋白[8]等植物蛋白提取的研究,但多集中于前萃取过程,后萃取过程鲜有研究。
因此,本文利用SDS(十二烷基磺酸钠)/正辛醇/异辛烷反胶束体系对葵花粕蛋白进行萃取研究,讨论了在超声辅助萃取下,W0、缓冲液pH、盐浓度、料液比、温度、时间以及表面活性剂浓度等因素对前萃取率以及后萃取率的影响,实现了葵花粕中蛋白质的萃取,并试图找到其最佳提取工艺,从而为葵花粕的深加工提供理论依据。
1 材料与方法
1.1 材料与仪器
葵花粕 甘肃敬业科技有限公司提供;SDS(十二烷基磺酸钠)、异辛烷、正辛醇、氯化钾、磷酸二氢钾、磷酸氢二钠、磷酸二氢钠、卡尔费休试剂、硫酸铜(CuSO4·5H2O)、硼酸、氢氧化钠、浓硫酸、甲基红指示剂、溴甲酚绿指示剂、无水乙醇 均为分析纯。
JY99-IIDN超声波细胞破碎仪 宁波新芝生物科技股份有限公司;RE52-86A旋转蒸发仪 上海亚荣生化仪器厂;CJJ78-1磁力搅拌器 上海梅香仪器有限公司;HH-4数显恒温水浴锅 国华电器有限公司;TC16-WS高速离心机 长沙相依离心机有限公司;PHB-5型便携式酸度计 中国杭州雷磁分析仪器厂;KLS-411型微量水份分析仪 上海精密科学仪器有限公司;FA2004电子天平 上海良平仪器仪表有限公司;101-2A电热鼓风干燥箱 北京科伟永兴仪器有限公司;CHA-S/SH 2-82气浴恒温振荡培养器 常州国华电器有限公司。
1.2 实验方法
1.2.1 原料中蛋白质和水分含量测定 水分测定:GB 5009.6-2010;粗蛋白测定:GB 5009.5-2010。
1.2.2 反胶束溶液的配制 称取一定量的表面活性剂SDS,置于250m L烧杯中,同时加入有机溶剂正辛醇/异辛烷(体积比为1∶4),并加入含有一定浓度KCl的KH2PO4-Na2HPO4(可配制成不同pH)磷酸盐缓冲溶液,磁力搅拌至SDS完全溶解,室温静置至溶液澄清透明即为反胶束溶液[9]。
1.2.3 反胶束溶液中含水量测定 采用卡尔费休法测定含水量(W0),W0=反胶束溶液中水的摩尔浓度/反胶束溶液中表面活性剂的摩尔浓度。
1.2.4 蛋白质前萃实验 分别称取不同质量SDS(4、6、7、8、9、10g),置于250m L烧杯中,同时加入有机溶剂正辛醇/异辛烷(体积比为1∶4)100m L,并加入不同浓度(0.04、0.05、0.06、0.08、0.10、0.12mol/L)不同pH的含KCl的KH2PO4-Na2HPO4缓冲溶液(pH=6、6.5、7、7.5、8、8.5)以控制含水量W0(22、23、24、25、26、27),增溶水后取上述配制的SDS/正辛醇/异辛烷反胶束溶液按不同料液比(1∶5、1∶10、1∶15、1∶20、1∶25、1∶30)加入葵花粕(精确到0.0001g),超声(300W)辅助萃取10m in后转移至恒温水浴锅中以不同温度(25、30、35、40、45、50℃)继续萃取不同时间(20、30、40、50、60、70m in),然后以4000r/m in离心分离10m in,萃取体系分为两层,凯氏定氮法测定上层溶液萃取的蛋白含量,计算蛋白质的前萃取率[10]。
蛋白质前萃率(R,%)=(上层溶液蛋白质的含量/原料中蛋白质含量)×100
每次单因素实验时依次仅改变一个变量,依次改变反胶团含水量W0、表面活性剂浓度、料液比、温度、缓冲液pH、盐浓度、时间进行单因素实验。并根据单因素结果选取4因素3水平进行正交实验,因素水平表如表1所示。

表1 前萃取因素水平表Table 1 Factors and levels of forward extraction orthogonal test
1.2.5 蛋白质后萃实验 将20m L前萃液加入等体积的不同浓度(0.6、0.8、1.0、1.2、1.4mol/L)的KCl的缓冲溶液(NaH2PO4-Na2HPO4配制)(pH=6.5、7、7.5、8、8.5、9.0),在恒温振荡培养器中以不同温度(25、30、35、40、45、50℃)相同速度振荡不同时间(30、40、50、60、70、80min)。然后将上述溶液置于离心机中,在4000r/m in下离心10m in,分液漏斗分层后取下层水相凯氏定氮法测定蛋白质含量[11]。
蛋白质后萃率(R,%)=(水相中蛋白质含量/反胶束溶液中蛋白质含量)×100
蛋白质总提取率(%)=(前萃率×后萃率)×100
每次单因素实验时依次仅改变一个变量,实验时依次改变盐浓度、缓冲液pH、时间、温度进行单因素实验。并根据单因素结果选取4因素3水平进行正交实验,因素水平表如表2所示。
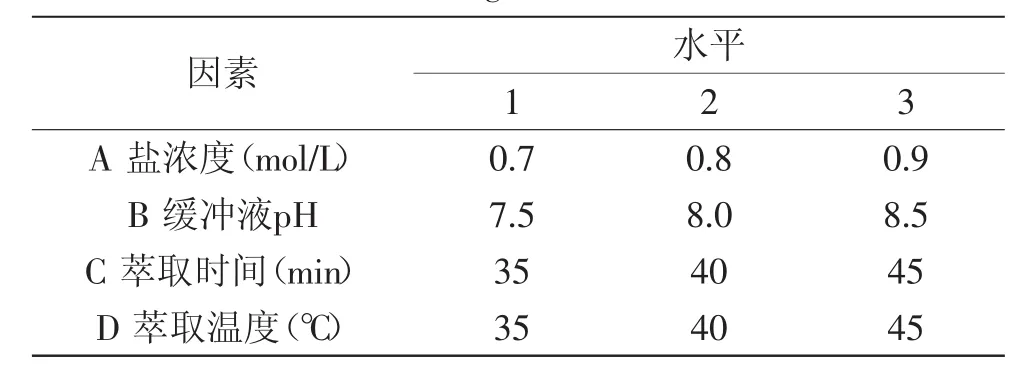
表2 后萃取因素水平表Table 2 Factors and levels of backward extraction orthogonal test
1.3 数据分析
数据分析采用SPSS 17.0软件进行分析。
2 结果与讨论
经测定,葵花粕原料中蛋白质和水分含量分别为42.67%、3.84%。
2.1 葵花蛋白前萃实验
2.1.1 W0对蛋白质前萃率的影响 由图1可以看出,随着W0的增大,蛋白质的前萃率呈现先增大后减小的趋势,当W0达到26时,前萃率达到最大值。W0的增大意味着反胶团直径的增大,当反胶团直径与蛋白质大小近似时,蛋白质才可以增溶到反胶团中,实现蛋白质的萃取[12]。因此,本实验选取W0=26进行后续实验。

图1 W0对前萃率的影响Fig.1 The effect ofW0on forward extraction rate
2.1.2 SDS浓度对蛋白质前萃率的影响 如图2所示,随着SDS浓度的增加,蛋白质的萃取率也随之增加,当达到0.08g/m L时达到最大值。这是因为在非极性溶剂中单位体积内表面活性剂所形成的反胶团数量越多,就可以萃取更多的蛋白质,并且SDS浓度的增加会使整个体系极性增加,致使反胶团与蛋白质分子间作用力增强,利于蛋白质的吸附。由图2可以看出,当SDS浓度为0.08g/m L时,蛋白质萃取率达到最大值。故选取SDS浓度为0.08g/m L。
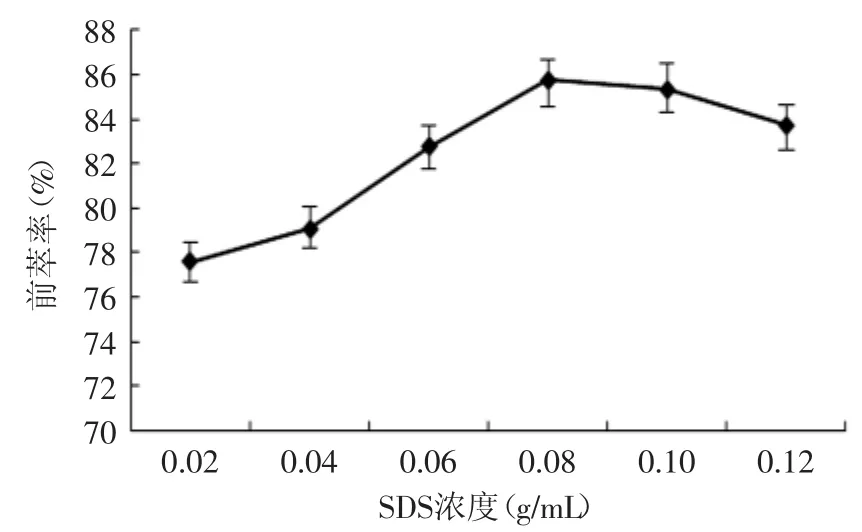
图2 SDS浓度对前萃率的影响Fig.2 The effect of SDS concentration on forward extraction rate
2.1.3 料液比对蛋白质前萃率的影响 图3所示为料液比对蛋白质前萃率的影响,随着料液比从1∶5变化到1∶25,蛋白质萃取率呈增长趋势,1∶25时达到最大值而后又呈现减小趋势。其原因可能是:当一定体积的反胶束溶液萃取蛋白质达到饱和后,剩余溶液中的蛋白质会破坏已稳定的反胶团-蛋白质体系,导致萃取率下降。由此也可以看出一定体积的反胶束溶液可萃取的蛋白质是有限的。故选取料液比1∶25为宜,这与郭晓歌、赵俊廷等研究结果相符合[3-4]。
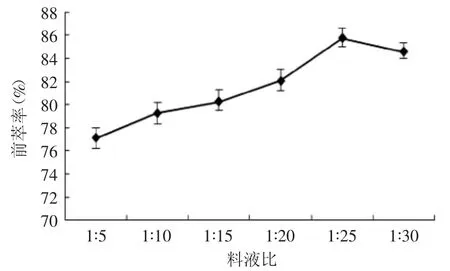
图3 料液比对前萃率的影响Fig.3 The effect of solid-liquid ratio on forward extraction rate
2.1.4 温度对蛋白质前萃率的影响 由图4所示,随着温度的升高,蛋白质萃取率逐渐增大,直到40℃后逐渐减小。伴随着温度的升高,分子运动加快,蛋白质的萃取速率也加快,但过高的温度,会导致反胶束-蛋白质体系的破坏。另一种解释为,随着温度的升高,反胶团内增溶的水含量变多,反胶团增溶水能力的增加将会导致蛋白质溶解于反胶团能力的增加,因为蛋白质进入反胶团的过程是伴随着水包围在蛋白质外层[13],因此温度选取为40℃。
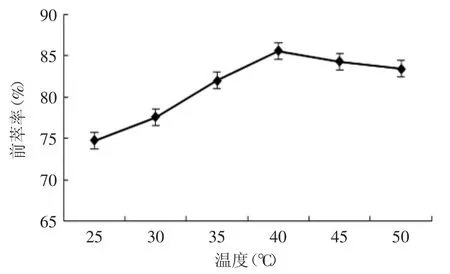
图4 温度对前萃率的影响Fig.4 The effect of temperature on forward extraction rate
2.1.5 缓冲液pH对蛋白质前萃率的影响 图5所示为缓冲液pH对前萃率的影响,随着缓冲液pH的增加,蛋白质的萃取率呈现先增加后减小的趋势,当pH=6.5时,前萃率最大。缓冲溶液的pH影响蛋白进入反胶团主要因为它改变了蛋白质分子表面的电荷分配。葵花蛋白p I=4.0,当体系pH大于葵花蛋白质等电点时,蛋白质带负电,此时静电作用不足以使蛋白质进入到反胶团中[14],则可能是离子交换机理和蛋白质的疏水性起主导作用。因此pH逐渐增大,蛋白质萃取率逐渐减小,所以pH=6.5较适宜。
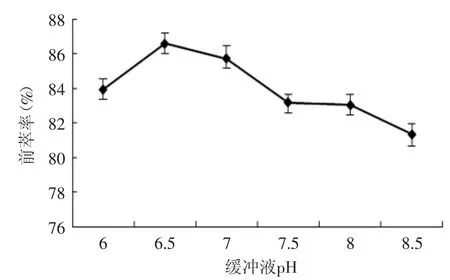
图5 缓冲液pH对前萃率的影响Fig.5 The effect of buffer pH on forward extraction rate
2.1.6 盐浓度对蛋白质前萃率的影响 如图6所示,蛋白质的前萃率随着盐浓度的增加而增加,直到盐浓度达到0.08mol/L达到最大值,随后逐渐减小。盐浓度影响了蛋白质进入反胶束的传质过程,因为缓冲液中盐的浓度影响反胶团的尺寸同时影响蛋白质和反胶团之间的静电作用[15]。当浓度超过0.08mol/L后,伴随着盐浓度的不断增加,前萃率减小这是因为产生了“屏蔽效应”而使静电相互作用减弱,从而抑制了蛋白质和水的的增溶[13],因此盐浓度选取0.08mol/L较好。
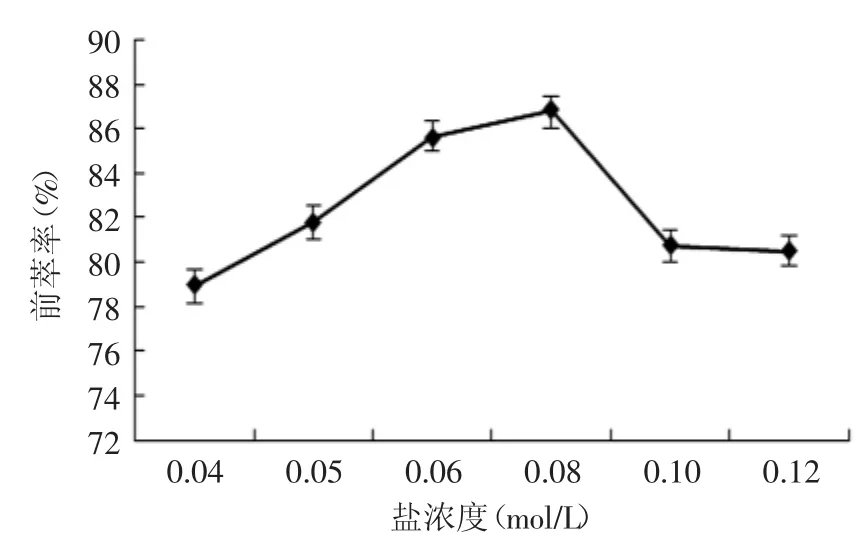
图6 盐浓度对前萃率的影响Fig.6 The effect of buffer concentration on forward extraction rate
2.1.7 时间对蛋白质前萃率的影响 图7为萃取时间对前萃率的影响曲线,30m in时萃取率最大,这说明SDS/正辛醇/异辛烷体系萃取葵花蛋白达到最大萃取效果的时间较短。萃取时间从30~80m in时,随着萃取时间的增加,萃取率有所下降,这可能是因为随着萃取的进行,增溶到反胶团中的蛋白质达到饱和,随着时间的继续增加,反胶团由于离子强度等因素影响而发生了渗滤现象,使反胶团结构破坏,导致提取率下降,故选取萃取时间为30m in。
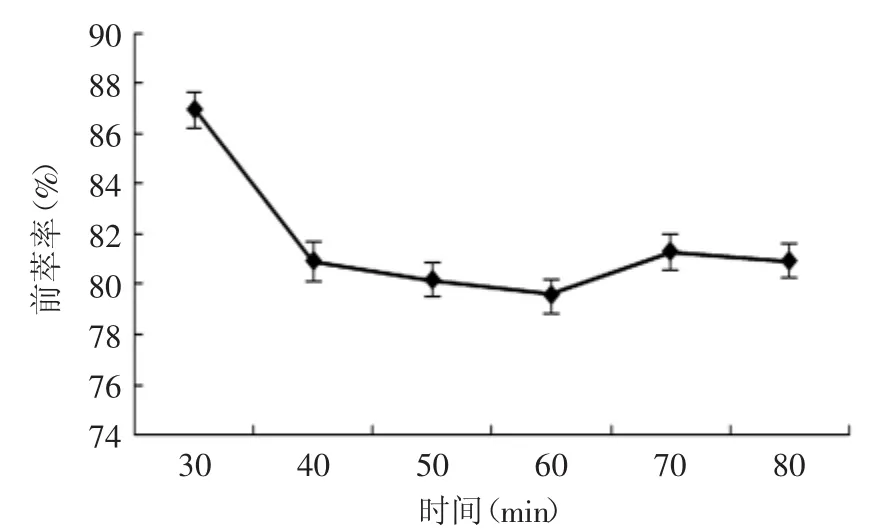
图7 萃取时间对前萃率的影响Fig.7 The effect of extraction time on forward extraction rate
2.1.8 前萃正交实验 根据前萃单因素实验分析结果,选取4个主要因素进行4因素3水平正交实验,结果见表3。
根据表3对所得数据进行直观极差分析,由R值的大小我们可以看出,对前萃率影响由大到小的因素为:B>D>C>A,即影响因素从主到次为:缓冲液浓度>萃取时间>W0>SDS浓度,由k值可以得出最佳提取条件为:A1B1C3D3,即SDS浓度为0.07g/m L、盐浓度为0.07mol/L、W0=27、萃取时间为35m in的条件为最佳提取条件。在此最佳条件下,进行验证实验,蛋白质的前萃率为89.93%,高于表中其他组合的前萃率。由表4可以看出,当用离均差平方和最小项W0作为误差来检验其他因素对前萃取率作用的显著性时,SDS浓度、萃取时间对前萃取率影响均显著。
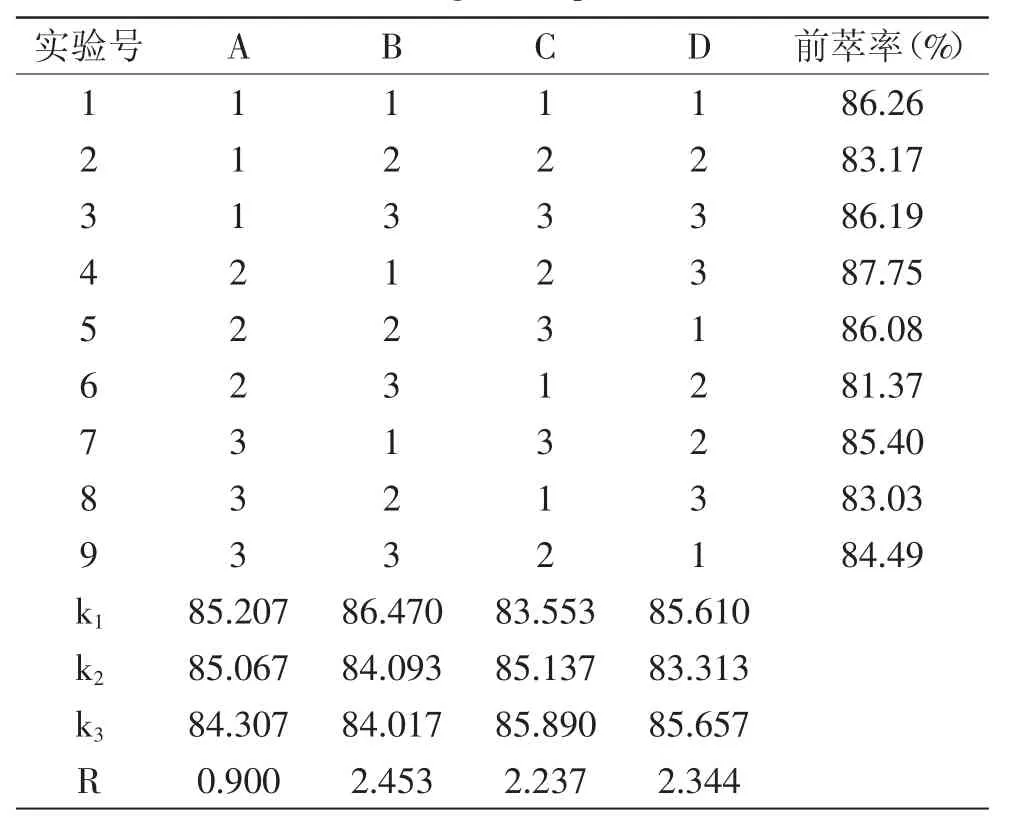
表3 正交试验表Table 3 Orthogonal experiment table
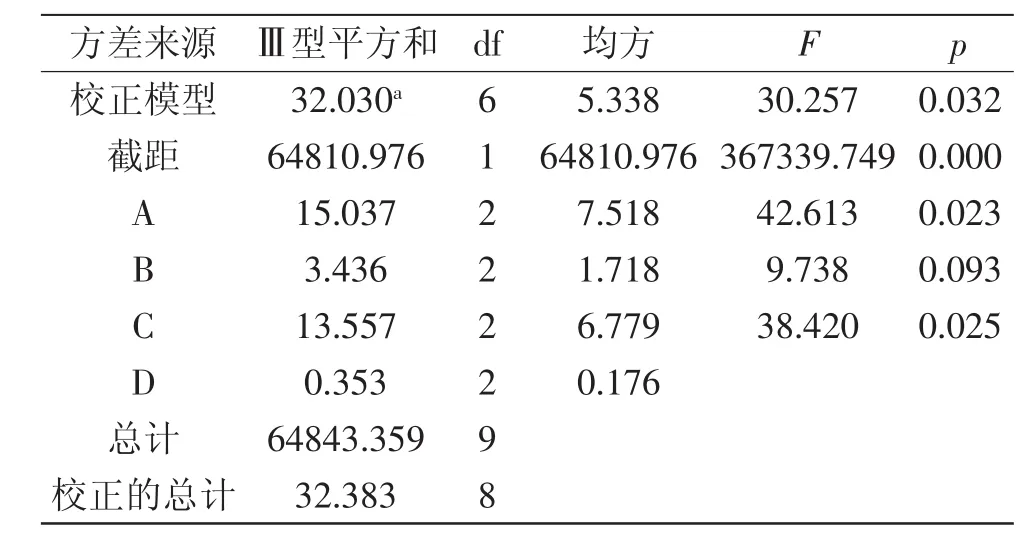
表4 前萃正交试验方差分析Table 4 Significant analysis on forward extraction orthogonal test
2.2 葵花蛋白后萃实验
2.2.1 盐浓度对蛋白质后萃率的影响 由图8可以看出,随着盐浓度的增大,蛋白质的后萃率在盐浓度为0.8mol/L时达到最大值,随后先增大后减小。这是因为随着盐浓度的增加,反胶团增容量逐渐减小,蛋白质随着反胶团增容量的减小而逐渐溶出。同时,由于蛋白质不断溶出到后萃水相体系中,致使反胶束“水池”中与水相中蛋白质形成浓度差,不断促进蛋白质反萃取到水相中,因此在盐浓度未达到0.8mol/L时,蛋白质后萃率逐渐增大。但当浓度过高时,蛋白质会由于盐析作用致使后萃率趋于减小[16]。因此本实验选取盐浓度为0.8mol/L进行后续实验。
2.2.2 缓冲液pH对蛋白质后萃率的影响 如图9所示,随着缓冲液pH的增加,蛋白质的萃取率也随之增加,当pH达到8时为最大值。这是由于随着pH的不断增加,蛋白质表面电荷量增加,并且与反胶束表面所带电荷同性。因此,随着pH的增加,静电斥力不断增大,蛋白质在反胶束中的增溶逐渐减小,蛋白质的后萃率也随之增大。故选取pH=8进行后续实验。

图8 盐浓度对后萃率的影响Fig.8 The effect of salt concentration on backward extraction rate
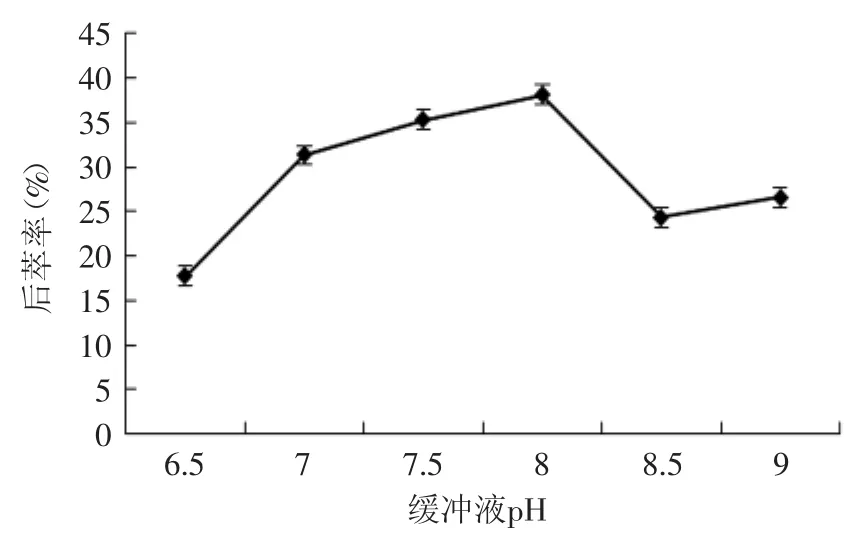
图9 缓冲液pH对后萃率的影响Fig.9 The effect of buffer pH on backward extraction rate
2.2.3 时间对蛋白质后萃率的影响 图10所示为时间对蛋白质后萃率的影响,随着时间从30m in增加到40m in,蛋白质后萃取率呈增长趋势,40m in时达到最大值而后呈现减小趋势。其原因可能是:当体积一定时反胶束后萃溶液萃取蛋白质的能力是有限的,因此即使时间延长,蛋白质的后萃取量也不会再增加。40m in后,蛋白质后萃取率呈现略微减小后趋于平稳的趋势,故选取后萃取时间为40m in为宜。

图10 时间对后萃率的影响Fig.10 The effect of time on backward extraction rate
2.2.4 温度对蛋白质后萃率的影响 由图11所示,随着温度从25℃上升到40℃,蛋白质后萃取率逐渐增大,直到40℃后逐渐减小。这是因为伴随着温度的升高,反胶团增溶能力逐渐减小,分子运动加快,蛋白质不断被释放出来进入后萃水相体系中,因此蛋白质的后萃取率增加。因此选取温度为40℃。
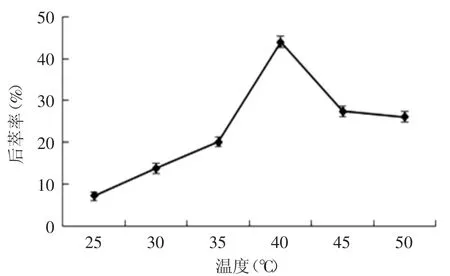
图11 温度对后萃率的影响Fig.11 The effect of temperature on backward extraction rate
2.2.5 后萃正交实验 根据后萃单因素实验分析结果,选取4个因素进行4因素3水平正交实验,结果见表5。
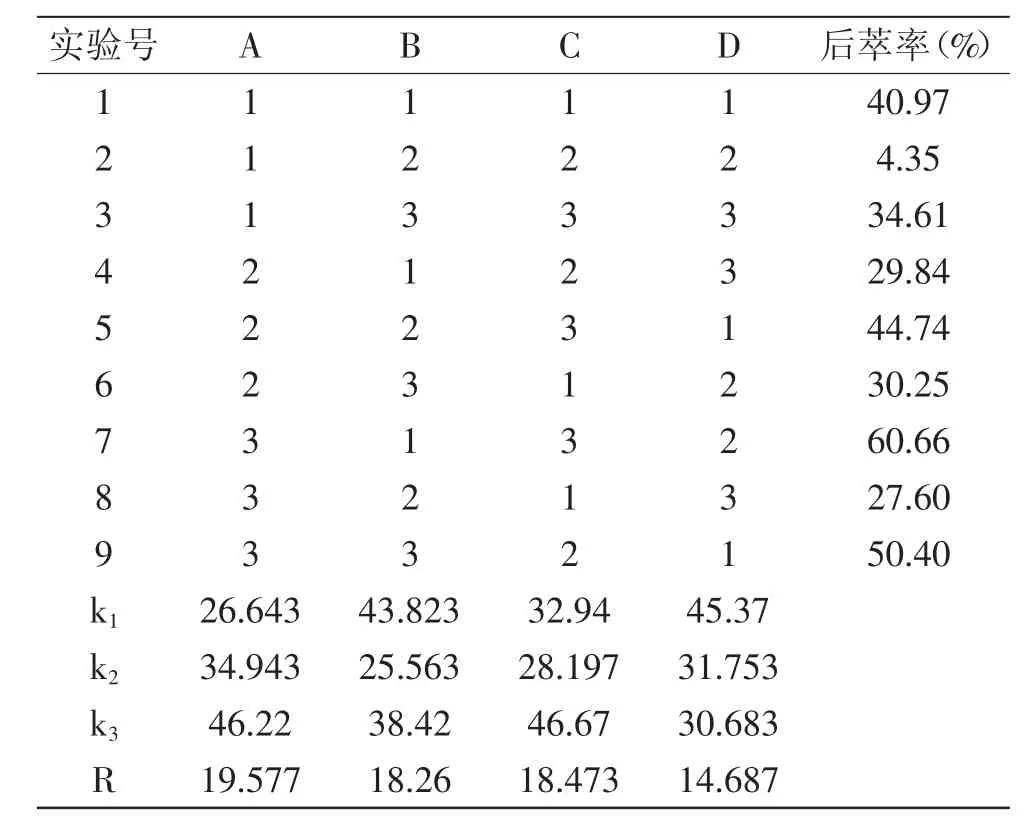
表5 正交实验表Table 5 Orthogonal experiment table
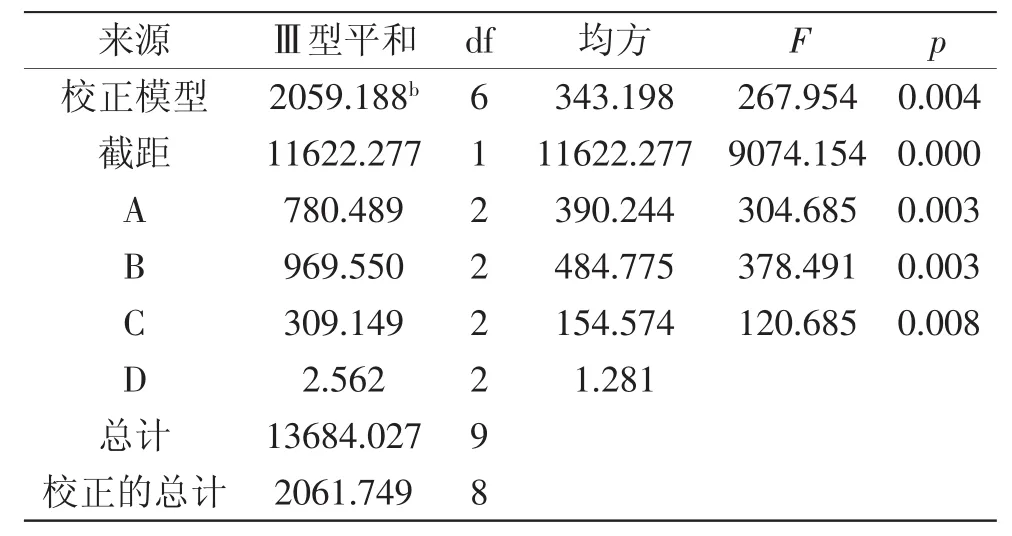
表6 后萃正交试验方差分析Table 6 Significant analysis of backward extraction orthogonal test
根据表5对所得数据进行直观极差分析,由R值的大小我们可以看出,对葵花蛋白后萃率影响由大到小的因素为:A>C>B>D,即影响因素从主到次为:盐浓度>萃取时间>缓冲液pH>萃取温度,由k值可以得出最佳提取条件为:A3B1C3D1,即盐浓度为0.9mol/L、缓冲液pH为7.5、萃取时间为45m in、萃取温度为35℃的条件为最佳提取条件。在此最佳条件下,进行验证实验,葵花蛋白的后萃率为65.01%,高于表中其他组合的后萃率。由表6可以看出,当用离均差平方和最小项萃取时间作为误差估计来检验其他因素作用的显著性时,盐浓度、缓冲液pH、萃取温度三个因素对后萃取率影响均极显著。根据1.2.5中公式计算可得,蛋白质的提取率为58.46%。
3 结论
通过对SDS(十二烷基磺酸钠)/正辛醇/异辛烷反胶束体系对葵花粕蛋白前萃单因素及正交实验得到SDS浓度为0.07g/m L、料液比(g/m L)为1∶25、盐浓度为0.07mol/L、W0=27、萃取时间为35min、萃取温度为40℃、缓冲液pH为6.5的条件为最佳提取条件。在此最佳条件下,蛋白质的前萃率为89.93%。通过对SDS/正辛醇/异辛烷反胶束体系对葵花粕蛋白后萃单因素及正交实验得到盐浓度为0.9mol/L、缓冲液pH为7.5、萃取时间为45min、萃取温度为35℃的条件为最佳提取条件。在此最佳条件下,蛋白质的后萃率为65.01%,蛋白质提取率为58.46%。
[1]ShahidiF,Han X,Synowiecki J.Production and characteristics of protein hydrolysates from capelin(Mallotus villosus)[J].Food Chemistry,1995,53(3):285-293.
[2]陈彦.葵花籽分离蛋白的制取工艺[J].中外技术情报,1995(1):45.
[3]赵晓燕,薛文通,陈复生,等.影响反胶束体系萃取蛋白能力的因素及机理[J].农业工程学报,2009(11):354-360.
[4]郭晓歌,赵俊廷.反胶束体系萃取葵花籽仁中蛋白质的研究[J].食品工业科技,2008(4):185-188.
[5]赵晓燕.反胶束萃取大豆蛋白质结构与特性研究[D].北京:中国农业大学,2007.
[6]李飞,朱科学,周惠明,等.反胶束法同时提取玉米胚芽中蛋白质和油脂的前萃工艺研究[J].中国油脂,2009(11):27-30.
[7]孙秀平,陈军,陈锋亮,等.不同反胶束体系对萃取花生蛋白的影响[J].食品科技,2012(1):164-168.
[8]孙晓宏,朱科学,周惠明.反胶束法提取小麦胚芽蛋白前萃工艺的优化[J].中国粮油学报,2008(4):38-42.
[9]赵俊廷.反胶束溶液同时萃取油和蛋白质的工艺研究[J].郑州工业大学学报,2001(2):54-56.
[10]陈复生,程小丽,李里特,等.超声波技术在SDS反胶束萃取中的应用研究[J].中国食品添加剂,2010(3):147-153.
[11]张洁,陈复生,赵俊廷.SDS/正辛醇/异辛烷反胶束体系后萃大豆蛋白的研究[J].食品科学,2005(S1):222-226.
[12]Cöklen K E,Hatton T A.Protein Extraction Using Reverse Micelles[J].Biotechnology Progress,1985,1(1):69-74.
[13]NoritomiH,Kojima N,Kato S,etal.How can temperature affect reverse micellar extraction using sucrose fatty acid ester[J]. Colloid and Polymer Science,2006,284(6):683-687.
[14]Adachi M,Harada M.Solubilization mechanism of cytochrome c in sodium bis(2-ethylhexyl)sulfosuccinate water/ oilmicroemulsion[J].The Journal of Physical Chemistry,1993,97(14):3631-3640.
[15]Andrews B A,Haywood K.Effect of pH,ion type and ionic strength on partitioning of proteins in reverse micelle systems[J]. Journal of Chromatography A,1994,668(1):55-60.
[16]陈茂深,朱科学.反胶束法提取花生蛋白后萃工艺的优化[J].中国油脂,2010(1):24-27.
SDS/isooctane/octanol reverse micellar extraction process of sunflower seed meal protein
ZHAO Ping,ZUO Ling,GUO Qiu-shi,WANG Ya*
(College of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China)
Using reverse micelles of SDS(Sodium dodecyl sulfate)/isooctane/octanol extraction of sunflower seed protein,discussed in the ultrasound assisted extraction,study effect of W0,buffer pH,buffer concentration,solid-liquid ratio,temperature,time and surfactant concentration on the extraction rate of protein forward and backward extraction.The results showed that:the optimum conditions of forward extraction process for the concentration of SDS was 0.07g/m L,the ratio of material to liquid was 1∶25(g/m L),buffer concentration of 0.07mol/L,pH6.5,W0=27,extraction time was 35m in,temperature was 40℃ condition for.Backward extraction optimum conditions were:the salt concentration was 0.9mol/L,pH value of buffer solution was 7.5,extraction time was 45m in,the extraction tem perature was 35℃,under these conditions,the forward extraction rate of protein was 89.93%,backward extraction rate was 65.01%,the total extraction rate of protein was 58.46%.
reverse micelle;sunflower protein;forward extraction;backward extraction
TS201.1
B
1002-0306(2015)08-0262-06
10.13386/j.issn1002-0306.2015.08.046
2014-07-21
赵萍(1964-),女,硕士,教授,主要从事食品科学、农产品加工与副产物综合利用方面的研究。
*通讯作者:王雅(1974-),女,博士,副教授,主要从事功能食品生物工程方面的研究。
甘肃省重点培育学科资助。
