超声辅助提取对蓝莓花青素提取率、抗氧化活性及化学组成的影响
2015-10-24罗水忠潘利华
罗水忠,潘利华
(1.合肥工业大学生物与食品工程学院,安徽合肥230009;2.安徽省农产品精深加工重点实验室,安徽合肥230009)
超声辅助提取对蓝莓花青素提取率、抗氧化活性及化学组成的影响
罗水忠1,2,潘利华1,*
(1.合肥工业大学生物与食品工程学院,安徽合肥230009;2.安徽省农产品精深加工重点实验室,安徽合肥230009)
采用Box-Behnken设计实验分析超声辅助提取工艺参数对蓝莓花青素的提取率和抗氧化活性的影响,并通过HPLC-ESI-MS法分析超声辅助溶剂浸提对蓝莓花青素化学组成的影响。结果表明:提取率与抗氧化活性的最显著影响因子、最佳工艺参数及回归模型并不相同;提取率的最显著影响因子为超声温度和超声功率强度,最适条件为超声温度39℃、超声功率强度490W、超声pH3.5、超声时间45min;而DPPH·清除率的最显著影响因子为超声时间,最适条件为超声温度45℃、超声功率强度450W、超声pH3.1、超声时间37min;与溶剂浸提法相比,超声辅助溶剂浸提法缩短了浸提时间,但没有改变其化学组成,两种方法都获得11种花青素糖苷。
蓝莓,花青素,溶剂浸提,超声辅助浸提
蓝莓果实中花青素含量高于其他所有水果与蔬菜,因此,蓝莓果为天然花青素的提取提供了优良资源。蓝莓花青素由矢车菊色素、飞燕草色素、锦葵色素、芍药色素、牵牛花色素等5种花青素苷元(anthocyadin),以及它们各自与葡萄糖、乙酰葡萄糖、半乳糖、乙酰半乳糖、阿拉伯糖、乙酰阿拉伯糖连接形成的花青素糖苷(anthocyanin)所组成[1-2],具有抗氧化、改善视力等多种生理功能[3]。为此,蓝莓花青素的提取备受关注。当前,蓝莓花青素的提取通常采用乙醇溶剂浸提法或超声波、微波、超临界流体等辅助乙醇溶剂提取法[4-6],其中,超声辅助溶剂提取法由于超声波的空化效应、热效应、机械效应等多种效应,在破坏细胞壁和细胞膜结构,增大物质分子运动频率和速度,增加溶剂穿透力,加速目标分子进入溶剂,提高提取率等方面优势突出[7]。但是,超声处理是否改变花青素的稳定性和生理活性仍有争议。Dubrovic等[8]发现,20℃超声处理草莓汁3~9m in,草莓花青素降解0.7%~4.4%;55℃超声处理9m in,草莓总花青素含量减少5.8%~7.1%;然而,Tiwari等[9]的研究则显示,超声处理对黑莓汁中的花青素没有显著影响。Flores等[10]研究发现,提取剂对蓝莓花青素的活性有影响,乙醇为提取剂时抗氧化活性较高而以丙酮为提取剂a-葡萄糖苷酶抑制活性较高。本文就超声辅助提取对蓝莓花青素的提取率、抗氧化活性及化学组成的影响开展研究,为超声辅助提取在蓝莓花青素的加工应用提供理论指导。
1 材料与方法
1.1 材料与设备
蓝莓 兔眼蓝莓巴尔德温栽培种冷藏鲜果,由安徽徽王食品有限公司惠赠;矢车菊素3-O-葡萄糖苷标准品(DPPH) Sigma公司产品;其他试剂 均为分析纯。
SY-1000E型多用途恒温超声提取器 北京弘祥隆生物技术开发有限公司;SHZCT15RT型高速冷冻离心机 上海天美科学仪器有限公司;Hei-VAP Advantage型旋转蒸发仪 德国Heidolph公司;V1100型可见光分光光度计 上海美谱达仪器有限公司;LGJ-18S型原位真空冷冻干燥机 北京松源华兴科技发展有限公司。
1.2 实验方法
1.2.1 蓝莓花青素的乙醇溶剂浸提过程 根据参考文献[11]获取蓝莓花青素粗提液,即称取500.0g干净、无腐烂的蓝莓鲜果,通过组织捣碎机捣碎成蓝莓浆,再置于提取瓶中,加入蓝莓浆8倍体积的pH3.0± 0.1的酸化乙醇提取剂(乙醇终体积分数75%)在(50± 0.5)℃、(150±5)r/min的条件浸提150m in,接着将浸提液在10000r/m in、4℃条件下离心10m in,取上清液得到蓝莓花青素粗提液;然后将蓝莓花青素粗提液通过AB-8树脂吸附,再用60%乙醇洗脱,收集乙醇洗脱流出液,50℃减压浓缩除去乙醇后冷冻干燥即得到花青素A。
1.2.2 蓝莓花青素的超声辅助乙醇溶剂浸提过程 按照1.2.1的方法准备蓝莓浆和提取剂,放入恒温超声提取器中,在参考文献[12]中单因素的实验结果的基础上,设定表1的超声温度、超声频率和超声功率强度条件超声提取一定时间后,将提取液按照1.2.1的方法离心,测定上清液中蓝莓花青素含量及DPPH·清除率;上清液按照1.2.1的方法纯化、减压浓缩、冷冻干燥即得到花青素B。
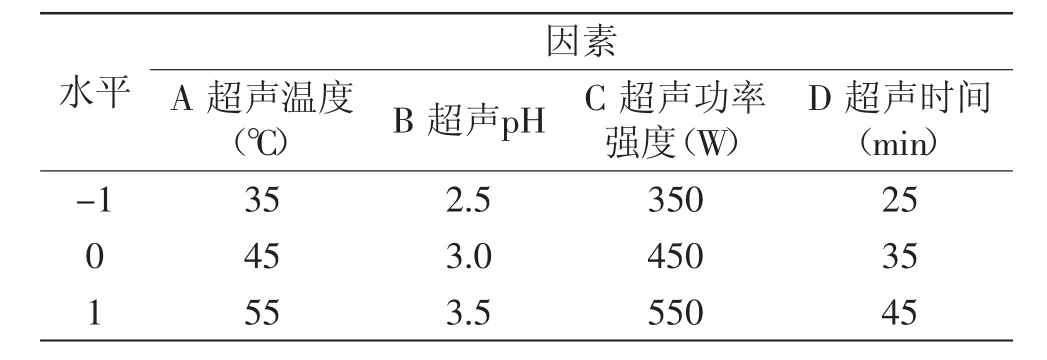
表1 Box-Behnken设计因素水平表Table 1 Factors and levers of Box-Behnken design
1.2.3 超声辅助提取工艺参数对蓝莓花青素提取率及抗氧化活性的影响 采用Box-Behnken设计方法,选取3个中心点进行27次实验(表1),测定每次实验中蓝莓花青素的提取率及DPPH·清除率,分析超声工艺参数对提取率及抗氧化活性的影响。蓝莓花青素含量的测定采用双波长pH示差法[13],以矢车菊素3-O-葡萄糖苷为参照,提取率(mg/g)以每g蓝莓干果中花青素(矢车菊素3-O-葡萄糖苷)的mg数表示。DPPH·清除率的测定参考Cui等[14]报道的方法进行,DPPH·清除率(%)=(A样品-A对照)×100/A空白;DPPH清除率越大,表示抗氧化活性越强,反之DPPH·清除率越小,表示抗氧化活性越弱。
1.2.4 超声辅助提取对蓝莓花青素化学组成的影响
取蓝莓花青素A和提取率最大时的蓝莓花青素B,通过HPLC-ESI-MS法分析其化学组分,探讨超声辅助提取对蓝莓花青素化学组成的影响。
色谱条件:色谱柱为Waters X Bridge C18(4.6mm× 250mm,5μm);流动相的A相为5%甲酸水溶液,B相为乙腈;进样量20μL;流速0.8m L/min;柱温25℃;线性洗脱梯度:0~15m in,5%~10%B;15~30m in,10%~13%B;30~34m in,13%~20%B;34~40min,20%~25% B;40~43m in,25%~100%B;DAD检测器检测波长为530nm。色谱柱分离后样品经三通阀分流后进入质谱分析。质谱条件:电喷雾离子源;数据采集使用软件Agilent Chemstation Rev.A.09.01 software(Agilent,Palo A lto,CA);正离子扫描模式,扫描范围100~1500m/z;干燥气温度350℃;氮气流速12L/min;毛细管电流34nA;雾化器压力0.31MPa。
2 结果与分析
2.1 超声辅助提取工艺参数对蓝莓花青素提取率的影响
利用Design-Expert 8.05软件对表2中数据进行多元回归拟合,得到响应值Y(提取率)与影响提取率的关键因子超声温度(A)、超声pH(B)、超声功率强度(C)和超声时间(D)的二次多项式回归模型为:

表3方差分析结果表明,该模型(p<0.01)高度显著;失拟项p=0.4061>0.05,差异不显著,说明残差由随机误差引起;R2=0.9524,表明该模型与实验拟合较好,自变量与响应值线性关系显著,可以用于蓝莓花青素提取率对超声辅助提取工艺参数响应的理论预测。在p=0.05显著水平剔除不显著项,得到蓝莓花青素提取率对超声辅助提取响应优化方程为Y1=46.97-
从表3还可以看出,超声pH(B)和超声功率强度(C)的互作效应对蓝莓花青素提取率的影响高度明显(p<0.01),进一步分析得到蓝莓花青素提取率预测值最大时的因素水平为:超声温度38.7℃、超声功率强度486W、超声pH 3.5、超声时间43.3m in,预测值为5.587mg/g。综合考虑优化为超声温度39℃、超声功率强度490W、超声pH3.5、超声时间45min的条件下进行验证,提取率平均值为5.478mg/g,与理论值5.512mg/g基本吻合,表明该模型合理有效。伍锦鸣等[15]用四因素五水平的响应面分析法,测得美国蓝莓果花青素的最佳提取条件为:超声功率强度730W、料液比1∶18、提取时间40m in、提取温度55℃,此工艺条件下花青素提取率为5.79%。Tian等[9]的结果则显示,蓝莓花青素超声辅助提取的最优工艺条件为超声功率强度510W、提取时间30m in、料液比10∶1m L/g,此时提取率为2.903mg/g。这种差异可能是由于各研究所用原料、仪器、检测方法等不同而造成的。
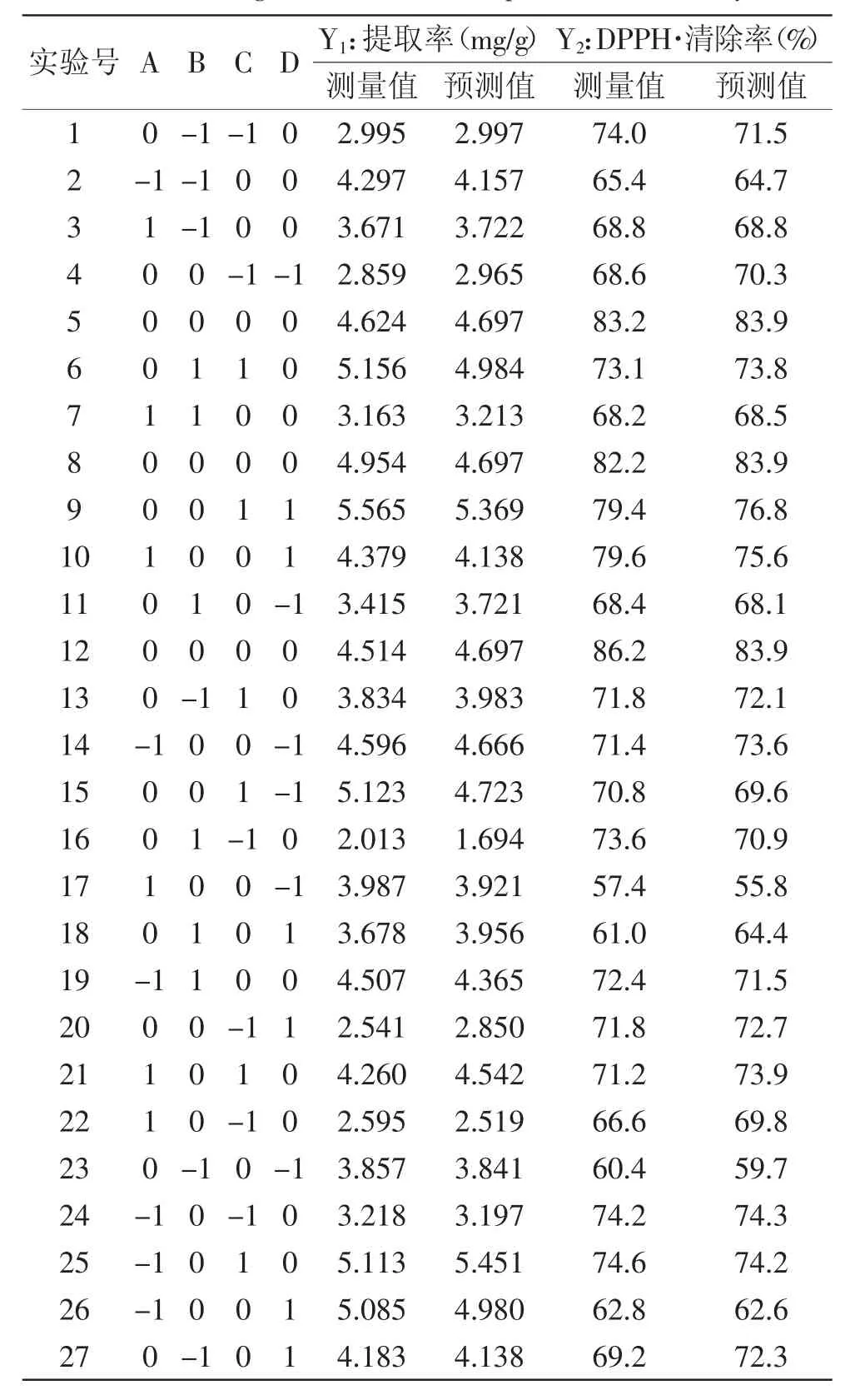
表2 响应面设计与结果Table 2 Design and results of response surface analysis
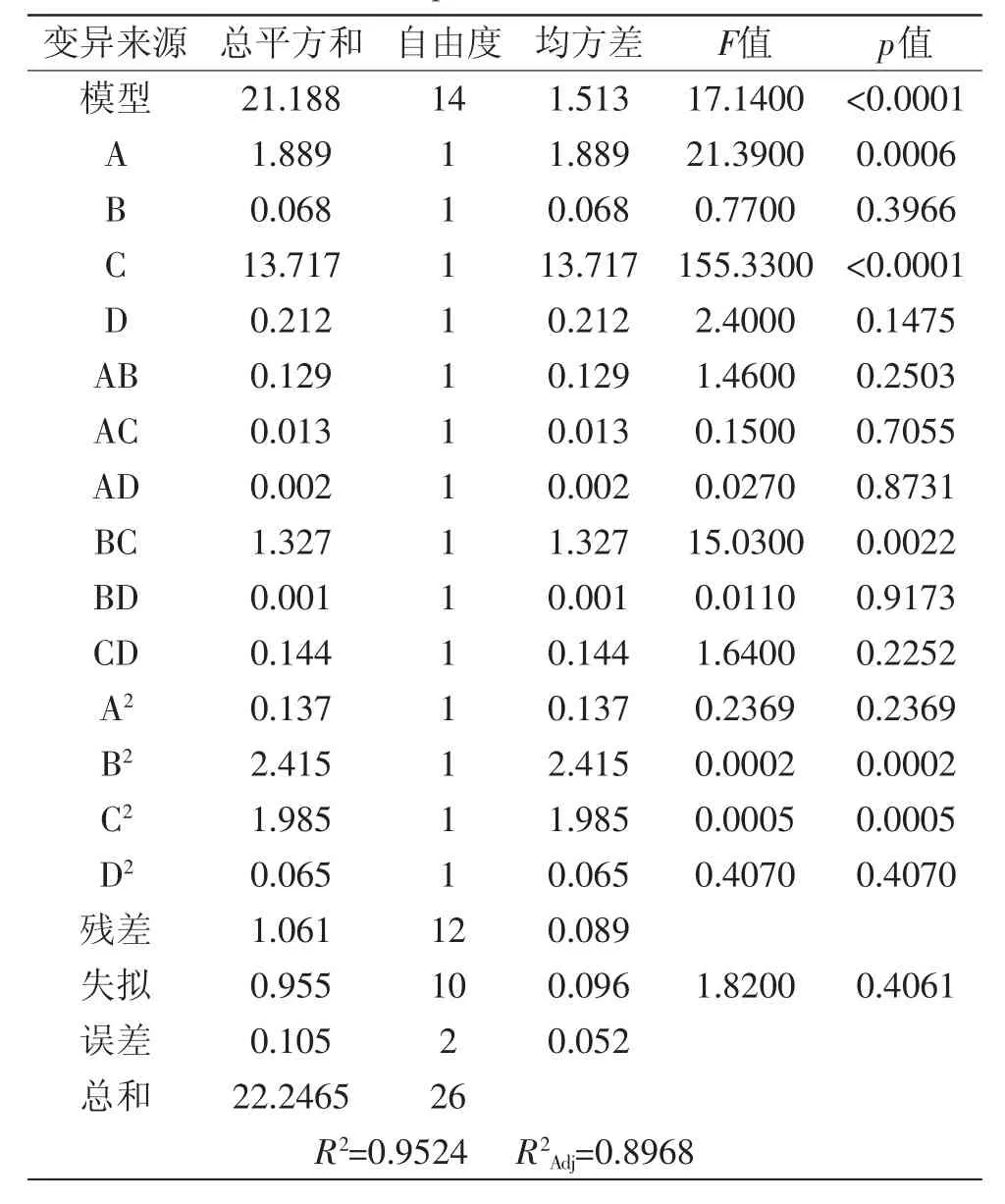
表3 提取率Box-Behnken实验回归模型方差分析Table 3 Variance analysis for regressionmodel of Box-Behnken experimenton extraction rate
2.2 超声辅助提取工艺参数对蓝莓花青素抗氧化活性的影响
利用Design-Expert 8.05软件对表1中数据进行多元回归拟合,得到响应值Y2(蓝莓花青素DPPH·清除率)与影响DPPH·清除率的关键因子超声温度(A)、超声pH(B)、超声功率强度(C)和超声时间(D)的二次多项式回归模型为:
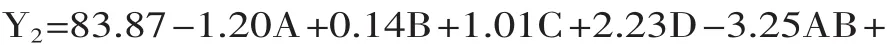
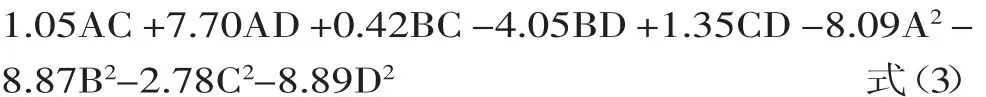
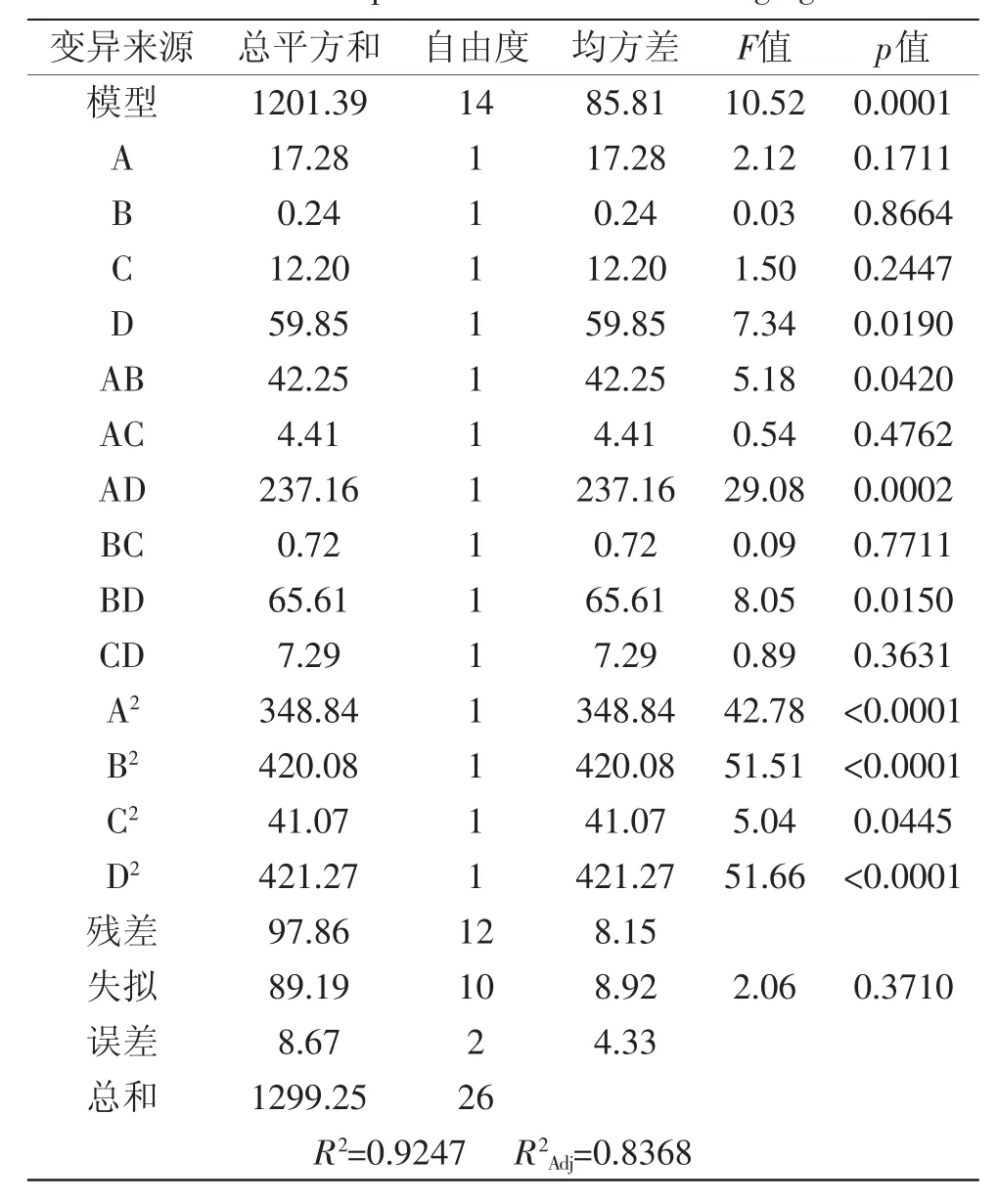
表4 DPPH·清除率Box-Behnken实验回归模型方差分析Table 4 Variance analysis for regressionmodel of Box-Behnken experimenton DPPH scavenging rate
表4方差分析结果表明,该模型(p<0.01)高度显著;失拟项p=0.3710>0.05,差异不显著,说明残差由随机误差引起;R2=0.9247,表明该模型与实验拟合较好,自变量与响应值线性关系显著,可用于蓝莓花青素DPPH清除率对超声辅助提取响应规律的理论预测。在p=0.05显著水平剔除不显著项,得到优化方程为Y2=83.87+2.23D-3.25AB+7.70AD-4.05BD-8.09A2-8.87B2-2.78C2-8.89D2式(4)
从表3还可以看出,超声温度(A)和超声pH(B)、以及超声pH(B)和超声时间(D)的互作效应对蓝莓花青素DPPH·清除率影响高度显著(p<0.01),超声温度(A)和超声时间(D)的互作效应影响显著(p<0.05),交互作用表现为蓝莓花青素对DPPH·清除率的增大。通过进一步分析计算,得到蓝莓花青素对DPPH·清除率预测值最大时的因素水平为:超声温度45.2℃、超声功率强度447W、超声pH 3.1、超声时间36.6min,预测值为84.14%。综合考虑优化为超声温度45℃、超声功率强度450W、超声pH 3.1、超声时间37min的条件下进行验证,DPPH清除率平均值为82.69%,与理论值82.87%十分吻合,表明该模型合理有效。
2.3 超声辅助提取对蓝莓花青素化学组成的影响
根据HPLC-ESI-MS信息及花青素在530nm附近有特征吸收,可以此判断是否为花青素[16]。图1结果表明,花青素A和花青素B都得到了较好的分离,均有11个吸收峰(峰2-峰12,峰1为溶剂峰),且各吸收峰占总吸收峰峰面积的百分比没有显著差异,这显示,两种提取方法所获得的蓝莓花青素的化学组成相同,根据表5色谱峰的相关信息及文献信息[17-20],推知它们分别为飞燕草-3-半乳糖苷(delphindin-3-galactoside)、飞燕草-3-葡萄糖苷(delphindin-3-glucoside)、矢车菊-3-半乳糖苷(cyanidin-3-galactioside)、矢车菊-3-葡萄糖苷(cyanidin-3--glucoside、牵牛花-3-半乳糖苷(petunidin-3-galactoside)、矢车菊-3-阿拉伯糖苷(cyanidin-3-arabinoside)、牵牛花-3-葡萄糖苷(petunidin-3-glucoside)、芍药素-3-葡萄糖苷(peonidin-3-glucoside)、锦葵素-3-半乳糖苷(malvidin-3-galactoside)、锦葵素-3-葡萄糖苷(malvidin-3-glucoside)和锦葵素-3-阿拉伯糖苷(malvidin-3-arabinoside)。可见,与乙醇溶剂浸提法相比,超声辅助乙醇溶剂浸提法并没有改变蓝莓花青素的化学组成,提取样品都为花青素糖苷。

图1 乙醇浸提与超声辅助乙醇浸提的蓝莓花青素的液相色谱图(530nm)Fig.1 HPLC chromatogram of blueberry anthocyanins obtained by at530nm
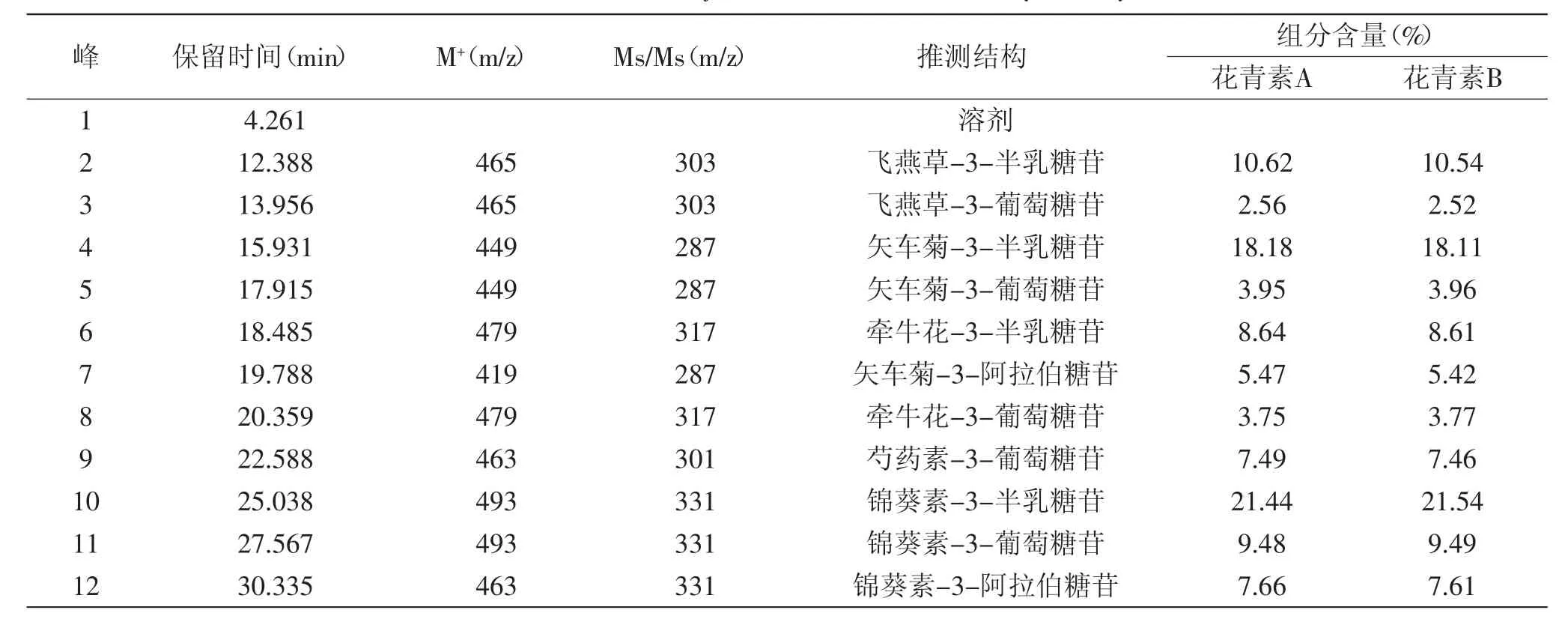
表5 蓝莓花青素A与蓝莓花青素B各组分的质谱信息及其结构推测Table 5 HPLC/MSand conjectural structure of blueberry anthocyanins
3 结论
3.1 花青素提取率及其抗氧化活性的最适超声辅助提取工艺条件不同。影响花青素提取率的最显著因子是超声温度和超声功率强度,最适提取工艺条件为超声温度39℃、超声功率强度490W、超声pH 3.5、超声时间45m in,预测值最大为5.478mg/g;而影响花青素DPPH·清除率的最显著因子是超声时间,最适提取工艺条件为超声温度45℃、超声功率强度450W、超声pH 3.1、超声时间37m in,预测值最大82.69%。
3.2 超声辅助乙醇浸提法能够显著缩短浸提时间、提高提取率而没有改变蓝莓花青素的化学组成。乙醇浸提和超声辅助乙醇浸提的蓝莓花青素均为花青素糖苷,它们的化学组成没有显著差别。
3.3 超声辅助浸提蓝莓花青素时,应该根据实验目的选择适宜的评价指标,当提取产物仅作为色素添加剂时,可以以提取率为评价指标进行工艺优化;当提取产物作为抗氧化功能因子时,可以以DPPH·清除率为评价指标进行工艺优化。
[1]Barnes JS,Nguyen H P,Shen S,et al.Generalmethod for extraction of blueberry anthocyanins and identification using high performance liquid chromatography-electrospray ionizationion trap-time of flight-mass spectrometry[J].Journal of Chromatography A,2009,1216(23):4728-4735.
[2]Hamamatsu S,Yabe K,Nawa Y.Compositions of anthocyanin and other flavonoids in cultured cells of rabbiteye blueberry(Vaccinium ashei Reade cv)[J].Food Science and Technology Research,2004,10(3):239-246.
[3]李金星,胡志和.蓝莓花青素的研究进展[J].核农学报,2013,27(6):817-822.
[4]Zheng X Z,Xu XW,Liu CH,etal.Extraction characteristics and optimal parameters of anthocyanin from blueberry powder under microwave-assisted extraction conditions[J].Separation and Purification Technology,2013,104(1):17-25.
[5]焦龙,李玉伟.蓝莓果实中花青素提取方法的研究进展[J].北京农业,2011,30(3):10-11.
[6]Tian Y,Yang Y,Gao P,et al.Optimization of ultrasonic assisted extraction of flavonols and anthocyanins from Blueberry using RSM[J].Advanced Materials Research,2012,468-471:2423-2430.
[7]EbringerováA,HromádkováZ.An overview on the application of ultrasound in extraction,separation and purification of plant polysaccharides[J].Central European Journal of Chemistry,2010,8(2):243-257.
[8]Dubrovic I,Herceg Z,Jambrak A R,et al.Effect of high intensity ultrasound and pasteurization on anthocyanin content in strawberry juice[J].Food Technology and Biotechnology,2011,49(2):196-204.
[9]Tiwari B K,Donnell C PO',Cullen P J.Effect of sonication on retention of anthocyanins in blackberry juice.Journal of Food Engineering,2009,93(2):166-171.
[10]Flores F P,Singh R K,Kerr W L,et al.Antioxidant and enzyme inhibitory activities of blueberry anthocyanins prepared using different solvents[J].Journal of Agricultural and Food Chemistry,2013,61(18):4441-4447.
[11]潘利华,王建飞,叶兴乾,等.蓝莓花青素的提取工艺参数及免疫调节活性研究[J].食品科学,2014,35(2):81-86.
[12]杨雪飞,潘利华,罗建平.蓝莓色素的超声提取工艺及稳定性[J].食品科学,2010,31(20):251-255.
[13]Lee JM,Durst RW,Wrolstad R E.Determination of total monomeric anthocyanin pigmentcontent of fruit juices,beverages,natural colorants,and wines by the pH differential method:collaborative study[J].Journal of AOAC International,2005,88(5):1269-1278.
[14]Cui C,Zhang SM,You L J,et al.Antioxidant capacity of anthocyanins from Rhodomyrtus tomentosa(Ait.)and identification of the major anthocyanins[J].Food Chemistry,2013,139(1):1-8.
[15]伍锦鸣,卓浩廉,普元柱,等.蓝莓花青素超声提取工艺优化及在卷烟中的应用研究[J].食品工业,2012,33(4):30-33.
[16]Montoro P,Tuberoso C I,Perrone A,etal.Characterisation by liquid chromatography-electrospray tandem mass spectrometry of anthocyanins in extracts of Myrtus communis L.berries used for the preparation ofmyrtle liqueur[J].Journal Chromatography A,2006,1112(1-2):232-240.
[17]Lohachoompol V,Mulholland M,Srzednicki G,et al. Determination of anthocyanins in various cultivars of highbush and rabbiteye blueberries[J].Food Chemistry,2008,111(1):249-254.
[18]Hamamatsu S,Yabe K,Nawa Y.Compositions of anthocyanin and other flavonoids in cultured cells of rabbiteye blueberry(Vaccinium ashei Reade cv.Tiiblue)[J].Food Science and Technology Research,2004,10(3):239-246.
[19]Barnes JS,Nguyen H P,Shen SJ,et al.Generalmethod for extraction of blueberry anthocyanins and identification using high performance liquid chromatography-electrospray ionizationion trap-time of flight-mass spectrometry[J].Journal of Chromatography A,2009,1216(23):4728-4735.
[20]You Q,Wang BW,Chen F,etal.Comparison of anthocyanins and phenolics in organically and conventionally grown blueberries in selected cultivars[J].Food Chemistry,2011,125(1):201-208.
Effect of ultrasonic-assisted extraction on the extraction rate,antioxidant activity and chemical composition of blueberry anthocyanins
LUO Shui-zhong1,2,PAN Li-hua1,*
(1.School of Biotechnology and Food Engineering,HefeiUniversity of Technology,Hefei230009,China;2.Key Laboratory for Agriculture Products Processing of Anhui Province,Hefei230009,China)
In order to obtain the characteristics of the extraction rate,antioxidant activity and chemical compositionof blueberry anthocyanins in the ultrasonic assisted extraction,Box -Behnken design,and antioxidant activitytest in vitro and HPLC-ESI-MS analysis were employed. The results showed that there were differences in themost significant affecting factors and optimal conditions between the extraction rate and the DPPH scavengingrate of blueberry anthocyanins. The ultrasonic temperature and the ultrasonic power were the most significantfactors affecting the extraction rate of blueberry anthocyanins,while the ultrasonic time was the most significantfactors affecting the DPPH scavenging rate of blueberry anthocyanins. The optimal conditions for the extractionrate of blueberry anthocyanins were ultrasonic temperature 39℃,ultrasonic power 490W,ultrasonic pH3.5 andultrasonic time 45min,while for the DPPH scavenging rate of blueberry anthocyanins were ultrasonic temperature45℃,ultrasonic power 450W,ultrasonic pH3.1 and ultrasonic time 37min. The results of HPLC-ESI-MS analysisshowed that 11 anthocyanins from blueberry belonged to anthocyanin glycosides and had the similar chemicalcomposition obtained by both the classic extraction and ultrasound-assisted extraction.
blueberry;anthocyanins;solvent maceration;ultrasonic-assisted extraction
TS254
B
1002-0306(2015)08-0235-05
10.13386/j.issn1002-0306.2015.08.041
2014-07-15
罗水忠(1975-),男,博士,副教授,研究方向:农产品加工。
*通讯作者:潘利华(1972-),女,博士,副教授,研究方向:农产品加工与贮藏。
安徽省2012年度科技攻关项目(1201032075);安徽省2013年度科技攻关计划项目(1301032165)。
