响应面法优化荸荠淀粉酶解工艺及动力学研究
2015-10-24高义霞路兴旺吴亚楠
高义霞,路兴旺,吴亚楠
(天水师范学院生命科学与化学学院,甘肃天水741001)
响应面法优化荸荠淀粉酶解工艺及动力学研究
高义霞,路兴旺,吴亚楠
(天水师范学院生命科学与化学学院,甘肃天水741001)
以葡萄糖当量值(DE)为考察指标,利用单因素和响应面法对α-淀粉酶酶解荸荠淀粉工艺进行优化,并计算相应酶解动力学参数。结果表明:α-淀粉酶酶解荸荠淀粉优化工艺为:时间88min、温度53℃、E/S=0.12U/mg和pH7.7。在此条件下,验证实验DE为(53.393%±0.899%)。在pH7.0,60℃条件下,Km=47.298mg/mL,Vmax=0.335mg/(mL·min),Ea= 11.995kJ/mol,△H=71.882kJ/mol。
荸荠,酶解,动力学,响应面
荸荠(Eleocharis tuberosa),又称马蹄、地栗等,为莎草科荸荠属多年水生或沼生果蔬植物[1]。荸荠淀粉含量高、粘性强、回生温度低、透明度和膨胀度好[2],有“地下雪梨”和“江南人参”的美誉[3]。利用非粮淀粉质原料生产燃料乙醇,符合国家生物质能源战略[4-5],因此,对其酶解工艺进行优化具有重要的实践意义。另外,由于影响淀粉糖生产效率和产品品质的因素有酶类型、离子强度、淀粉种类和浓度、pH和温度等,故常规的米氏方程难以真实描述反应过程[6]。探讨酶解动力学过程各参数,有助于加深对影响该过程的因素的理解和控制,以更充分发挥酶的催化作用,因而在生产实践中具有指导意义。国内外有关玉米、小麦、甘薯、木薯及马铃薯等酶解工艺的研究较多[7],但对酶解动力学研究不足,且不同来源的淀粉,其性质差异较大。本实验以时间、温度、E/S及pH为因素,通过响应面法优化α-淀粉酶酶解荸荠淀粉工艺,同时对酶解动力学进行研究,为荸荠淀粉资源的进一步开发提供理论依据。
1 材料与方法
1.1 材料与仪器
荸荠淀粉 购自平乐宏源农业发展有限公司,淀粉含量为(75.875%±0.941%,n=6);α-淀粉酶 为Sigma产品(58.7U/mg);酒石酸钾钠、氢氧化钠、3,5-二硝基水杨酸、亚硫酸氢钠、苯酚、葡萄糖等 均为分析纯。
AL204型电子天平 梅特勒-托利多仪器有限公司;TGL-20M型高速冷冻离心机 湖南湘仪离心机仪器有限公司;PHS-3D雷磁pH计 上海精密科学有限公司;722型可见分光光度计 上海欣茂有限公司。
1.2 实验方法
1.2.1 标准曲线的制作 参考3,5-二硝基水杨酸(DNS)法[8]。Y=2.633X-0.091,r=0.994(X为葡萄糖质量,mg;Y为OD)。
1.2.2 单因素实验 称取荸荠淀粉,加20m L pH7.0的磷酸缓冲液,80℃糊化5m in。冷却,按E/S=0.02U/mg加入α-淀粉酶,混匀,100m in后迅速沸水浴灭活5m in,测定吸光值,计算葡萄糖当量值(DE)。
DE(%)=葡萄糖量(mg)×100/淀粉(mg)。
式中:m为葡萄糖质量(mg);V为酶解液测定体积(m L);t为反应时间(min)。
1.2.2.1 时间对DE的影响 在pH 6.0、E/S=0.02U/mg、温度50℃条件下,分别测定时间为10、20、40、60、80、100、120、150、180m in时DE,探讨时间对其影响。
1.2.2.2 温度对DE的影响 在pH 6.0、E/S=0.02U/mg、时间100m in条件下,分别测定温度为30、40、50、60、70℃时DE,探讨温度对其影响。
1.2.2.3 E/S对DE的影响 在pH 6.0、时间100m in、温度60℃条件下,分别测定E/S为0.005、0.01、0.02、0.04、0.08、0.16U/mg时DE,探讨E/S对其影响。
1.2.2.4 pH对DE的影响 在时间100m in、温度60℃、E/S=0.08U/mg条件下,分别测定pH为4、5、6、7、8时DE,探讨pH对其影响。
1.2.3 响应面法优化酶解工艺 在单因素实验基础上,参考李艳红[9],以时间、温度、E/S及pH为因子,单因素实验各因子最优点为基准点,确定适度步长,DE为响应值,利用Design-Expert 8.06中Box-Behnken法设计实验,见表1。

表1 Box-Benhnken实验因素水平及编码Table 1 Level and code of variables for Box-Benhnken design
1.2.4 酶促反应动力学模型 Michaelis和Menten根据快速平衡学说建立米氏方程,Briggs和Haldane用稳态代替快速平衡态,对米氏方程做了修正,得到更合理的酶促反应动力学过程[10]。在30~50℃范围内,以lnv对1/T(×103)拟合:lnK3=式(2)
式中:R为气体常数8.31J(/mol·K);Ea为活化能(kJ·mol);B为积分常数。
将公式(2)写成指数形式,K3=A×exp(-Ea/RT),A为前指因子[mg(/m L·m in)]。求得Ea。
平衡常数Ks与温度T服从范特柯夫方程:lnKs=-△H/RT+lnC式(3),当K3≥K2时,Ks≈Km,在30~45℃范围内,以不同温度下Km与1/T回归[11],求得△H。
1.3 数据处理
利用Origin 7.5作图,Design-Expert 8.06进行响应面分析,单因素方差分析采用Excel 2003(p<0.01),数据重复3次,以平均值±标准差(±s)表示。
2 结果与分析
2.1 单因素实验
2.1.1 时间对DE的影响 由图1可知,在0~100m in范围内,DE随时间的延长而增加,随后趋于平稳,甚至缓慢下降,原因可能是开始时淀粉被水解释放大量葡萄糖,但当DE达到28%以上时,葡萄糖重新结合生成异麦芽糖等复合糖,复合糖生成速率逐渐超过淀粉水解速率,出现较弱的复合反应[12]。同时,淀粉浓度降低、产物浓度增加加速了逆反应的进行、产物还原糖对酶促反应的抑制作用和随时间的延长酶分子失活[13-14]等因素,使DE不断减少,因此,时间选择100min。

图1 时间对DE的影响Fig.1 Effect of time on DE
2.1.2 温度对DE的影响 由图2可知,在30~50℃范围内,DE先急剧增加,随后趋于平缓;在50~70℃范围内,DE先增大,并在60~70℃范围内接近最大值。因此,温度选择60~70℃。
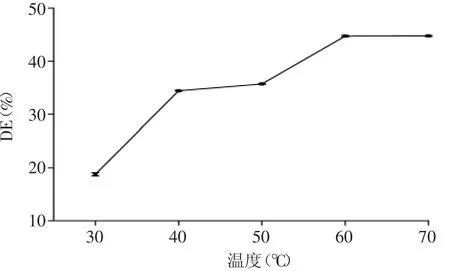
图2 温度对DE的影响Fig.2 Effect of temperature on DE
2.1.3 E/S对DE的影响 由图3可知,反应初期,随E/S的增大,DE迅速增加,原因是开始时底物过量,酶促反应速率与酶量成正比,随反应的进行,底物成为限制因子,因而反应速率不再增加,甚至出现下降趋势[15],故DE下降,E/S选择0.08U/mg。
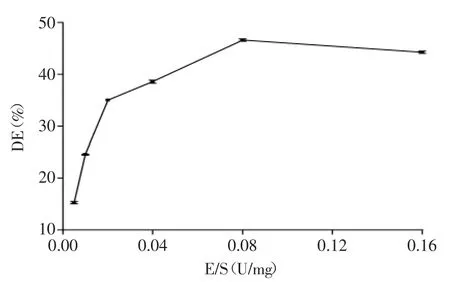
图3 E/S对DE的影响Fig.3 Effect of E/Son DE
2.1.4 pH对DE的影响 由图4可知,pH可影响酶分子活性中心上必需基团的离子化程度,也可影响底物的解离程度,从而影响酶与底物的结合[16]。在pH 6.0~7.0范围内,DE接近最大值,因此pH选择6.0~7.0。

图4 pH对DE的影响Fig.4 Effect of pH on DE
2.2 响应面分析
Box-Benhnken设计和结果及方差分析见表2和表3。模型(p<0.0001),极显著,失拟项p=0.2042> 0.05,不显著,说明残差由随机误差引起,该模型稳定。R2=0.949>90%,该模型与实验拟合良好,自变量与响应值线性显著,可用于该工艺的分析和预测[17]。
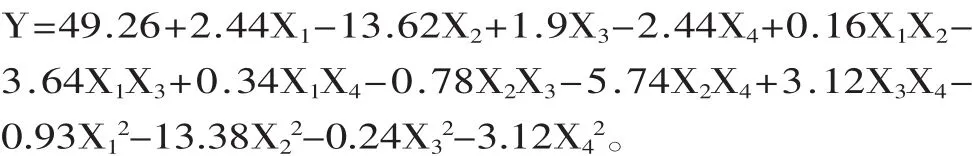

表2 Box-Benhnken实验设计表及结果Table 2 Box-Benhnken designmatrix and experimental results
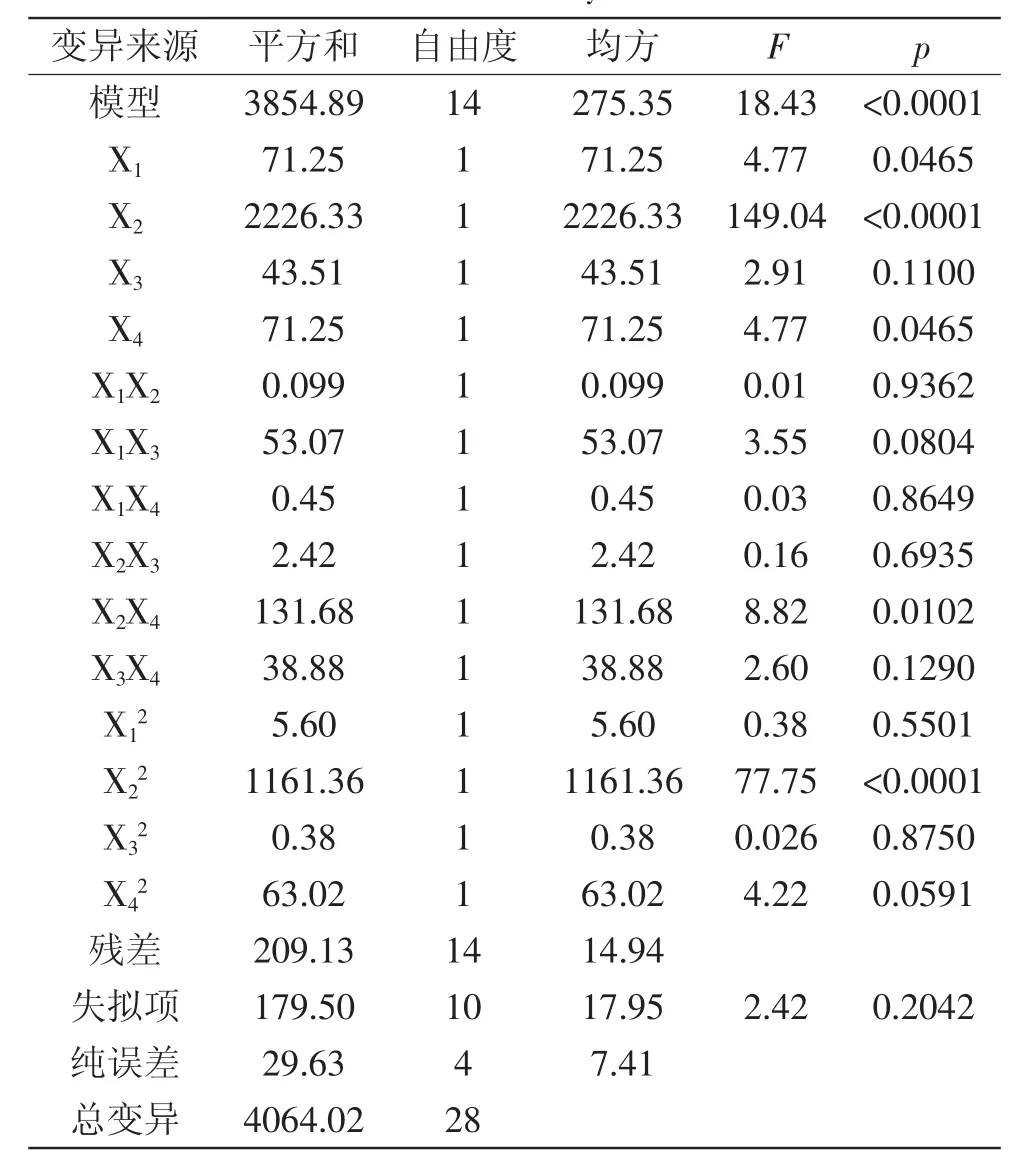
表3 回归模型系数显著性检验及其方差分析Table 3 Significance test of regression coefficientand its variance analysis
温度(X2)的p<0.0001,表明其对DE影响极显著;时间(X1)及pH(X4)的p<0.05,影响显著;E/S(X3)的p> 0.05,影响不显著。二次项影响极显著,其余均影响不显著。交互项X2X4影响显著,其余均不显著。去掉不显著项,得到的优化方程为Y=49.26+2.44X1-
最优工艺为:时间88m in、温度53℃、E/S=0.12U/mg和pH7.7,预测DE可达56.518%。验证实验平均值为(53.393%±0.899%,n=6),RSD=1.684%,可用于荸荠淀粉酶解工艺的优化。
2.3 Lineweaver-Buck法求酶解参数
以葡萄糖浓度(mg/m L)为纵坐标,时间(min)为横坐标[18],在1~25min内,Y=0.059X+0.109,r=0.999,故酶解动力学测定选择25m in。以1/V-1/S作图,1/V= 2.985+141.181/S,r=0.996,求得Vmax=0.335mg/(m L·m in),Km=47.298mg/m L。
2.4 Ea及△H计算
在30~50℃范围内,以lnv对1/T(×103)作图,见图5,lnK3=0.91-1.443/T,r=0.975,求得Ea=11.995kJ/moL,A=2.483mg/(m L·m in)。在30~45℃范围内,以不同温度下Km与1/T回归,见图6,lnKs=28.684-8.65/T,r=0.929,△H=71.882k J/mol。
Enzymolysis technologies and kinetics of Chinese water chestnut(Eleocharis tuberosa)with response surface method
GAO Yi-xia,LU Xing-wang,WU Ya-nan
(College of Life Science and Chemistry,Tianshui Normal University,Tianshui741001,China)
With dextrose equivalent value(DE)as an index,response surface method was used to investigate the optimum enzymolysis technologies of Chinese water chestnut(Eleocharis tuberosa)starch by alpha-am ylase based on single experiment,and its corresponding kinetics parameters were also established.The results indicated that the optimal technologies were time 88m in,temperature 53℃,E/S=0.12U/mg and pH7.7.The verification results of DE reached(53.393%±0.899%)under above conditions.Under pH7.0 and temperature 60℃,Kmand Vmaxwere 47.298mg/m L and 0.335mg/(m L·m in),respec tively,Eaand△H were 11.995kJ/moland 71.882kJ/mol,respectively.
Chinese water chestunt;enzymolysis;kinetics;response surface method
TS201.1
A
1002-0306(2015)08-0215-04
10.13386/j.issn1002-0306.2015.08.036
2014-08-12
高义霞(1982-),女,硕士研究生,讲师,主要从事食品化学方面的研究。
天水师范学院“青蓝人才”资助(TS201406)。
