高产纳豆激酶的枯草芽孢杆菌优选及发酵工艺条件优化
2015-10-24葛武鹏吴晓勇
张 杰,葛武鹏,*,张 静,陈 瑛,吴晓勇
(1.西北农林科技大学食品科学与工程学院,陕西杨凌712100;2.陕西省质量技术监督局,陕西西安710068;3.咸阳市食药局检测中心,陕西咸阳712000)
高产纳豆激酶的枯草芽孢杆菌优选及发酵工艺条件优化
张 杰1,葛武鹏1,*,张 静1,陈 瑛2,吴晓勇3
(1.西北农林科技大学食品科学与工程学院,陕西杨凌712100;2.陕西省质量技术监督局,陕西西安710068;3.咸阳市食药局检测中心,陕西咸阳712000)
以黄豆为主料,添加不同辅料,采用不同处理方式,以产酶活力为指标研究三株枯草芽孢杆菌发酵性能,筛选优势菌株进行固态发酵,确定最优工艺条件。结果表明:在三株受试菌种中BS21076发酵性能最优,活菌数及纳豆激酶活力均较高;最优固态发酵条件为:大豆90℃下烘炒5min,破碎度为四瓣,魔芋精粉添加量3%,接种量为8%,37℃下发酵24h;在此条件下,酶活力可达(3582.48±83.13)U/g,较传统发酵NK活力极显著(p<0.01)提高。
纳豆激酶,枯草芽孢杆菌,工艺优化
纳豆(Natto)作为日本一种具有一千多年历史的传统食品,其营养与活性物质使纳豆在食用中具有多种医疗保健功能[1-3],并被作为药食兼用的健康食品,受到日本民间的厚爱[4]。经常食用纳豆可预防或治疗多种亚健康体质长期积累引起的疾病[5]。纳豆激酶(Nattokinase,NK)为发酵食品纳豆中提取出的一种单链多肽酶[6-7],其功能特性已得到大量文献证实,主要表现为溶栓作用[8-9],同时兼具安全性好、成本低、作用迅速、经口服后可迅速入血[10]及在胃肠的稳定性好等优点[11-13]。纳豆激酶作为一种微生物代谢产物具有广阔的开发应用前景[14],当前已有较多关于固态发酵产纳豆激酶工艺条件研究的报道[15-18],并且已有相关产品面世。
目前,对于纳豆及其相关产品的研究日本处于领先地位,其既有富含枯草芽孢杆菌的纳豆制品,又有纳豆激酶富集纯化的相关产品。而我国虽有大量相关研究,但在整体水平上仍有待提高,主要表现为枯草芽孢杆菌活菌数不高,纳豆激酶活力偏低,至今未有突破性进展。本研究在传统发酵技术上,结合前人研究成果,通过对大豆原料的优化处理,并添加不同辅助材料,以高产纳豆激酶为目标优选高产菌株,同时对固态发酵条件进行优化,以期得到工业发酵生产高活性的纳豆激酶的工艺条件,为相关产品开发提供支撑。
1 材料与方法
1.1 材料与仪器
三株受试菌 购自中国工业微生物菌种保藏管理中心,分别为BS10458(枯草芽孢杆菌)、BS20639(枯草芽孢杆菌枯草亚种)及BS21076(枯草芽孢杆菌枯草亚种);尿激酶 购自北京雅安达生物技术有限公司;凝血酶(1000U/支)、牛纤维蛋白原 购自Sigma公司;其余试剂 均为分析纯。
101-1型干燥箱 上海市实验仪器总厂;DRP-9162电热恒温培养箱、DK-S26型电热恒温水浴锅上海森信实验仪器有限公司;BCD-200(KK20V51TI)冰箱 博西华家用电器有限公司;SW-CJ-2D型(实用垂直新颖)双人净化工作台 苏州净化设备有限公司;ES-315高压蒸汽杀菌锅 上海博迅实业有限公司;FA2004型电子天平 长沙湘平科技发展有限公司;精密pH仪 德国赛多利斯股份公司;SPH-200B摇床 西安禾普生物科技有限公司;HC-3018高速离心机 安徽中科中佳科学仪器有限公司。
1.2 菌种培养基
液体培养基:蛋白胨5.0g,牛肉膏3.0g,NaCl 5.0g,蒸馏水1.0L,pH 7.0。
斜面培养基:蛋白胨5.0g,牛肉膏3.0g,NaCl 5.0g,琼脂15.0g,蒸馏水1.0L,pH7.0。
1.3 实验方法
1.3.1 斜面培养 将保藏的菌种转接至斜面培养基,37℃培养24h。
1.3.2 种子液的制备 用接种环挑取斜面菌种两环,接种于装有100m L液体种子培养基的250m L三角瓶中,37℃、150r/m in摇床培养15h。
1.3.3 纳豆传统发酵工艺流程 大豆→筛选、清洗→浸泡→分装入三角瓶→高压蒸汽蒸煮→冷却→接菌→37℃恒温培养24h→放入冰箱中后熟→成熟纳豆[19]。
1.3.4 纳豆固态发酵酶液的提取 纳豆固态发酵结束后,将纳豆制品以1∶5加入0.85%生理盐水,4℃浸提24h,4500r/m in离心20m in,取上清液测定酶活。
1.3.5 纳豆激酶活性测定方法 纳豆激酶活性测定参照Astrup法[20],制备纤维蛋白平板并进行改进。取3m L配制好的纤维蛋白原溶液放入长试管中于37℃保存备用。在直径9cm培养皿中,用1000μL的移液枪加入1m L 20U/m L凝血酶,再加入2m L工作液,摇匀。再将配制好的琼脂糖溶液取10m L加入放有纤维蛋白原溶液的试管中,摇晃几下倒入培养皿中,按逆时针方向匀速转圈摇晃培养皿,以确保溶液充分混合均匀,并保持无气泡。将尿激酶标准品用生理盐水配制成200、400、600、800、1000U/m L 5个浓度梯度,分别取5μL加入已制备好的琼脂糖-纤维蛋白原平板中,放入恒温培养箱中37℃孵育18h,测量溶解圈垂直直径,计算溶解圈面积。以溶解圈面积为纵坐标,酶活力为横坐标做标准曲线。取样品5μL加入纤维蛋白平板中,37℃孵育18h,测量溶解圈垂直直径,根据标准曲线测定样品酶活。
1.3.6 三株菌生长特性及其纳豆激酶活力比较
1.3.6.1 生长曲线的绘制 将三株活化后的菌种以4%的接种量接入液体培养基,培养不同时间后进行梯度稀释测定活菌数[21],重复3次,结果取平均值。
1.3.6.2 三株菌产纳豆激酶活力测定 称取100g黄豆,洗净、浸泡过夜;将其沥干后的黄豆于121℃高压灭菌蒸煮20m in,自然冷却后,接入8%种子液,然后37℃培养,分别测定培养16、20、24、36、48h后,再经4℃冰箱后熟纳豆激酶的酶活力值。
1.3.7 固态前处理最佳条件确定
1.3.7.1 不同处理方法对酶活的影响 称取100g黄豆,洗净、浸泡过夜,将沥干后的黄豆采取不同的处理方式:微波处理、蒸处理、煮处理、烘炒处理,按8%的接种量接入种子液,放置培养箱中37℃培养20h,然后4℃冰箱后熟24h,分别测定其酶活。
1.3.7.2 破碎度确定 称取100g黄豆,洗净、浸泡过夜,将沥干后的黄豆分别切成0、2、4、8瓣及细碎状态,90℃下烘炒5m in,自然冷却后,接8%种子液,37℃培养20h,然后4℃冰箱后熟24h,分别测定其酶活。
1.3.8 固态发酵最佳条件确定 在固态前处理最佳条件的基础上选择接种量、魔芋精粉添加量、发酵时间、发酵温度作为实验四因素,设计四因素三水平的正交实验,参照上述1.3.5纳豆激酶活性测定方法,按L9(34)正交表进行实验,研究得到固态发酵最佳条件。正交实验的各因素水平见表1。
1.3.9 数据处理 采用Excel对数据进行处理,实验结果计算标准差。采用M initab 16.0软件对实验数据进行分析。
2 结果与讨论
2.1 尿激酶标准曲线的绘制
图1为尿激酶的标准曲线图,所得到的标准曲线方程为y=0.003x+0.3937,相关系数R2=0.9976。
2.2 菌株生长特性及纳豆激酶活力比较
2.2.1 生长曲线 三株枯草芽孢杆菌生长曲线见图2。由图2可见,BS10458在0~6h时,处于生长延滞期;在6~12h时,处于对数生长期;在12~30h时,处于生长稳定期;30h后即进入生长衰亡期,活菌数最高达1.04× 107cfu/m L。BS21076在0~9h时,处于生长延滞期;在9~18h时,处于对数生长期;在18h后进入生长稳定期,最高活菌数达4.57×108cfu/m L。BS20639在0~12h时,处于生长延滞期;在12~18h时,处于对数生长期;在18~33h时,处于生长稳定期;33h后进入生长衰亡期,最高活菌数达2.70×108cfu/m L。
根据以上结论,BS21076与BS20639这两株菌的活菌数最高达到108cfu/m L,且都在12h左右进入对数期。而BS10458达到对数期时间相对短,但活菌数最高却仅达到107cfu/m L。
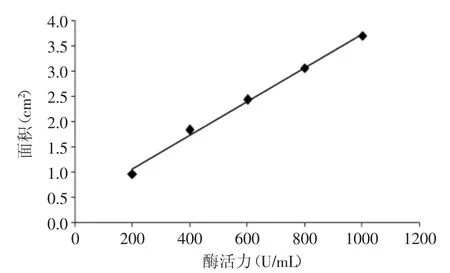
图1 尿激酶标准曲线Fig.1 Standard curve of urokinase
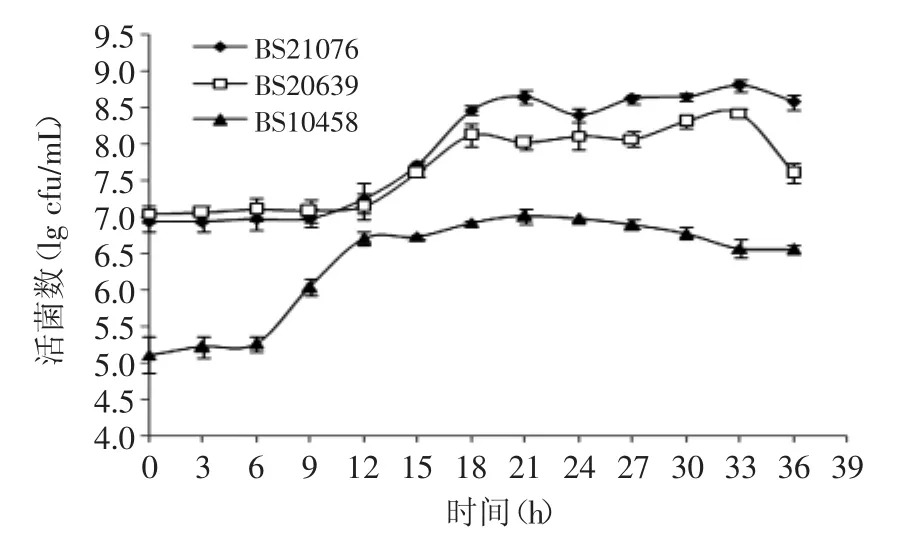
图2 三株枯草芽孢杆菌的生长曲线Fig.2 Growth curve of three Bacillus Subtilis
2.2.2 纳豆激酶活力比较 三株枯草芽孢杆菌不同发酵时间的酶活变化见图3。由图3可知,三株枯草芽孢杆菌均随发酵时间的延长,其酶活变化呈现先增大后减小的趋势,在20h时,三株菌(BS10458、BS21076及BS20639)的纳豆激酶的酶活力达到最大值,其分别为1470.47、1668.76、1545.97U/g。其中,BS21076发酵得到的纳豆激酶酶活力值明显高于BS20639与BS10458。
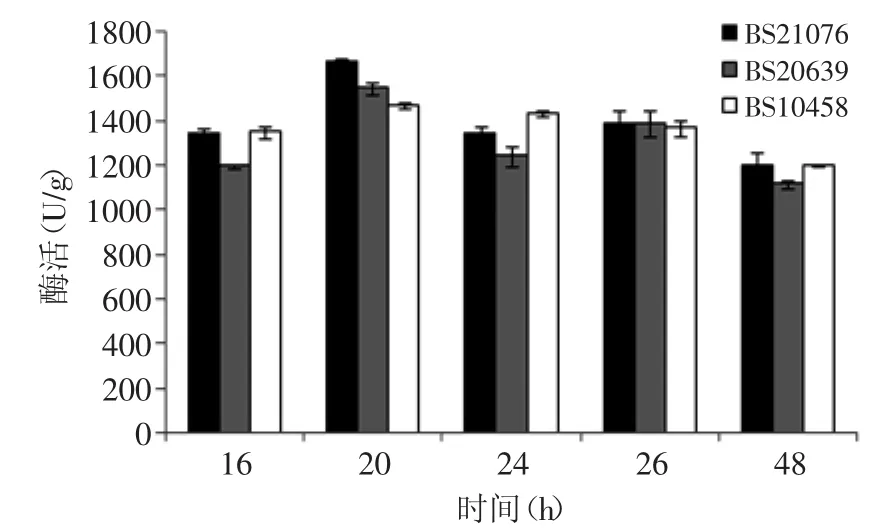
图3 不同发酵时间下对酶活力影响Fig.3 Effect of different fermentation time on the activity of nattokinase
综合而言,BS21076在不同发酵时间下所产生的酶活力高于其他两株菌,表明该菌种具有较好的产酶活性。图3看出,三株菌随发酵时间的延长,酶活力均呈现先增大后减小的趋势,并且在20h时达到峰值。原因可能是起始阶段至16h内,菌种处于长菌阶段,16~20h间处于产酶阶段,20h时酶活力达到最大值。
综合比较三株菌的活菌数及纳豆激酶酶活力两项指标,可以得出,BS21076在固态发酵中其发酵性能优于其他两株菌,后续研究中以BS21076作为发酵生产菌株。
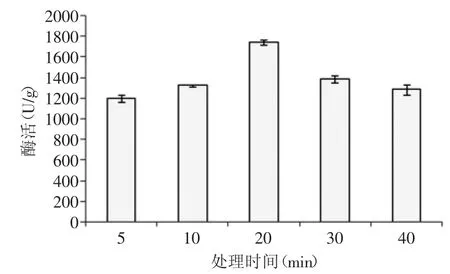
图4 不同蒸制处理时间对纳豆激酶活力的影响Fig.4 Effect of steming time on the activity of nattokinase
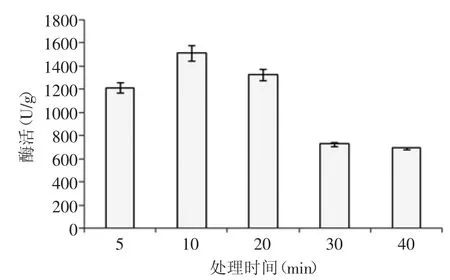
图5 不同煮制处理时间对纳豆激酶活力的影响Fig.5 Effect of boiling time on the activity of nattokinase

图6 90℃时不同烘炒时间对纳豆激酶活力的影响Fig.6 Effect of baking time on the activity of nattokinase on 90℃
2.3 固态发酵前处理最佳条件优化
2.3.1 不同处理方式对酶活的影响 对浸泡沥干后的豆子进行蒸制处理、煮制处理、烘炒处理、微波处理,然后接种8%的种子液进行发酵,不同处理方式下发酵产生的纳豆激酶的酶活力随处理时间变化见图4~图7。随着处理时间的延长,豆子中的蛋白质变性越来越严重,而当其营养成分受到很大影响时,往往不利于微生物的发酵,选择合适的处理时间对于不同处理方式下发酵纳豆显得尤为重要。表2中纳豆激酶的酶活力值为优化处理条件后得到最优值。通过比较四种处理方法,对纳豆激酶的酶活值与活菌数的影响,最终确定烘炒处理为最佳处理方式,烘炒条件为90℃烘炒5m in。
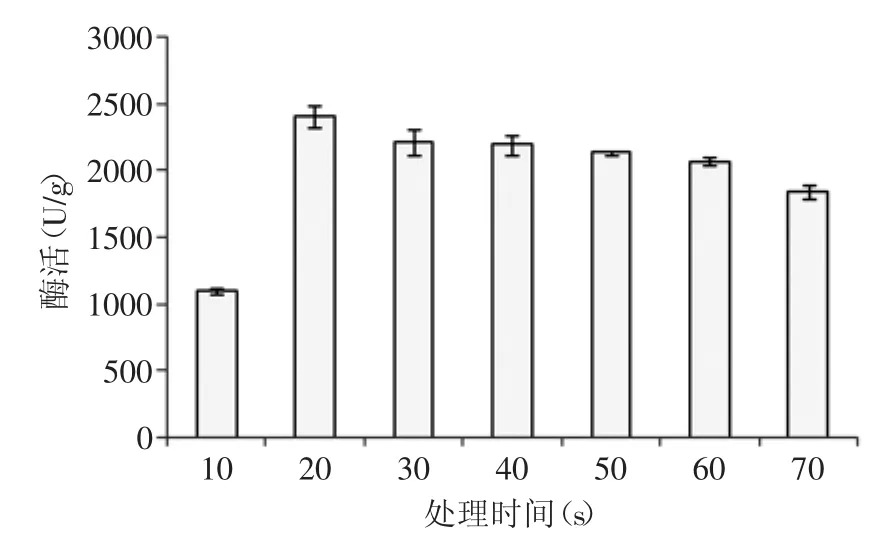
图7 不同微波处理时间对纳豆激酶活力的影响Fig.7 Effect of microwave processing time on the activity of nattokinase

表2 不同处理方式对纳豆激酶活力的影响Table 2 Effect of different treatments on the activity of nattokinase
2.3.2 破碎度对酶活的影响 不同破碎度对纳豆激酶的酶活力的影响见图8。从图8可知,当豆子被切成四瓣时,其酶活力达到最高,其值为1730.52U/g。这是因为当豆子被切碎后,增加了微生物与黄豆的接触面积使之更好的被利用,但是过于细碎会使微生物利用的氧气降低,酶活值下降。最终确定黄豆破碎度为四瓣。
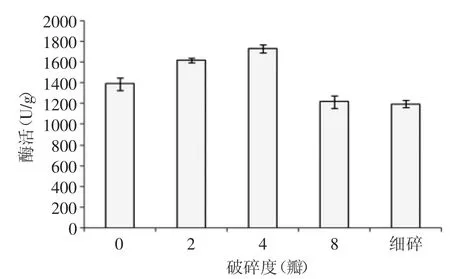
图8 不同破碎度对纳豆激酶活力的影响Fig.8 Effect of soybean fragmentation on the activity of nattokinase
2.4 固态发酵最佳工艺优化
本实验在单因素实验的基础上,选择接种量、魔芋精粉添加量、发酵时间、发酵温度因素,使用正交设计对产酶工艺条件进行优化,结果分析见表3与表4。
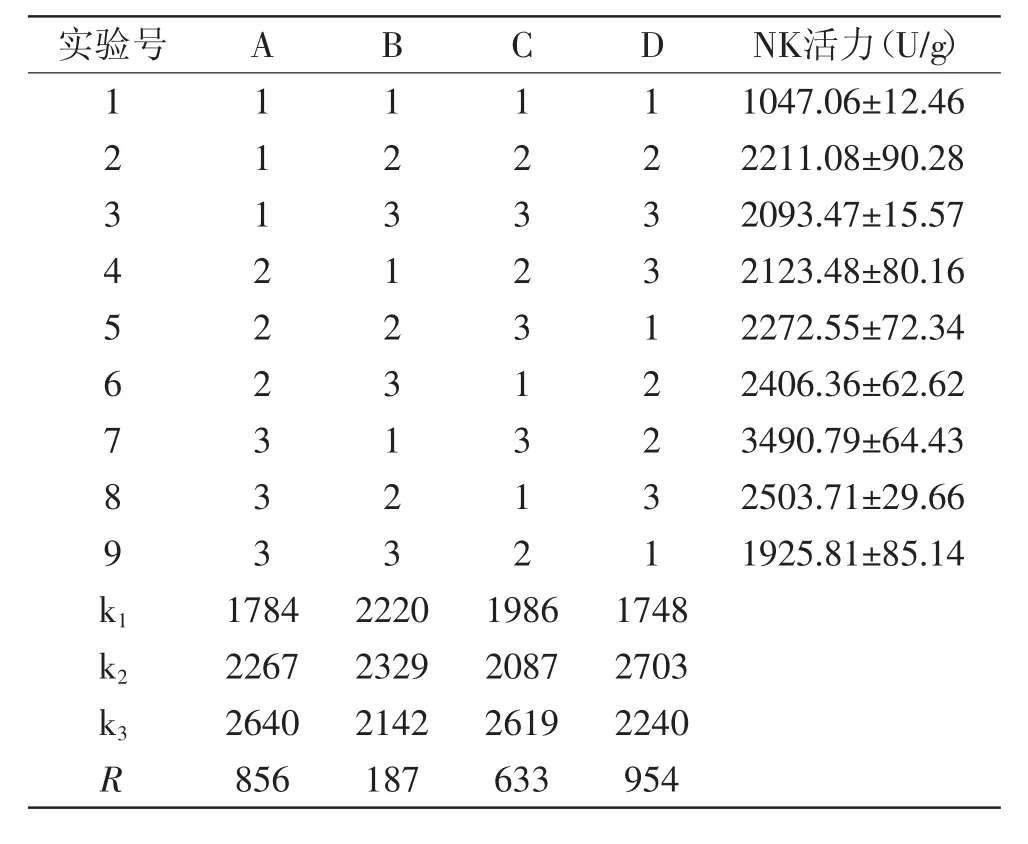
表3 正交实验结果及分析Table 3 Results and analysis of orthogonal experiment
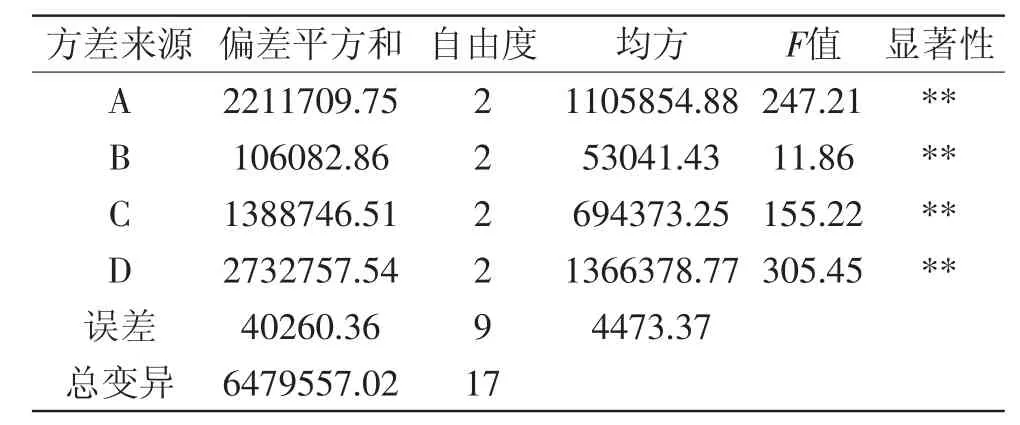
表4 正交实验方差分析表Table 4 Variance analysis of orthogonal test
由正交实验结果和方差分析表可以看出,接种量(A)、魔芋精粉添加量(B)、发酵时间(C)与发酵温度(D)此四个因素对纳豆激酶活力的影响主次顺序为发酵温度>接种量>发酵时间>魔芋精粉添加量。即发酵温度对发酵产生的纳豆激酶活力影响最大,达到极显著水平,为决定性因素。其次为接种量、发酵时间,而魔芋精粉添加量的影响最小。固态发酵工艺最佳条件为A3B2C3D2,即破碎度为四瓣,90℃烘炒5m in,魔芋精粉添加量为3%,接种量为8%,37℃下发酵24h。
2.5 正交实验验证
根据正交实验结果其最优组合为A3B2C3D2,进行多次重复性(n=3)验证实验,测得NK活力为(3582.48± 83.13)U/g,与传统发酵NK活力(2060.12±59.45)U/g相比极显著(p<0.01)提高。所得到的正交实验结果合理,在工业生产中具有一定的应用价值。
3 结论
3.1 通过生长曲线、活菌数及不同发酵时间下产生纳豆激酶的酶活力指标研究,由三株枯草芽孢杆菌中筛选出了一株较为优良的枯草芽孢杆菌BS21076。其在9h左右进入对数期,最高活菌数为4.57×108cfu/m L,用于固态发酵20h后产生纳豆激酶的酶活力最高,其值为1668.76U/g。
3.2 通过正交实验,最后得到了固态发酵条件的最佳工艺参数:破碎度为四瓣,90℃烘炒5m in,魔芋精粉添加量为3%,接种量为8%,37℃下发酵24h。在此条件,发酵得到的酶活值为3582.48±83.13U/g。
[1]张晓敏,徐宝才.纳豆—一种值得开发的功能性食品[J].中国食品添加剂,2007,2:187-192.
[2]史延茂,田智斌,张聪莎,等.传统发酵大豆制品功能成分的研究进展[J].中国调味品,2012,37(12):13-20.
[3]Xie Q L,Guo Y,Lin J.Research on themethod of nattokinase activity detection[J].Guangdong Med.J,2000,10(6):8-10.
[4]高瑞萍,刘辉,刘嘉,等.纳豆的研究进展[J].食品与发酵科技,2011,47(1):23-26.
[5]代增英,冯建岭,李迎秋,等.纳豆及纳豆激酶的研究进展[J].山东食品发酵,2013,1:46-50.
[6]李淑英,赵仲麟,聂莹,等.纳豆激酶研究进展[J].中国农业科技导报,2013,4:139-143.
[7]Sumi H,Hamada H,Tsushima H,et al.A novel fibrinolytic enzyme(nattokinase)in the vegetable cheese natto:a typical and popular soybean food in the Japanese diet[J].Experientia,1987,43(10):1110-1111.
[8]FujitaM,Hong K,Ito Y,etal.Thrombolytic effect of nattokinase on a chemically induced thrombosis model in rat[J].Biol Pharm Bull,1995,18(10):1387-1391.
[9]平谷一,中西晃一朗,须见洋行.血栓溶解剂[P].日本公开特许89180834,1989.
[10]Essam Kotb.Fibrinolytic Bacterial Enzymes with Thrombolytic Activity[M].Springer Briefs in Microbiology,2012:35-43.
[11]王常苏,孙晓彤,余洁,等.纳豆激酶高活性菌株BN-05鉴定及发酵工艺优化[J].中国酿造,2014,33(1):91-95.
[12]董超,史延茂,田智斌,等.纳豆发酵及后处理生产工艺对纳豆激酶活性的影响[J].中国酿造,2013,32(5):38-41.
[13]李妍,吴庆红,陈义伦,等.一株纳豆芽孢杆菌的产酶条件优化[J].食品科学,2013,3:179-183.
[14]郭颖,孔繁东,祖国仁,等.纳豆激酶溶栓功效及开发应用前景[J].食品工业科技,2007,3:225-228.
[15]鲍艳霞,陈钧,钱之玉,等.固态发酵产纳豆激酶的工艺优化[J].沈阳药科大学学报,2004,11(6):468-471.
[16]仓义鹏,张宏志,董明盛.苹果渣固态发酵产纳豆激酶的工艺优化[J].生物工程,2010,31(15):181-185.
[17]孙岩,王海宽,王建玲,等.以豆粕为原料固态发酵产纳豆激酶工艺的优化[J].天津科技大学学报,2011,26(6):7-11.
[18]周伏忠,陈晓飞,陈国参,等.纳豆激酶固态发酵的参数优化[J].生物技术,2011,21(1):91-94.
[19]甘露,崔松松,倪敬田,等.纳豆固态发酵条件优化[J].食品工业科技,2013,17:210-213.
[20]Astrup T,Muller S.The fibrin plate method for estimating fibrinolytic activity[J].Arch Biochemical Biopys,1995,40:346-351.
[21]周建平,郭华.纳豆黏液成分分析[J].食品工业科技,2003,24(4):32-34.
Screening of nattokinase high-yielded in different Bacillus Subtilis and optimization of fermentation conditions
ZHANG Jie1,GEW u-peng1,*,ZHANG Jing1,CHEN Ying2,WU Xiao-yong3
(1.College of Food Science and Engineering,Northwest A&FUniversity,Yangling 712100,China;2.Shaanxi Bureau of Quality and Technical Supervision,Xi'an 710068,China;3.Center of Inspection of Food and Drug Administration,Xianyang 712000,China)
This study was based on soybeans as main material,added different auxiliary material and hand led with different treatments.Three Bacillus Subtilis fermentation characteristics were com pared and the optimal strain was sele ted with the index of enzyme activity.The optimal process conditions were determined by solid-state fermentation experiments with the optimal strain.The result showed as follows:among three testing strains,BS21076 had the optimal fermentation characteristics,higher viable count and nattokinase activity.The op timal conditions of solid fermentation were baked at 90℃for 5m in,crushed deg ree four,3%konjac power,the inoculation of 8%and fermented at 37℃ for 24h.Under these conditions,the enzyme activity reached(3582.48±83.13)U/g,which com pared with traditional fermentation NK activity increased significantly(p<0.01).
nattokinase;Bacillus Subtilis;process op tim ization
TS201.3
A
1002-0306(2015)08-0202-05
10.13386/j.issn1002-0306.2015.08.033
2014-07-15
张杰(1989-),女,硕士研究生,研究方向:生物技术。
*通讯作者:葛武鹏(1965-),男,博士,副教授,研究方向:乳品科学及生物技术。
西北农林科技大学人才基金项目(Z111020923)。
