应用三种方法观察副溶血性弧菌生物被膜
2015-10-24郭卓然付娇娇潘迎捷
蓝 英,郭卓然,付娇娇,潘迎捷,2,3,赵 勇,2,3,*
(1.上海海洋大学食品学院,上海201306;2.农业部水产品贮藏保鲜质量安全风险评估实验室,上海201306;3.上海水产品加工及贮藏工程技术研究中心,上海201306)
应用三种方法观察副溶血性弧菌生物被膜
蓝 英1,郭卓然1,付娇娇1,潘迎捷1,2,3,赵 勇1,2,3,*
(1.上海海洋大学食品学院,上海201306;2.农业部水产品贮藏保鲜质量安全风险评估实验室,上海201306;3.上海水产品加工及贮藏工程技术研究中心,上海201306)
采用三种方法(结晶紫染色法、荧光显微镜法、扫描电镜法)观察了两株分离自食品中的副溶血性弧菌Vp8和Vp32在4℃条件下的生物被膜形成情况,旨在为进一步研究低温条件下副溶血性弧菌生物被膜提供依据。结果表明:三种观察方法所得结果基本一致,Vp8有大量生物被膜形成,而Vp32几乎没有生物被膜形成。结论:在副溶血性弧菌生物被膜的研究中,各种观察方法各有利弊,可根据不同实验室条件或不同研究需求选择合适的观察方法。
副溶血性弧菌,生物被膜,结晶紫染色,荧光显微镜,扫描电镜
细菌生物被膜(Bacterial biofilm)是指单一或多种细菌为适应周围环境,附着于载体(塑料、金属、医疗植入材料和人体组织等)的表面,由细菌及其自身分泌的聚合性含水基质包裹而形成的聚集物,其主要成分包括多糖基质、纤维蛋白、脂蛋白、胞外DNA等。生物被膜中的细菌对各种物理、化学、生物学的应激反应均不敏感,尤其对抗菌类药物的敏感性显著降低[1-3]。由于生物被膜中的细菌可以抵抗宿主免疫应答,较浮游态细菌对抗生素耐药性更强(达到1000倍),这就使得常规的杀菌方法不能有效灭菌,并且从生物被膜中分离出来的细胞将进一步转变为持续污染源,因而由细菌生物被膜引起的污染尤其难治[4-5]。副溶血性弧菌是一种广泛存在于海水,海底沉积物以及鱼、虾、贝等海产品中的常见革兰氏阴性嗜盐细菌[6],是海水养殖中的一种重要的条件致病菌,也是我国沿海地区食物中毒和夏季腹泻的重要病原,已经高居微生物性食物中毒首位[7-8]。选择适宜观察方法评估副溶血性弧菌生物被膜形成能力对有效控制和清除食品加工过程中的副溶血性生物被膜污染具有重要意义。目前生物被膜的常用观察方法主要有刚果红实验、结晶紫染色法、银染法、荧光显微镜、扫描电镜或激光共聚焦扫描显微镜法等,均为表性检查方法[9]。
本文采用三种方法(结晶紫染色法、荧光显微镜法、扫描电镜法)观察了两株副溶血性弧菌在4℃条件下的生物被膜形成情况,从准确性、灵敏度、成本及检测速度等方面比较了三种方法的优缺点,以期为副溶血性弧菌生物被膜的研究提供一定的方法依据。
1 材料与方法
1.1 材料与仪器
副溶血性弧菌菌株来源及基因型见表1。

表1 副溶血性弧菌菌株来源及基因型Table 1 The source and genotype of vibrio parahaemolyticus
乙醇 上海展云化工有限公司,分析纯;氯化钠 上海生工生物工程有限公司,分析纯;胰蛋白胨大豆肉汤培养基 TSB,北京陆桥技术有限责任公司。
24孔板、96孔板 上海生物工程有限公司;BioTek多功能酶标仪 基因有限公司;摇床 江苏环宇科学仪器厂;荧光显微镜 卡尔蔡司有限公司;扫描电镜 日本株式会社日立制作所。
1.2 实验方法
1.2.1 种子液的获得 将副溶血性弧菌接种于含5m L TSB[含3%(W/V)NaCl,下同]的试管中,37℃、180r/min摇床培养10h,连续活化2次,至OD600=0.6,作为种子液。
1.2.2 菌液制备 将所得种子液用TSB按1∶100的比例进行稀释,取1m L稀释后的菌液置于24孔板中37℃培养24h,随后移至4℃静置贮藏24h。
1.2.3 结晶紫染色 将1.2.2中24孔板取出,移除菌液,加入1.5m L 0.1mol/L磷酸盐缓冲液(pH=8.0)清洗两次,去除浮游菌体。加入1m L 0.1%(W/V)的结晶紫染液在室温下染色30min,吸水纸吸掉染料后,再用0.1mol/L磷酸盐缓冲液清洗三次,将其置于60℃烘箱中干燥30min,然后加入1m L 95%乙醇,检测其在570nm条件下的吸光值(OD570)[10-11]。以新鲜TSB培养基为阴性对照,每个实验重复三次。
1.2.4 荧光显微镜 将24孔板取出,移除菌液,加入0.1mol/L磷酸盐缓冲液清洗三次,去除悬浮的菌体。用4%(v/v)戊二醛磷酸盐缓冲液在4℃条件下固定2h,加入0.1mol/L磷酸盐缓冲液清洗三次,用SYBR GreenⅠ(1∶100000)染色30m in。再用0.1mol/L磷酸盐缓冲液清洗三次,制作成载玻片置于荧光显微镜下观察细菌生物被膜形成情况[12]。
1.2.5 扫描电镜 将24孔板取出,移除菌液,加入0.1mol/L磷酸盐缓冲液清洗三次,去除浮游菌体。加入2.5%(v/v)戊二醛磷酸盐缓冲液置于4℃静置过夜,再用0.1mol/L磷酸盐缓冲液清洗三次,每次10m in。然后样品用1%锇酸室温下固定1h,固定完成后用0.1mol/L磷酸盐缓冲液清洗三次,每次10m in。然后分别用30%、50%、70%和90%乙醇脱水10min,100%乙醇脱水三次,每次10m in,样品用乙酸异戊酯处理两次,每次15min。将脱水样品在临界点干燥器干燥5h后喷金,扫描电镜下观察副溶血性弧菌生物被膜形成情况[13]。
1.3 数据处理与分析
结晶紫染色数据处理与分析:以新鲜TSB培养基所测得的OD值作为对照,以该值的两倍(ODc)为临界值,将菌株被膜的形成分为以下4类:强生物被膜形成OD>4ODc,中等被膜形成2ODc<OD≤4ODc,弱生物被膜形成ODc<OD≤2ODc和无生物被膜形成OD≤ODc[8]。
2 结果与讨论
2.1 结晶紫染色法观察副溶血性弧菌生物被膜形成状况
采用结晶紫染色方法检测Vp8和Vp32在4℃静置贮藏24h后的生物被膜形成情况,以570nm条件下吸光度值的高低表示被膜形成量的多少。结果如表2所示,以新鲜TSB培养基测得的OD570值0.09作为对照,ODc为0.18。由表2可知,Vp8的OD570是ODc的19.65倍,因而可以判定Vp8为强生物被膜形成;Vp32的OD570<ODc,因而可以判定Vp32无生物被膜形成。实验结果表明在相同条件下,不同的菌株有不同的生物被膜形成情况。李燕等[9]对临床分离的45株表皮葡萄球菌采用结晶紫染色法进行检测,发现有18株有生物被膜形成,其余27株无生物被膜形成。生物被膜的形成是一个复杂耗时的多基因调控、多因子参与的过程,已有研究表明aphA对副溶血性弧菌生物被膜的形成有影响[14]。
利用生物被膜内物质可以与结晶紫染料结合的特点,可以通过染色的方法对生物被膜进行定性或定量的分析。如果过程中着色较深说明生物被膜形成比较成熟,如果着色较浅则说明生物被膜基本没有形成或牢固度不够。结晶紫染色法简单、快捷、价格低廉、对实验条件要求较低,可用于实验室对生物被膜形成能力的半定量研究。但结晶紫染色法操作费力,难于标准化,此外,该方法只测量了细菌生物量而不是生物被膜的细胞活力[15]。已有不同的研究表明清洗条件(步骤、自动化、水、磷酸缓冲液等),结晶紫的持续时间,结晶紫浓度等都会对结果造成显著影响[16-17]。

表2 副溶血性弧菌Vp8和Vp32在4℃静置贮藏24h后OD570Table 2 The OD570of Vp8 and Vp32 under 4℃for 24h
2.2 荧光显微镜法观察副溶血性弧菌生物被膜形成状况
荧光显微镜法用SYBR GreenⅠ对生物被膜进行染色,观察Vp8和Vp32在4℃静置贮藏24h后的生物被膜形成情况。由图1可知,Vp8形成了典型的多细胞聚集的生物被膜结构,该结构覆盖了材料表面的大部分,荧光强度较强。而Vp32则呈单细胞分布,并没有形成明显的细菌聚集,荧光强度也较弱。由荧光显微镜观察结果可知:Vp8有大量生物被膜形成,而Vp32则无生物被膜形成。此方法观察结果与结晶紫染色法所得结果一致。SYBR GreenⅠ会与生物被膜内物质结合,结合后其荧光信号会大大增强,可判断物体的形状及其所在位置。
荧光显微镜法对实验条件要求较低,价格较低廉,耗时较短,可观察到细菌大量聚集在一起,但不能进行定量检测,可用于实验室对生物被膜形态的初步观察。在染色的过程中生物被膜会受到染色试剂的影响,其结构形态可能会发生不同程度的改变。另外荧光显微镜法只能初步观察细菌生物被膜的表层现象,无法对被膜内层结构和生理学现象进行观察[18]

图1 Vp8和Vp32生物被膜荧光显微镜图片(×400)Fig.1 The fluorescencemicroscope images of biofilms of Vp8 and Vp32(×400)
2.3 扫描电镜法观察副溶血性弧菌生物被膜形成状况
图2为采用扫描电镜法观察Vp8和Vp32在4℃静置贮藏24h后的被膜形成情况。由图2可知,Vp8大量聚集在一起且被胞外聚合物包围,细菌嵌入生物被膜内部,菌体表面有隆起和凹陷,形成明显的皱褶,在微菌落中,细菌与细菌间有丝状连接;Vp32在相同条件下几乎无细菌聚集体及胞外聚合物的形成。由扫描电镜结果可知:Vp8有大量生物被膜形成,Vp32无生物被膜形成。该方法所得结果与前两种方法结果相一致。
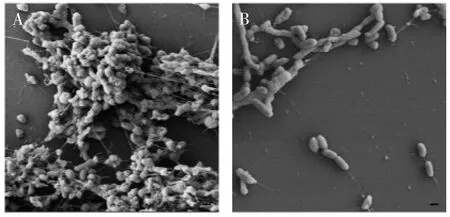
图2 Vp8和Vp32生物被膜扫描电镜图片Fig.2 The scanning electronmicroscope images of biofilms of Vp8 and Vp32
扫描电镜是一种定性观察微生物的方法,由于扫描倍数高,成像清晰,立体感强,可以清晰地观察到生物被膜内存在细菌聚集成团的现象,且细胞间有纤维样连结。因此,该法可很好的用于生物被膜形态学方面的鉴定,其结果更准确、可靠,被认为是检测生物膜形成能力的“金标准”,适用于高灵敏度观察的实验[19]。但扫描电镜法耗时长,对实验条件要求高,也不能进行定量检测,且在操作中需要固定及脱水处理,容易破坏生物被膜的结构引起实验假象,且价格昂贵,难以满足实验室对生物膜形成能力的评估要求,不宜做常规检测。
3 结论
生物被膜的形成是细菌为适应自然环境而采取的策略,任何细菌在成熟条件下都可以形成生物被膜[20]。本文分别比较研究了结晶紫染色法、荧光显微镜法和扫描电镜法三种不同的方法观察副溶血性弧菌生物被膜形成情况。三种观察方法所得结果一致:Vp8有大量生物被膜形成,Vp32几乎无生物被膜形成。
总之,副溶血性弧菌生物被膜形成能力的观察对有效控制和清除食品加工过程中的副溶血性生物被膜污染具有重要意义。随着对生物被膜研究的不断深入,用于细菌生物被膜形成能力的检测方法种类会越来越多,但如何提高细菌生物被膜的检测水平,建立快速、灵敏、准确的检测方法,并且研制出简便、特异的检测试剂盒应用于生产,将会是今后研究的重要内容。
[1]Kilty SJ,DuvalM,Chan FT,etal.Methylglyoxal:(active agent of manukahoney)in vitro activity against bacterial biofilms[J]. International Forum of Allergy&Rhinology,2011,1(5):348-350.
[2]Jones WL,Sutton MP,McKittrick L,et al.Chemical and antimicrobial treatments change the viscoelastic properties of bacterial biofilms[J].Biofouling,2011,27(2):207-215.
[3]Mah T-FC,O'Toole GA.Mechanisms of biofilm resistance to antimicrobial agents[J].Trends in Microbiology,2001,9(1):34-39.
[4]Bordi C,de Bentzmann S.Hacking into bacterial biofilms:a new therapeutic challenge[J].Annals of Intensive Care,2011,1(1):19-19.
[5]李燕杰,朱小花,阴冠秀,等.不同方法观察单增李斯特菌生物被膜的比较研究[J].食品工业科技,2010,31(10):241-246.
[6]李沁,彭织云,陈鑫鹏,等.副溶血性弧菌毒力基因表达时内参基因的选择[J].微生物学报,2013,53(3):306-312.
[7]陈瑞英,鲁建章,苏意诚,等.食品中副溶血性弧菌的危害分析、检测与预防控制[J].食品科学,2007,28(1):341-347.
[8]苏靖华,章红红,傅慧琴,等.副溶血性弧菌160株血清群型分布和耐药性分析[J].上海预防医学,2012,24(3):135-138.
[9]李燕,李冬冬,陶传敏,等.4种方法检测表皮葡萄球菌生物膜形成能力的应用价值探讨[J].中国实验诊断学,2011,15(3):424-427.
[10]Stepanovic S,Vukovic D,Dakic I,etal.Amodified microtiterplate test for quantification of staphylococcal biofilm formation[J]. Journal of Microbiological Methods,2000,40(2):175-179.
[11]Sachin R Kadam,Heidy MW den Besten,Stijn van derVeen,et al.Diversity assessment of Listeria monocytogenes biofilm formation:Impact of growth condition,serotype and strain origin[J].International Journal of Food Microbiology,2013,165(3):259-264.
[12]Prieto C,Serra DO,Martina P,et al.Evaluation of biofilmforming capacity of Moraxella bovis,the primary causative agentof infectious bovine kerato conjunctivitis[J].Veterinary Microbiology,2013,166(3-4):504-515.
[13]Jung JH,Choi NY,Lee SY.Biofilm formation and exopolysaccharide(EPS)production by Cronobacter sakazakii depending on environmental conditions[J].Food Microbiology,2013,34(1):70-80.
[14]Wang L,Ling Y,Jiang H,et al.AphA is required for biofilm formation, motility, and virulence in pandemic Vibrio parahaemolyticus[J].International Journal of Food Microbiology,2013,160(3):245-251.
[15]Crémet L,Corvec S,Batard E,et al.Comparison of three methods to study biofilm formation by clinical strains of Escherichia coli[J].Diagnostic Microbiology and Infectious Disease,2013,75(3):252-255.
[16]Naves P,del Prado G,Huelves L,et al.Correlation between virulence factors and in vitro biofilm formation by Escherichia coli strains[J].Microbial Pathogenesis,2008,45(2):86-91.
[17]Reisner A,Krogfelt KA,Klein BM,et al.In vitro biofilm formation of commensal and pathogenic Escherichia coli strains:impact of environmental and genetic factors[J].Journal of Bacteriology,2006,188(10):3572-3581.
[18]胡锦松,陈豪泰,张杰,等.细菌生物被膜鉴定方法的研究进展[J].中国兽医科学,2010,40(11):1194-1199.
[19]聂鑫,高原.细菌生物被膜检测方法研究进展[J].黑龙江畜牧兽医,2012(11):24-26.
[20]Costerton JW,Stewart PS,Greenberg EP.Bacterial biofilms:A common cause of persistent infections[J].Science(Washington D C),1999,284(5418):1318-1322.
Applied three methods to observe biofilms of Vibrio parahaemolyticus
LAN Ying1,GUO Zhuo-ran1,FU Jiao-jiao1,PAN Ying-jie1,2,3,ZHAO Yong1,2,3,*
(1.College of Food Science and Technology,ShanghaiOcean University,Shanghai201306,China;2.Shanghai Engineering Research Center of Aquatic-Product Processing&Preservation,Shanghai201306,China;3.Laboratory of Quality&Safety Risk Assessment for Aquatic Products on Storage and Preservation(Shanghai),Ministry of Agriculture,Shanghai201306,China)
Methods(crystalviolet staining,fluorescence microscope,scanning electron microscope)were app lied to observe biofilms of Vibrio parahae molyticus(Vp8 and Vp32)at4℃,in order to lay a foundation for the further study of Vibrio parahaemolyticus under the condition of low temperature.The results showed that Vp8 could be considered as strong biofilm producers while Vp32 was negative.Conclusion:Each method had its advantages and disadvantages,thus an appropriate method could be selected depending on the condition of laboratory or the study demanding.
vibrio parahaemolyticu;biofilm;crystal violet staining;fluorescence microscope;scanning electron microscope
TS201.3
A
1002-0306(2015)08-0183-04
10.13386/j.issn1002-0306.2015.08.029
2014-07-15
蓝英(1990-),女,硕士研究生,研究方向:食品安全。
*通讯作者:赵勇(1975-),男,博士,教授,研究方向:食品安全。
国家自然科学基金面上项目(31271870);上海市科委计划项目(14DZ1205100,14320502100,12391901300);上海市科技兴农重点攻关项目(沪农科攻字2014第3-5号)。
