壳寡糖对壳聚糖-明胶-壳寡糖三元复合膜的性能影响研究
2015-10-24王亚珍邵则淮
王亚珍,谢 晶,李 立,薛 斌,邵则淮,孙 涛
(上海海洋大学食品学院,上海201306)
壳寡糖对壳聚糖-明胶-壳寡糖三元复合膜的性能影响研究
王亚珍,谢 晶,李 立,薛 斌,邵则淮,孙 涛*
(上海海洋大学食品学院,上海201306)
以壳聚糖、明胶和壳寡糖进行了复合膜的制备,通过红外光谱表征了其结构,考察壳寡糖添加量对复合膜物理、机械、抗氧化和抑菌性能的影响。结果表明,壳聚糖、明胶、壳寡糖三者之间发生氢键相互作用。适量壳寡糖的加入,可增强复合膜的亲水性,改善力学性能及水蒸气阻隔性能,显著提高复合膜的抗氧化性能和抑菌活性(p<0.05)。壳聚糖与明胶的质量比为2∶3,甘油含量为1%(v/v),添加30%的壳寡糖,复合膜的DPPH自由基清除率提高了7.03倍,对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别增大了32%和30%。
壳寡糖,复合膜,机械性能,抗氧化性,抑菌性能
壳聚糖是甲壳素脱乙酰基后的产物,是自然界中唯一的碱性天然多糖。壳聚糖安全无毒、易于生物降解,且具有优良的成膜性、生物相容性和抗菌性[1-3]等,在保鲜包装方面有着广阔的应用前景。明胶来源广泛,价格低廉,成膜性好,也是一种可降解的天然膜材料。单一的壳聚糖膜,力学性能较差,将明胶与壳聚糖共混制膜,可以改善壳聚糖膜的力学性能[4]。但由于壳聚糖几乎不具有抗氧化活性,且抑菌谱较窄[5],这些缺点限制了壳聚糖作为食品包装膜的应用范围。添加天然的抗氧化剂和抗菌剂,提高壳聚糖复合膜的抗氧化性能以及抑菌性,可以拓宽壳聚糖复合膜在食品包装方面的应用[6]。
壳寡糖是壳聚糖降解以后的产物,具有良好的水溶性,基本没有成膜性。由于与壳聚糖具有相同的结构单元,因此二者具有良好的相容性。与壳聚糖相比,壳寡糖具有良好的抗氧化性能及抑菌活性[7-8]。
本文以溶液共混法制备壳聚糖-明胶-壳寡糖复合膜,研究壳寡糖添加量对复合膜的物理性质、机械性能、阻隔性能、抗氧化性能及抑菌性能的影响,以期制备一种综合性能优良的食品包装膜。
1 材料与方法
1.1 材料与仪器
壳聚糖 分子量10万,脱乙酰度90%,浙江金壳药业有限公司;明胶 食品级,国药集团化学试剂有限公司;壳寡糖 分子量1000,脱乙酰度90%,浙江金壳药业有限公司;DPPH(1,1-二苯基-2-苦基肼) 分析纯,Sigma公司;冰醋酸、甘油、无水氯化钙、硝酸镁 均为分析纯,购自国药集团化学试剂有限公司;金龙鱼葵花籽油 市售;胰蛋白胨大豆肉汤 北京路桥技术有限公司;营养琼脂 北京奥博星生物技术有限责任公司;大肠杆菌(Escherichia coli)、金色葡萄球菌(Staphylococcus aureus) 由上海海洋大学食品学院提供。
FTIR-650傅里叶变换红外光谱仪 天津港东科技发展股份有限公司;DCP-KZ300型电脑测控抗张实验机 四川长江造纸仪器有限责任公司;UV-2000型紫外分光光度计 上海龙尼柯仪器有限公司;恒温磁力搅拌器 上海雷磁新泾仪器有限公司;HHS型电热恒温水浴锅 上海博讯实业有限公司医疗设备厂;YXQ-SG46-280S型手提式压力蒸汽灭菌锅 上海博迅实业有限公司;SW-CJ-1F型净化工作台 苏净集团苏州安泰空气技术有限公司;PYX-DHS-40X50BS型隔水式电热恒温培养箱 上海跃进医疗器械厂;数显卡尺 上海量具刃具厂有限公司。
1.2 实验方法
1.2.1 膜的制备 将壳聚糖溶于1%(v/v)的醋酸溶液中,制成2%(w/v)的壳聚糖溶液,与6%的明胶溶液按2∶1的比例混合,即壳聚糖与明胶质量比为2∶3,然后分别加入1%(v/v)甘油及不同质量的壳寡糖,其中壳寡糖的添加量分别为壳聚糖及明胶总质量的10%、20%、30%、40%、50%,磁力搅拌至完全溶解。静置消泡后,取75m L膜液均匀铺展于干燥洁净的有机玻璃板(20cm× 30cm)上,自然干燥后揭膜,保存于相对湿度(RH)为53%(用饱和硝酸镁溶液保持)的干燥器内备用。
1.2.2 复合膜的结构表征 用FTIR-650傅里叶变换红外光谱仪对复合膜的结构进行表征。测试条件如下:测试范围为4000~500cm-1,扫描次数为8次,分辨率为2cm-1。
1.2.3 复合膜的性能测试
1.2.3.1 机械性能 膜的机械性能参照GB13022-91《塑料、薄膜拉伸性能实验方法》,采用电脑测控抗张实验机测定。测试前将待测膜裁成长150mm宽15mm的长条形试样,作出标距50mm,然后在(23±1)℃、53%RH条件下平衡两天,备用。实验条件:拉伸速度为150mm/m in,夹具间距50mm,测试环境温度为(23±1)℃,湿度为50%。每组膜测定6次。
按下式计算抗张强度(Tensile strength,TS):
TS=F/bd
式中:TS—抗张强度(MPa);F—最大载荷(N);b—试样宽度(mm);d—试样厚度(mm)。
按下式计算断裂伸长率(Elongation at break,E):
E(%)=(G-G0)/G0×100
式中:E—断裂伸长率(%);G0—试样原始标线间的距离(mm);G—试样断裂时标线间的距离(mm)。
1.2.3.2 透湿性 根据GB-1037-70,采用拟杯子法,在25mm×40mm的称量瓶中放入粉碎干燥过的无水CaCl2。把制备好的完整薄膜盖在瓶口,密封,将其置于底部有一定量蒸馏水的干燥器中,使试样两侧保持一定的蒸汽压差,每隔24h测量称量瓶重量的变化,计算水蒸气透过系数(Water vapor permeability,WVP)[9]。每种膜做3组平行实验,到前后两次质量的增加量相差不超过5%时,方可结束实验。
按下式计算水蒸气透过系数(WVP):
WVP=q/t·d·s·△p
式中:WVP—水蒸气透过系数(g·mm/m2·h· kPa);q/t—单位时间内透湿杯增加重量的算术平均值(g/h);d—试样厚度(mm),本实验采用同一张膜上5个以上不同部位测量值的平均值;s—试样的实验面积(m2);△p—试样两侧的蒸汽压差(kPa)。
1.2.3.3 溶胀度 将膜剪成2cm×2cm称重(m1),室温下浸入30m L蒸馏水中,30m in后取出,用滤纸迅速吸干表面的水,称重(m2),根据膜质量变化计算溶胀度(Swelling degree,SR)[10]。
按下式计算溶胀度(SR):
SR(%)=[(m2-m1)/m1]×100
1.2.3.4 水溶性 将膜切成40mm×40mm的正方形,在干燥器中干燥至恒重后称重(m1),然后放入300m L蒸馏水中,于室温25℃下溶解12h,再将膜在60℃的条件下干燥至恒重,称重(m2),根据膜质量变化计算水溶性[11]。
按下式计算水溶性:
水溶性(%)=[(m1-m2)/m1]×100
1.2.3.5 抗氧化性能 复合膜抗氧化性能的测定参照文献[6]并稍作调整。将0.5g膜样品放入装有30m L蒸馏水的烧杯中,浸泡24h后,得到复合膜浸泡液。将1m L浓度为0.001mol/L的DPPH无水乙醇溶液与3m L壳聚糖复合膜浸泡液混合。将混合液放入暗室反应30min,然后测定混合液在517nm处的吸光度值。每个样品做6次平行实验,结果取平均值。
按下式计算DPPH自由基清除率:
DPPH自由基清除率(%)=[1-(AS-A0)/ADPPH]×100
式中,ADPPH—DPPH无水乙醇溶液在517nm处的吸光度;AS—复合膜浸泡液和DPPH无水乙醇溶液混合液在517nm处的吸光度;A0—复合膜浸泡液和无水乙醇混合液在517nm处的吸光度。
1.2.3.6 抑菌活性 通过抑菌圈法判定复合膜的抑菌作用强弱[12]。挑取受试菌种(大肠杆菌和金黄色葡萄球菌)的单菌落接种于100m L液体培养基内,在37℃和转速100r/m in的摇床内培养18h。将活化好的菌用无菌生理盐水稀释十倍,作为初始菌液。将已灭菌并冷却至50℃的营养琼脂固体培养基倒入无菌平皿中,水平放置待凝固。吸取0.1m L初始菌液(106~107CFU/m L的菌悬液)加入到上述平皿中,用无菌三角棒涂布均匀。复合膜及滤纸分别用6mm的打孔器打孔,紫外杀菌30m in后,用无菌镊子将其贴于含有菌悬液的培养皿表面。将贴好待测膜片的含菌平皿倒置,放于37℃培养箱中,24h后取出,用游标卡尺测量抑菌圈的直径。无菌滤纸片为空白对照。实验采用三个平行样品,结果取平均值。
1.3 数据处理
实验最少重复3次,所有数据用SPSS17.0软件处理,得到的结果表示为平均值±标准误差;用Duncan's法进行方差分析。使用Origin 8.5软件作图。
2 结果与分析
2.1 复合膜的红外光谱分析
FT-IR是表征聚合物分子间相互作用的有效技术之一[13]。图1为纯壳聚糖膜、壳聚糖-明胶膜及壳聚糖-明胶-壳寡糖复合膜的FT-IR谱图。在纯壳聚糖膜的红外光谱图上,有1158cm-1及896cm-1的多糖结构吸收峰,这与文献[14]相符。在波数3260cm-1处较宽的吸收峰归属为-OH伸缩振动吸收峰和-NH伸缩振动吸收峰。在壳聚糖-明胶复合膜(壳寡糖添加量为0%)红外光谱上,1647cm-1处酰胺Ⅰ带的吸收峰向低波数移动,且吸收峰变宽,说明壳聚糖与明胶分子间形成了较强的氢键。添加壳寡糖后,随着含量的增大,复合膜的红外光谱图发生了一些变化。在1041cm-1附近的峰移向高波数,且变得越来越弱,说明部分C-O-C键的键能减弱,这可能导致复合膜机械性能的降低[15]。

图1 壳聚糖-明胶-壳寡糖三元复合膜的红外光谱图Fig.1 FTIR spectra of chitosan-gelatin-chitosan oligosaccharide ternary composite films
2.2 壳寡糖对复合膜的影响
2.2.1 抗张强度与断裂伸长率 壳寡糖添加量对复合膜机械性能的影响见表1。由表1可见,随着壳寡糖添加量的增加,复合膜的抗张强度表现出先增大后减小的趋势,当壳寡糖的添加量为10%时,抗张强度较壳聚糖-明胶膜显著提高(p<0.05);而当壳寡糖的含量增加至30%时,复合膜的抗张强度下降了34.8%;壳寡糖含量继续增加,复合膜的抗张强度显著下降(p<0.05)。复合膜的断裂伸长率则出现先降后升的情况,其中添加20%壳寡糖的复合膜相对于壳聚糖-明胶膜降低了54.5%,差异显著(p<0.05)。壳聚糖和明胶具有良好的成膜性,而不易成膜的壳寡糖会导致复合膜变脆,使膜的断裂伸长率下降。

表1 壳寡糖含量对复合膜机械性能的影响Table 1 Effects of COS content on mechanical properties of composite films
2.2.2 透湿性 壳寡糖含量对复合膜水蒸气透过系数的影响见图2。从图2可以看出,随着壳寡糖含量的增加,复合膜的水蒸气透过系数呈现出先下降后上升的趋势。壳寡糖添加量为10%时,复合膜的水蒸气透过率最小。
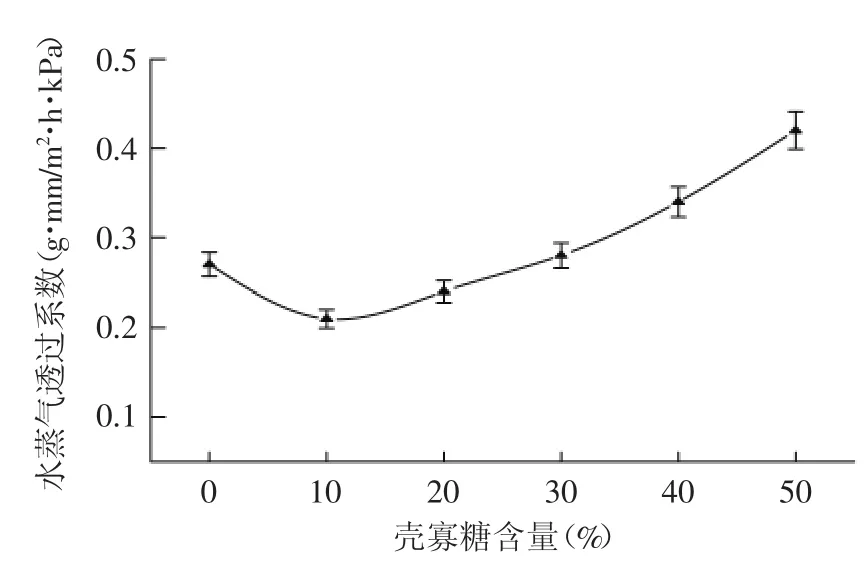
图2 壳寡糖含量对复合膜水蒸气透过率的影响Fig.2 Effects of COS content on water vapor permeability of composite films
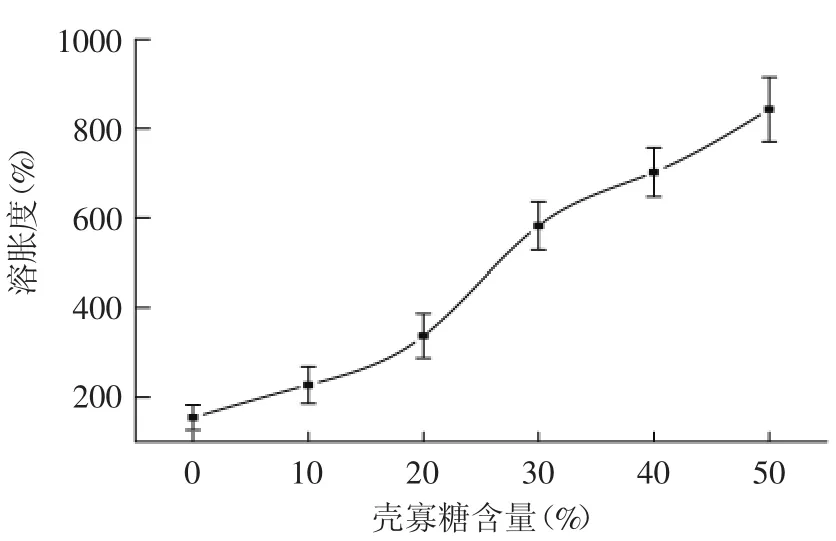
图3 壳寡糖含量对复合膜溶胀度的影响Fig.3 Effects of COS content on swelling degree of composite films
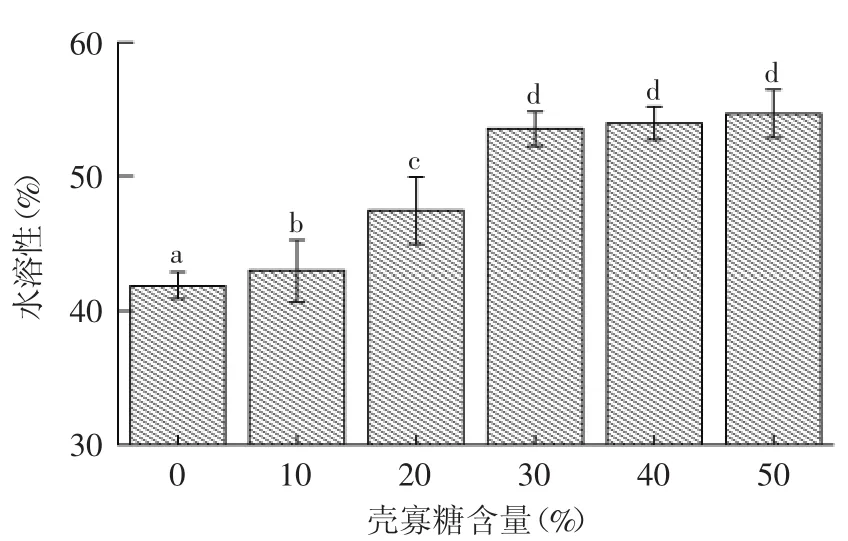
图4 壳寡糖含量对复合膜水溶性的影响Fig.4 Effects of COS content on solubility of composite films
2.2.3 溶胀度及水溶性 溶胀度及溶解性是评价膜性能的重要指标,可以反映复合膜的亲水性能。亲水基团越多,基团亲水性越好,则复合膜的溶胀度及水溶性越高。由图3和图4可以看出,膜的溶胀度随壳寡糖含量的增加而升高,水溶性显著(p<0.05)增强,当壳寡糖含量大于30%,水溶性变化差异不显著。这可能是由于壳寡糖本身易溶于水,因此导致复合膜溶胀性及水溶性的增大。
2.2.4 抗氧化性 DPPH自由基清除能力被认为是评价物质抗氧化能力的标准方法之一[16-17]。图5显示了复合膜清除DPPH自由基的能力。从图5中可以看到,未加壳寡糖的膜,其DPPH清除能力非常弱,随着壳寡糖添加量的增加,复合膜的DPPH自由基清除能力显著提高(p<0.05)。壳寡糖的添加量为30%时,复合膜的DPPH自由基清除率提高了7.03倍。当其添加量为50%时,复合膜的清除率最高,是未添加壳寡糖膜的10.83倍。
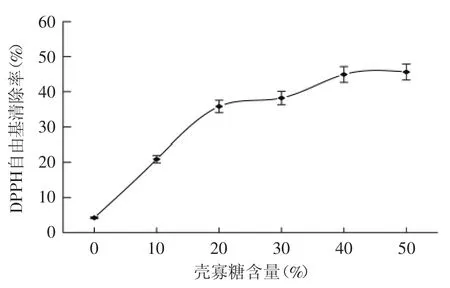
图5 壳寡糖含量对复合膜DPPH清除率的影响Fig.5 Effects of COS content on DPPH radical scavenging activity of composite films
2.2.5 抑菌性 表2显示了壳寡糖含量的变化对复合膜抑菌活性的影响。从表2中可以看出,壳聚糖-明胶膜及添加不同含量的壳寡糖复合膜对大肠杆菌和金黄色葡萄球菌都有一定的抑菌活性。且随着壳寡糖含量的增加,两种受试菌的抑菌圈直径显著(p<0.05)增大。当壳寡糖含量为30%时,复合膜对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别为9.38mm和9.21mm,相比未添加壳寡糖的壳聚糖-明胶膜分别增大了32%和30%,且复合膜对大肠杆菌的抑制效果优于金黄色葡萄球菌。

表2 壳寡糖含量对复合膜抑菌性能的影响Table 2 Effects of COS content on antibacterial activity of composite films
3 结论
以溶液共混法制备的壳聚糖-明胶-壳寡糖三元复合膜,相较于壳聚糖-明胶膜而言,适量壳寡糖的添加,增强了其亲水性,改善了其力学性能和水蒸气阻隔性能,显著提高了其抗氧化性能和抑菌活性(p<0.05)。当壳聚糖与明胶的质量比为2∶3,甘油含量为1%(v/v),壳寡糖添加量为10%时,复合膜的水蒸气透过率最小,抗张强度最大达53.35MPa;添加量为30%时,复合膜的DPPH自由基清除率提高了7.03倍,对大肠杆菌和金黄色葡萄球菌的抑菌圈直径分别增大了32%和30%。
[1]Ravi Kumar,Majeti N V.A review of chitin and chitosan applications[J].Reactive and Functional Polymers,2000,46(1):1-27.
[2]岳晓华,沈月新.可食性壳聚糖膜性能的研究[J].食品科学,2002,23(8):62-67.
[3]Dutta P,Tripathi S,Mehrotra GK,et al.Perspectives for chitosan based antimicrobial films in food applications[J].Food Chemistry,2009,114(4):1173-1182.
[4]董战峰,杜予民,藩李红,等.壳聚糖/明胶/TiO2三元复合膜的制备与功能特性[J].功能高分子学报,2004,17(1):61-66.
[5]冯永巍.壳聚糖的化学改性及其衍生物的抑菌活性研究[D].无锡:江南大学,2011.
[6]王丽岩.壳聚糖基活性包装膜的性能及其在食品贮藏中应用的研究[D].长春:吉林大学,2013.
[7]李晓晶.日粮中添加壳寡糖对肉仔鸡促生长、免疫调节和抗氧化作用的影响[D].北京:中国农业大学,2007.
[8]严钦,沈月新,王慥,等.壳寡糖的制备及其抑菌性能研究[J].食品研究与开发,2003,24(2):26-29.
[9]宫志强.可食性明胶-壳聚糖复合膜的制备及性能研究[D].济南:山东轻工业学院,2008.
[10]高美玲.海洋多糖生物可降解膜的制备与应用研究[D].无锡:江南大学,2011.
[11]岳晓华.可食性壳聚糖-淀粉复合膜的研究[J].食品科学,2004,25(增刊):7-10.
[12]Mehdi A,Masoud R,Gholamali F.A novel active bionanocomposite film incorporating rosemary essential oil and nanoclayinto chitosan[J].Journal of Food Engineering,2012,111(2):43-50.
[13]宋慧君,孟春丽,汤克勇.明胶-壳聚糖复合膜的制备与性能[J].高分子材料科学与工程,2011,27(8):165-167.
[14]FG Pearson,R H Marchessault,C Y Liang.Infrared spectra of crystalline polysaccharides V chitin[J].Polymer Science,2003,43(141):101-116.
[15]Liyan Wang,Yan Dong,Haitao Men,et al.Preparation and characterization of active films based on chitosan incorporated tea polyphenols[J].Food Hydrocolloid,2013,32:35-41.
[16]勾明玥,刘梁,张春枝.采用DPPH法测定26种植物的抗氧化活性[J].食品与发酵工业,2010,36(3):148-150.
[17]林恋竹,赵谋明.反应时间对DPPH法、ABTS法评价抗氧化结果的影响[J].食品科学,2010,31(5):63-67.
Effect of chitosan oligosaccharide on properties ofchitosan-gelatin-chitosan oligosaccharide ternary composite films
WANG Ya-zhen,XIE Jing,LILi,XUE Bin,SHAO Ze-huai,SUN Tao*
(College of Food Science&Technology,Shanghai Ocean University,Shanghai201306,China)
Composite film s of chitosan,gelatin and chitosan oligosaccharide(COS)were prepared.The films' structures were characterized by FT-IR.The effects of COS on physical,mechanical,antioxidant and antibacterial properties of the composite film were evaluated.The results showed that there were hydrogen bonding interactions among chitosan,gelatin and COS.The addition of proper content of COS increased the hyd rophilicity of composite films,moreover,the tensile strength,water vapor barrier properties were im p roved,and the antioxidant and antibacterial properties were significantly imp roved(p<0.05).Com posite film consisting of chitosan and gelatin with a weight ratio of 2∶3,1%g lycerin,30%COS showed some good properties.The DPPH radical scavenging activity was enhanced by 7.03 times,moreover,the diameters of inhibition zone against Escherichia coli and Staphylococcus aureus were enlarged by 32%and 30%respectively.
chitosan oligosaccharide;composite film;mechanical property;antioxidant property;antibacterial property
TS206.4
A
1002-0306(2015)08-0134-04
10.13386/j.issn1002-0306.2015.08.018
2014-05-09
王亚珍(1989-),女,在读硕士研究生,研究方向:多糖的改性及应用。
*通讯作者:孙涛(1970-),女,博士,副教授,研究方向:多糖的改性及生物功能的开发。
“十二五”国家支撑计划项目(2012BAD38B04)。
