蓬莪术干叶和鲜叶精油化学成分分析与抗氧化、抑菌活性研究
2015-10-24苟学梅周永红杨瑞武
王 茜,苟学梅,高 刚,周永红,杨瑞武,*
(1.四川农业大学生命科学学院,四川雅安625014;2.四川农业大学小麦研究所,四川温江611130)
蓬莪术干叶和鲜叶精油化学成分分析与抗氧化、抑菌活性研究
王 茜1,苟学梅1,高 刚1,周永红2,杨瑞武1,*
(1.四川农业大学生命科学学院,四川雅安625014;2.四川农业大学小麦研究所,四川温江611130)
通过GC/MS技术分析了蓬莪术叶片精油的化学组成,确定了各成分在精油中的相对含量,并采用清除DPPH自由基、清除ABTS自由基、抑制亚油酸脂质过氧化和抑制卵黄脂质过氧化能力,测定了精油的抗氧化能力,以滤纸片琼脂扩散法测定抗菌活性。结果表明:蓬莪术干叶中鉴定出31种成分,鲜叶中鉴定出36种成分,分别占总峰面积的83.05%和82.29%,主要由单萜烯类和倍半萜类组成,并含有微量的醇类、醛类、酮类和烷类等物质。蓬莪术叶精油对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌和沙门氏菌均有抑制作用,且随浓度的增加抑制作用增强。
蓬莪术,GC/MS,精油,化学成分,抗氧化,抗菌
蓬莪术(Curcuma phaeocaulis)为姜科姜黄属植物,是多年生单子叶草本植物,其主要成分为挥发油、姜黄素和多糖等。主要产于我国广西、云南等地,贵州也有分布。浙江温州地区产的叫温莪术(C. aromatica Salis),广西产的叫桂莪术(C.kwangsicensis S.G.lee et.G.Fliang),根茎、块茎可以入药。全世界姜黄属植物约60种,主要分布于东南亚和澳大利亚北部,喜玛拉雅海拔4000m高山上亦有分布。我国有16种,其中药用的有莪术(C.zedoaria Rose.)、姜黄(C.Longa L.)、印尼莪术(C.xanthonhiza Roxb)、广西莪术(C.Kwangsiensis S.G.Lee et.C.F.)、郁金(C.aromomatica Salisb)等5种以上。
近年来研究表明:莪术具有调节机体免疫反应,直接抑制和破坏癌细胞,拮抗致癌反应的作用,并已应用临床抗肿瘤治疗中。此外,还具有抗早孕、抗炎、抗菌和降酶等活性。用于疒徵瘕痞块,瘀血经闭,食积胀痛,早期宫颈癌[1]。
经研究发现,挥发油中抗肿瘤有效成分主要为β榄香烯[2]、莪术醇、莪术酮[3]、莪术二酮[4]和异莪术醇。以莪术油为原料的制剂,中国药典2000版收载有“莪术油葡萄糖注射液”,用于小儿病毒性肺炎[5]。挥发油的主要成分为姜黄烯、倍半萜烯醇、樟脑、莰烯、姜黄酮、芳姜黄酮等组分,具有特殊的香味,具有很好的抗氧化、抗菌、抗艾病毒、抗肿瘤[6]等作用。用水蒸气蒸馏法对四川、福建、广东、广西、云南等地区的姜黄挥发油提取工艺的研究也有很多[7],并且现在国内外对芳香植物和药用植物的精油和活性物质研究很多[8-9]。但是到目前为止,分析其结构成分、组成含量,并考察其抗氧化和体外抗菌活性,主要集中于对地下部分的分析,本实验针对其地上部分的叶片进行一系列分析,并为综合利用这一资源提供科学依据,希望其可以和根茎一样对开发新型精油应用于食品、烟草和医药等行业产生重要意义[10]。
1 材料与方法
1.1 材料与仪器
供试材料 采集于四川双流,由四川农业大学生命科学学院杨瑞武教授鉴定为姜科植物蓬莪术(Curcuma phaeocaulis Valeton);抗坏血酸(VC) 成都科龙化工试剂有限公司;2,2-二苯基-1-苦味基肼(DPPH) 美国Sigma公司;无水乙醇 成都科龙化工试剂有限公司;试剂 均为分析纯;实验用水 均为实验室自制双蒸水;2种革兰氏阳性菌为金黄色葡萄球菌和枯草芽孢杆菌(Staphylococcus aureus and Bacillus cereus),2种革兰氏阴性菌为沙门氏菌和大肠杆菌(Salmonella and Escherichia coli) 菌种均来自四川农业大学食品学院。
BDW 1-1KW万用电炉 北京科伟永兴仪器有限公司;BB89-2000型挥发油提取器 北京中西远大科技有限公司;QP2010 GC/MS 岛津公司;UV-3200PC型紫外分光扫描仪 上海美谱达仪器有限公司;BT-124S型电子天平 德国Sartorius公司;DHG-9240A型电热恒温鼓风干燥箱 上海一恒科技有限公司;FW 80型中草药粉碎机 南京飞宇制药设备有限公司;HWSY11-K型电热恒温水浴锅 北京市长风仪器仪表有限公司;H-1650型离心机 长沙湘仪仪器有限公司。
1.2 实验方法
1.2.1 GC-MS条件 色谱柱HP-5MS毛细管柱(30.0m× 250mm×0.25mm);载气为高纯氦气,流速1m L/m in,分流比50∶1,进样量0.1μL;程序升温:80℃恒温3min,8℃/m in升至140℃,保持6m in,2℃/m in升至170℃,保持2m in,10℃/m in升至250℃,保持3m in;进样温度250℃;倍增器电压1565eV;接口温度280℃;离子源温度230℃,电离方式EI;电子能量70eV;溶剂延迟3m in;扫描质量范围:45~550u。
1.2.2 挥发油提取 参照冯磊等方法[11]:自然阴干(指在室温下,通风处将材料吹干,每天测量其重量,直至连续3d测量重量不在变化即可)的蓬莪术叶片用粉碎机粉碎(鲜叶将新鲜的叶片剪成小段),再用电子天平称取50.000g材料粉末于圆底烧瓶中,加300m L的水,浸泡60m in。采用水蒸气蒸馏法提取挥发油,需蒸馏5h,用正己烷萃取3次,再用无水硫酸钠干燥,记下提取的挥发油量并计算提取得率,于低温(4℃)保存。
1.2.3 抗氧化活性研究
1.2.3.1 清除DPPH自由基 参照陆占国等方法[12]。方法稍有改进,用无水乙醇分别配制浓度为2.0、4.0、6.0、8.0、1.0mg/m L的精油溶液,配制同样浓度的VC溶液作为样品溶液。分别将2.0m L样品溶液和2.0m L浓度为1×10-4mol/L的DPPH溶液,混匀后暗处放置0.5h,以无水乙醇作参比,测定517nm处的吸光值A,同样测定2.0m L样品溶液与2.0m L无水乙醇混合后517nm处的吸光值A0,再测定2.0m L DPPH溶液与2.0m L无水乙醇混合液在517nm处的吸光值A1,重复三次,取平均值,按下式公式计算清除率:
清除率(%)=[1-(A-A0)/A1]×100
1.2.3.2 清除ABTS自由基 参照Delgado-Andrade等方法[13]。配制2mmol/L ABTS溶液,吸取50m L上述溶液与200m L K2S2O8溶液(70mmol/L)混合,暗处放置12~16h,得到ABTS自由基溶液。用磷酸缓冲液(PBS)将ABTS自由基溶液稀释至在734nm下吸光度为0.70± 0.02。用95%乙醇将精油稀释为5个浓度梯度溶液,分别为2.0、4.0、6.0、8.0、10.0mg/m L。取0.1m L溶液,加入1.9m L ABTS自由基溶液,在734nm测其吸光度。重复三次,取平均值,按下式公式计算清除率:
清除率(%)=(A0-A)/A0,其中A0为ABTS自由基溶液的吸光度,A为加精油溶液后的吸光度。
1.2.3.3 抑制亚油酸脂质过氧化 参照Zainola等方法[14]。用无水乙醇分别配制2.0、4.0、6.0、8.0、10.0mg/m L的孜然精油溶液、0.01%BHT(w/v)溶液和0.01%VC(w/v)溶液各5m L作为样品液。取4m L样品液,加入4.1m L 2.5%亚油酸(v/v),8m L磷酸缓冲液(pH=7.0),3.9m L蒸馏水,放于40℃恒温下培养。取上述培养液1m L,加入lm L 20%三氯乙酸,静置20m in。然后加入2m L 0.3%TBA溶液,在沸水中恒温10m in,取出室温下冷却。3000r/m in离心20m in,取上清液在532nm下测定吸光度值。平行测定三次,取平均值。
1.2.3.4 抗脂质过氧化能力测定 以TBA法测定待测挥发油对卵黄脂质过氧化的影响[15-16]。卵黄悬液的配制:新鲜鸡蛋去卵清,卵黄用等体积的pH 7.4的0.1mol/L PBS配成1∶1悬液,并用磁力搅拌器搅拌10m in,4℃冷藏备用,使用前用PBS稀释成1∶25的悬液。吸取1∶25的卵黄悬液20μL,加入20μL的不同质量浓度待测精油溶液(反应体系中的终质量浓度为50、100、150、200、250mg/L),再加入20μL的7.5mmol/L的FeSO4,用pH7.4,0.1mol/L的PBS补至200μL,37℃振荡15min,取出后再加入50μL的体积分数20%的三氯乙酸,5740×g离心8m in,吸取上清液100μL,加入50μL质量分数0.8%的TBA溶液,封口,沸水浴中煮15m in,在532nm波长处测定各孔吸光度。以不加样品管的吸光度为A0,以样品加PBS管的吸光度为A1。精油对卵黄脂质过氧化抑制率按下式计算。相同实验重复3次,结果取3次平均值。
抑制率(%)=[(A0-A+A1)/A0]×100
1.2.4 抑菌活性研究
1.2.4.1 培养基的制备 牛肉膏蛋白胨培养基:牛肉膏3g、蛋白胨10g、琼脂18g、NaCl 5g、蒸馏水1000m L、pH7.2~7.4,然后121℃蒸汽灭菌30min。
1.2.4.2 抑菌活性的测定 参照王世强方法[17]并修改。将高压灭菌的培养基倒入无菌的直径9cm培养皿内,厚度约为2mm,待培养基冷凝后,加入0.1m L菌悬液,均匀涂布平板,然后用直径为6mm无菌金属打孔器在平板中央位置打孔,并用移液器吸取一滴培养基封底。然后孔内加入30μL精油。以上操作均在无菌条件下进行。然后将培养皿置于恒温培养箱中培养(细菌置于37℃恒温培养箱中培养24~48h)。然后测量抑菌直径的大小,取平均值。如果抑菌剂能杀死或者抑制平板中病原菌生长,则在孔的周围会出现一个无菌生长的透明圈即抑菌圈。以抑菌圈的直径作为评定指标,即抑菌圈直径越大说明该抑菌剂对此种病原菌的抑制效果越好,反之则抑制效果越差。
抑菌圈实验判定标准[18]:抑菌圈直径大于20mm,极敏;15~20mm,高敏;10~15mm,中敏;7~9mm,低敏;小于7mm,不敏感。
2 结果与分析
2.1 精油的提取与分析
2.1.1 干叶和鲜叶精油得率的比较 通过对蓬莪术鲜叶和干叶精油含量的多次测定,得出两组数据,结果表明蓬莪术鲜叶精油得率为0.83%,干叶精油得率为1.63%,干叶的精油较鲜叶的高0.80%。

表1 干叶和鲜叶精油成分的比较Table 1 Comparison of essential oil of components between dried leaves and fresh leaves
2.1.2 干叶与鲜叶GC-MS分析 蓬莪术精油通过GCMS-QP2010分析,经该仪器适配的NBS库谱检索,实验重复三次,取平均值,最终,从蓬莪术鲜叶精油中鉴定出36种物质,占总峰面积的82.29%,从干叶精油中鉴定出31种物质,占总峰面积的83.05%。精油的相对含量经数据处理按峰面积归一化法平均计算得出表1。

续表
从表1可以看出,蓬莪术鲜叶和干叶中成分基本相同,鲜叶比干叶多检测出5种成分,分别是三环庚烷(Tricyclo heptane)、二环庚二烯(Bicycloheptane)、蛇麻烯(Humulen)、α-香柠檬烯(alpha-Bergamotene)和α-金合欢烯(alpha-Farnesene),干叶中少的成分也许是在风干过程中某些成分被破坏造成的。同时,鲜叶中含量较高的有:姜黄二酮(curdione)为21.33%,姜黄醇(curcumol)为11.73%,蓬莪术环二烯(furanodiene)为9.26%,β-榄香烯(beta-Elemene)为4.69%,α-蒎烯(alpha-Pinene)为6.47%;干叶中含量较高的有姜黄二酮(curdione)为19.73%,姜黄醇(curcumol)为8.96%,蓬莪术环二烯(furanodiene)为6.93%,α-蒎烯(alpha-Pinene)为4.17%,1,2-环氧-4-乙烯基环己烷(1,2-Epoxy-4-vinylcyclohexane)为4.56%,β-蒎烯(beta-Pinene)为4.39%。
2.2 抗氧化活性分析
2.2.1 清除DPPH自由基 从图1可以看出,蓬莪术鲜叶和干叶精油对DPPH自由基具有较强的清除作用,随着浓度的增大,清除能力增强,可以从溶液颜色看出,颜色从紫色渐变为无色,当浓度达到8mg/m L时,鲜叶和干叶对DPPH自由基的清除能力分别达到83.96%和76.37%,但是,继续增加浓度,对DPPH的清除能力没有大幅度增加。但在任一浓度下,VC的清除能力总是高于鲜叶和干叶对DPPH的清除能力。
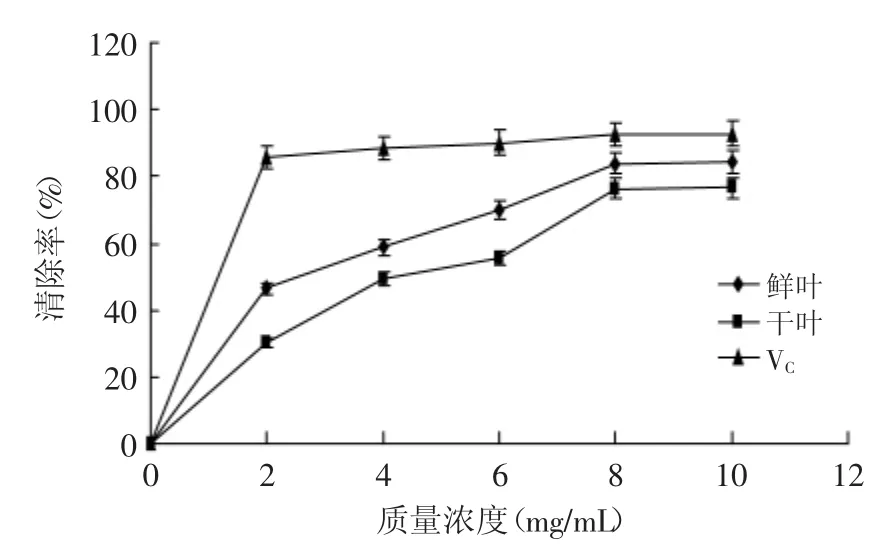
图1 DPPH自由基的清除能力Fig.1 2,2-diphenyl-1-picrylhydrazyl(DPPH)radical scavenging activity
2.2.2 清除ABTS自由基 从图2可以看出,蓬莪术鲜叶和干叶精油对ABTS自由基具有较强的清除作用,随着浓度的增大,清除能力增强,呈现一定的线性规律,当浓度达到8mg/m L时,鲜叶和干叶对ABTS自由基的清除能力分别达到74.34%和62.33%,但是,继续增加浓度,对DPPH的清除能力没有大幅度增加。但在任一浓度下,VC的清除能力总是高于鲜叶和干叶对DPPH的清除能力。当浓度达到10mg/m L时,鲜叶的清除能力基本接近VC。
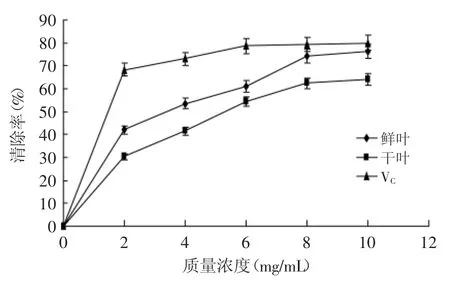
图2 ABTS自由基的清除能力Fig.2 ABTS radical scavenging activity
2.2.3 抑制亚油酸脂质过氧化 从图3可以看出所有的样品都显示出了抑制脂质过氧化的能力。同对照VC相比,干叶和鲜叶都表现出一定的抑制亚油酸氧化能力,但干叶精油抑制亚油酸氧化的能力比鲜叶和VC弱。当浓度达到10mg/m L时,VC的抑制能力达到81.93%,鲜叶和干叶的较低,分别为69.23%和59.08%,继续增加精油浓度时,其对亚油酸的抑制力基本保持平衡。实验表明,植物精油作为天然抗氧化剂用于食品生产、加工和贮存是可行的。
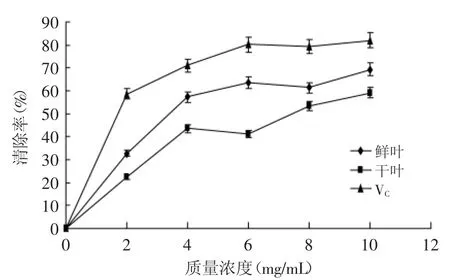
图3 抗亚油酸脂质氧化的能力Fig.3 Lipid peroxidation of linoleic acid inhibition
2.2.4 抑制卵黄脂质过氧化能力比较 由图4可看出,2种精油的浓度均能抑制卵黄脂质过氧化。蓬莪术鲜叶精油对脂质过氧化的抑制能力强于干叶的精油,当浓度达到8mg/m L时,鲜叶的抑制能力为65.57%,干叶的为46.88%,鲜叶的较干叶的高18.69%,但鲜叶和干叶精油对卵黄脂质过氧化的能力始终低于对照VC。

图4 抗卵黄脂质氧化的能力Fig.4 Against the peroxidation of unsaturated fatty acids in egg yolk
2.3 抑菌能力
从表2可以看出,蓬莪术干叶的精油对细菌具有一定的抑制作用,并且随浓度的增加抑制作用增强,总体上抑菌作用的强弱为:大肠杆菌>金黄色葡萄球菌>枯草芽孢杆菌>沙门氏菌。同时,当浓度达到1.0mg/m L时,大肠杆菌和金黄色葡萄球菌的抑菌圈都接近15mm,接近抑菌的高敏感水平。

表2 蓬莪术干叶对细菌的抑菌活性Table 2 Antimicrobial activity of the essential oil of Curcuma phaeocaulis dry leaves
从表3可以看出,蓬莪术鲜叶的精油对细菌有一定的抑制作用,同样,随浓度的增加抑制作用增强,抑菌作用的强弱为大肠杆菌>沙门氏菌>金黄色葡萄球菌>枯草芽孢杆菌。由表3可知,当浓度达到1.0mg/m L时,沙门氏菌、大肠杆菌和金黄色葡萄球菌达到高敏感水平。比较表2和表3,蓬莪术鲜叶精油对菌的抑制作用高于干叶精油。根据前人对植物精油抑菌机理的研究[19-21],普遍存在的现象是精油作用于微生物过程中,作用体系电导率增加,还原糖、蛋白等含量增加,表现出细胞膜渗漏的现象,可能也是蓬莪术叶本身精油抑菌的机理所在,且精油中含有一定量的醇、醛、酮类等化合物,均有一定的抑菌作用。

表3 蓬莪术鲜叶对细菌的抑菌活性Table 3 Antimicrobial activity of the essential oil of Curcuma phaeocaulis freash leaves
3 结论
3.1 从蓬莪术鲜叶精油中鉴定出36中物质,占总峰面积的82.29%,从干叶精油中鉴定出31种物质,占总峰面积的83.05%。干叶和鲜叶化学成分主要为蓬莪术环二烯(furanodiene)、姜黄二酮(curdione)、姜黄醇(curcumol)、α-蒎烯(alpha-Pinene)等。以上化学成分可能与蓬莪术精油特殊气味具有一定的关系,这需要做进一步的研究来证明。
3.2 在抗氧化活性方面,与维生素C相比,消除DPPH自由基和ABTS自由基时,蓬莪术干叶精油和鲜叶精油在相同浓度下弱于维生素C,但干叶精油和鲜叶精油两者还是存在一定的差异,干叶精油抗氧化性较强,同时,干叶精油和鲜叶精油在抗亚油酸脂质过氧化和卵黄抗氧化方面也表现出较强的能力,因而可说明蓬莪术干叶精油和鲜叶精油均具有较强的抗氧化能力。
3.3 蓬莪术叶精油的体外抑菌实验通过琼脂扩散法(也称滤纸片法)测得,滤纸片直径0.6cm。对金黄色葡萄球菌、枯草芽孢杆菌、沙门氏菌和大肠杆菌菌有很强的抗菌能力,尤其是鲜叶,当质量浓度达到1.0mg/m L,除了枯草芽孢杆菌,对其他3种供试菌都达到高敏感水平。可能是精油中含量较多的成分发挥作用,同时,精油中含有一定量的醇、酚、醛、醚类等化合物,这些化合物均有一定的抑菌作用。
[1]国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2000:230.
[2]傅乃武,全兰萍,郭永钿,等.β-榄香烯的抗肿瘤作用和药理学研究[J].中药通报,1984,9(2):35-39.
[3]中国医学科学院药物研究所编辑.中草药现代研究[M].北京:中国医科大学中国协和医科大学联合出版社,1992.
[4]陈淑莲,游静,王国俊.超临界流体萃取分析蓬莪术挥发性成分[J].中草药,2000,31(12):902-904.
[5]李爱群,胡学军,邓远辉,等.温莪术挥发油的成分[J].中草药,2001,32(9):782-783.
[6]余成浩,彭成,余葱葱.川产道地中药材蓬莪术的研究进展[J].时珍国医国药,2008,19(2):15-17.
[7]胡小军.正交法优化姜黄油提取工艺的研究[J].食品与药品,2007,9(5):4-6.
[8]M A Calvo1,E L Arosemena1,C Adelantado1,et al. Antimicrobial activity of plant natural extracts and essential oils[J].Science against microbial pathogens:communicating current research and technological advances,2011:1179-1185.
[9]A R Opoku,A O Oyedej.The chemical composition,antimicrobial and antioxidant properties of the essential oils of Tulbaghia violacea Harv.and Eucalyptus grandis W.Hill ex Maiden[D].Soyingbe Oluwagbemiga Sewanu,2012:1-108.
[10]BURT S.Essential oils:their antibacterial properties and potential applications in foods-a review[J].International Journal of Food Microbiology,Utrecht,2004,94(3):223-253.
[11]冯磊,敖宗华,陶文沂,等.莪术挥发油的提取工艺和主要成分测定[J].无锡轻工大学学报,2003,22(1):90-92.
[12]陆占国,郭红转,封丹.芜荽茎叶精油成分及清除DPPH自由基能力研究[J].食品与发酵工业,2006,32(8):24-27.
[13]Delgado A C,Rufian H J A,Morales F J.Assessing the antioxidant activity of melanoidins from coffee brews by different antioxidant methods[J].Journal of Agricultural and Food Chemistry,2005,3:7832-7836.
[14]Zainola M K,Abd-Hamida A,Yusof S.Antioxidative activity and total Phenolic compounds of leaf,root and Petiole of four aeeessions of Centella asiatiea(L.)Urban[J].Food Chemistry,2003,81(4):575-581.
[15]ZHAOYaping,YUWenli,WANGDapu.Chemiluminescence determination of free radical scavenging abilities of tea pigments and comparison with tea polyphenols[J].Food Chemistry,2003,80:115-118.
[16]Sukhdev Swami Handa,Suman Preet Singh Khanuja,Gennaro Longo,et al.Extraction Technologies for Medicinal and Aromatic Plants[M].Intenational Centre for Science and High Technology,2008:115-121
[17]王世强.打孔法测定抗生素的效价[J].生物学通报,2005,40(3):2.
[18]蔡一鸣,任荣清,文正常.中药方剂的抗菌实验[J].贵州兽牧兽医,1995,19(4):4-5.
[19]吴慧娟,黄杨名,陈科廷,等.神农香菊全草精油的化学成分及抑菌机理研究[J].食品科学,2012,33(17):35-39.
[20]Gill A O,Holly R A.Disruption of Escherichia coli,Listeria monocytogenes and Lactobacillus sakei cellular membranes by plantoil aromatics[J].International Journal of Food Microbiology,2006,108(1):1-9.
[21]张彬,缪存铅,宋庆,等.荷叶精油对肉类食品中常见致病菌的抑菌机理[J].食品科学,2010,31(19):63.
Comparative study of chemical composition,antioxidant activity and antibiosis of fresh and dry leaves essential oil of Curcuma phaeocaulis
WANG Qian1,GOU Xue-mei1,GAO Gang1,ZHOU Yong-hong2,YANG Rui-wu1,*
(1.College of Life Science,Sichuan Agricultural University,Ya'an 625014,China;2.Triticeae Research Institute,Sichuan Agricultural University,Wenjiang 611130,China)
The essential oil of leaves from Curcuma phaeocaulis variety were analyzed by GC/MS,and the relative contents of constituents were detemined.The antioxidant activity of the essential oil was evaluated by four methods about 2,2-diphenyl-1-picrylhydrazyl(DPPH)radical scavenging activity,ABTS radical scavenging activity,lip id peroxidation of linoleic acid inhibition and against the peroxidation of unsaturated fatty acids in egg yolk.The antimicrobial activity was analyzed by agar diffusion method.The results showed that:Curcuma phaeocaulis stem identified 31 components in leaves,identified 36 compounds in fresh leaves,respectively accounted for 83.05%and 82.29%of total area of the peak,and the main compounds of the essential oil were monoterpene alkenes and triterpenoid,also spirits,microscale aldehyde,ketone and alkane were inc luded. Antim ic robial activity of Myrica rub ra leaf essential oils was observed against Staphylococcus aureus,Bacillus cereus,Salmonella and Escherichia coli,and the inhibition increased with concentration of essentialoil increase.
Curcuma phaeocaulis;GC/MS;essentialoil;chemical composition;antioxidant;antimicrobial
TS201.1
A
1002-0306(2015)08-0097-06
10.13386/j.issn1002-0306.2015.08.011
2014-07-07
王茜(1988-),女,硕士研究生,研究方向:植物化学与成分分析。
*通讯作者:杨瑞武(1969-),博士,教授,主要从事植物系统与进化方面的研究。
国家自然科学基金(31270243)。
