MreB蛋白与actin蛋白的同源建模和进化关系研究
2015-10-24沈清清张玉洁
沈清清 ,刘 芳 ,赵 芳 ,张玉洁
(1.文山学院 环境与资源学院,云南 文山 663099;2.文山学院 化学与工程学院,云南 文山 663099)
肌动蛋白(actin)是1941年首先在脊椎动物骨骼细胞中发现并命名的一种蛋白,广泛存在于真核生物细胞膜、细胞质和细胞核中,是细胞骨架微丝的主要成分,在氨基酸序列组成和长度上( 374~376个氨基酸)具有高度保守性[1-4]。长期以来,人们认为细胞骨架仅存在于真核生物中,然而近十年来科研人员逐渐在许多种类的原核生物中也发现了细胞骨架蛋白,其中MreB蛋白就是一类与细菌和原核藻类形态维持密切相关的蛋白,且该蛋白在氨基酸序列组成、装配方式和功能等方面都与真核生物肌动蛋白具有高度相似性[5-7]。这一发现推动了学术界转换角度重新审视肌动蛋白的起源以及真核生物与原核生物的进化关系,并成为近年来的研究热点。生物大分子蛋白质的三级结构决定蛋白质的生物学功能,因此比较蛋白质的三级结构可以使我们了解蛋白之间的相互作用和进化关系,发现远程同源关系[8-9]。但是,目前已知的蛋白质序列数据库中,已经根据实验测出其结构和功能的蛋白质只占其中的小部分,大部分晶体结构尚未解析,因此利用一级氨基酸序列信息和已知蛋白质的空间结构信息来研究预测未知蛋白质的空间结构,已成为结构生物学中研究蛋白质结构和功能关系的主要手段[10]。当前实际有效的方法是蛋白质同源建模,即根据模板蛋白将一级序列转成3D结构的技术[11-13]。本研究拟采用生物信息学的手段和方法对几种原核MreB蛋白和真核actin蛋白进行同源建模,预测蛋白的三维结构,分析原核MreB蛋白和真核actin蛋白结构相关性和进化关系,旨在为实验尚不能攻克的生物细胞骨架蛋白起源和进化问题提供一些基础理论数据,同时也为MreB蛋白在系统发育学研究中的应用奠定理论基础和参考价值。
1 分析材料
从美国生物信息中心(National Center for Biotechnology Information,NCBI)蛋白数据库筛选出来自于19种细菌的MreB蛋白和16种真核生物的actin蛋白作为分析材料,选取的蛋白相关信息见表1。
2 方法
2.1 蛋白的同源建模
蛋白数据库(Rcsb-PDB)检索获得有价值的模板,利用SWISS-MEDOL服务器进行同源建模,获得蛋白的预测模型和相关参数。
2.2 预测模型的评估分析
利用在线工具PROCHECK对蛋白结构模型进行评估,获得蛋白模型的氨基酸残基二面角分布图(Ramachandran Plot),由图中相关参数评鉴模型的质量等级,确定其可信度与合理性。
2.3 预测模型的比对分析
利用可视化分析软件PyMOL叠合比对预测模型,分析蛋白三维结构的构象差异。
2.4 系统进化分析
应用序列比对软件ClustalX2.0对表1所列出的蛋白序列进行比对,根据比对结果用MEGA6构建NJ系统进化树。Bootstrap 分析中使用1000次重复计算NJ树的支持率。

表1 MreB蛋白和actin蛋白相关信息
3 结果与分析
3.1 MreB和actin蛋白的同源建模
3.1.1 同源建模模板的筛选
利用SWISS-MODEL对表1所列35种蛋白全部进行了同源建模,发现该软件检索系统为各蛋白建模所筛选出的最佳模板存在一定程度的重复性,如表2所示,其中SWISS-MODEL为克雷伯氏杆菌属的肺炎克雷伯氏菌、产酸克雷伯菌、鼻硬结克雷伯氏杆菌;埃希氏菌属的大肠杆菌、弗格森埃希菌、赫尔曼埃希菌、伤口埃希菌,气单胞菌属的维氏气单胞菌所选择的最佳模板均为4czm;为气单胞菌属的杀鲑气单胞菌、嗜水气单胞菌、豚鼠气单胞菌和类芽孢杆菌属的蜂房芽孢杆菌选择的模板均为4czf;为类芽孢杆菌属的胶质类芽胞杆菌、北方类芽孢杆菌、多粘类芽孢杆菌和乳酸杆菌属的干酪乳杆菌、短乳杆菌和加氏乳杆菌选择的模板均为2wus;为真菌中的酿酒酵母、黄曲霉和草酸青霉菌选择的模板均为1yag;为大变形虫、向日葵和鞘毛藻选择的模板均为4efh;为野猪和真蛸选择的模板均为3b5u;为大豆、大麦、铁皮石斛和水仙选择的模板均为3ci5。从以上数据可知不同类群的生物可能选择相同的模板进行同源建模,SWISSMODEL系统选择的模板蛋白与建模蛋白可能属于不同类群的生物,表明模板与建模蛋白并不存在类群或种属对称性。

表2 同源建模的模板信息
3.1.2 同源建模及质量评估
SWISS-MODEL预测系统中,用同一模板构建的模型存在相似性较高的特点,因此本文仅列出分别 以 4czm、4czf、2wus、4cze、1yag、4efh、2btf和3ci5为模板构建的8种生物(每个类群至少1种)的预测模型,结果如图1所示,A为肺炎克雷伯氏菌MreB蛋白模型,B为嗜水气单胞菌MreB蛋白模型,C为多粘类芽孢杆菌MreB蛋白模型,D为嗜酸乳酸杆菌MreB蛋白模型,E为草酸青霉菌actin蛋白模型,F为大变形虫actin蛋白模型,G为布氏双尾藻actin蛋白模型,H为大麦actin蛋白模型。

图2 蛋白氨基酸残基二面角分布图
为证实SWISS-MODEL系统同源建模模型的可靠性,对图1中构建的模型进行PROCHECK质量评估,结果如图2所示,A模型的蛋白氨基酸残基二面角分布图显示该模型99.3%的氨基酸残基落在允许区,其中93.5%落在最适区,5.4%落在附加区,0.4%落在宽容区,剩余0.7%落在非允许区;B模型的蛋白氨基酸残基二面角分布图显示该模型99.6%的氨基酸残基落在允许区,其中88.7%落在最适区,10.2%落在附加区,0.7%落在宽容区,剩余0.4%落在非允许区;C模型的蛋白氨基酸残基二面角分布图显示该模型100%的氨基酸残基落在允许区,其中92.8%落在最适区,6.5%落在附加区,0.7%落在宽容区;D模型的蛋白氨基酸残基二面角分布图显示该模型100%的氨基酸残基落在允许区,其中87.5%落在最适区,11.8%落在附加区,0.7%落在宽容区;E模型的蛋白氨基酸残基二面角分布图显示该模型100%的氨基酸残基落在允许区,其中92.5%落在最适区,7.5%落在附加区;F模型的蛋白氨基酸残基二面角分布图显示该模型99.7%的氨基酸残基落在允许区,其中92.2%落在最适区,7.5%落在附加区,剩余0.3%落在非允许区;G模型的蛋白氨基酸残基二面角分布图显示该模型98.8%的氨基酸残基落在允许区,其中82.8%落在最适区,15.3%落在附加区,0.6%落在宽容区,剩余1.2%落在非允许区;H模型的蛋白氨基酸残基二面角分布图显示该模型100%的氨基酸残基落在允许区,其中93.8%落在最适区,5.9%落在附加区,0.3%落在宽容区。以上结果表明通过SWISSMODEL构建的8个蛋白模型基本符合立体化学规则,有较高的合理性与可靠性,其中A、C、E、F、H模型均属高质量模型(落于最适区的氨基酸残基数 >90%)。
8个模型中A、B、C和D结构比较相似,E、F、G和H结构较为相似,因此A、B、C和D做第一组,E、F、G和H做第二组分别进行叠合比对处理,分别比较两组存在的差异。结果如图3A所示,PyMOL软件将肺炎克雷伯氏菌、嗜水气单胞菌、多粘类芽孢杆菌和嗜酸乳酸杆菌的MreB蛋白模型叠合比对后得出的RMSD值为0.951,4个蛋白的骨架折叠非常相似,α螺旋和β折叠在数量和构型上都很接近,表明核心结构差别不大,主要在Ⅰ、Ⅱ和Ⅲ表面环区空间结构上存在较大差异;如图2B所示,将草酸青霉菌、大变形虫、布氏双尾藻和大麦actin蛋白模型叠合比对后PyMOL软件计算的RMSD值为0.535,4个蛋白的骨架折叠也非常相似,α螺旋和β折叠在数量和构型上都很接近,主要是Ⅰ表面环区空间结构上存在较大差异。另外,第一组模型(图2A)与第二组模型(图2B)从大致框架上比较有很多相似的结构,特别是核心部位,但周边蛋白骨架和表面环区结构上差异度较大,表明MreB和actin蛋白虽为同源蛋白,氨基酸序列和结构上存在一定相似性,但两者从三维结构上比较存在特异性差异。

图3 蛋白晶体结构、同源建模结构的叠合比较
3.2 原核MreB与真核actin蛋白的系统进化分析
将表1中35种生物的MreB和actin蛋白序列比对和构建系统发育树,进行系统进化分析,结果如图4所示,整棵进化树明显分为两支,其中19种细菌同属于第一分支,而植物、藻类、动物和真菌同属于第二分支。由此表明虽然MreB和actin在氨基酸序列和结构上虽存在相似性,但两者仍具有显著的独立性,可以比较容易地将真核生物和原核生物分别聚类。MreB蛋白的聚类情况表明克雷伯氏杆菌属、埃希氏菌属和气单胞菌属亲缘关系较近,而类芽孢杆菌属和乳酸杆菌属亲缘关系较近,肠球菌属与乳酸杆菌属亲缘关系较远,这一结果与张斌等[14]在研究FtsZ蛋白同源性时获得的结果一致。另外图中还显示加氏乳杆菌和干酪乳杆菌与类芽孢杆菌属的亲缘关系比另外两种乳酸杆菌的亲缘关系较近。actin蛋白是一种非常保守的蛋白质,各种生物间氨基酸序列的同源性高达70%~100% ,植物与动物之间的氨基酸序列差异在11%~15%,大豆与玉米之间的差异在8%~10%,因此肌动蛋白是一种非常适合研究生物进化规律的分子工具。早在1999年国内胡年松等[1]就研究了74种生物共128个肌动蛋白序列,将这些蛋白序列比对后构建了进化树,分析得出肌动蛋白进化树能较好的反映真核生物间的进化关系。2012年张珍等[15]利用肌动蛋白分析了千里光与其他植物的亲缘关系,发现千里光与甘草和鹰嘴豆的亲缘关系较近。本研究构建的进化树中,肌动蛋白actin将表1中16种真核生物分别进行了聚类,分出植物、真菌、动物3个分支,均显示了与传统分类系统一致的亲缘关系,只有藻类生物聚类不明显,表明真核藻类actin蛋白的来源或进化分歧可能不同。
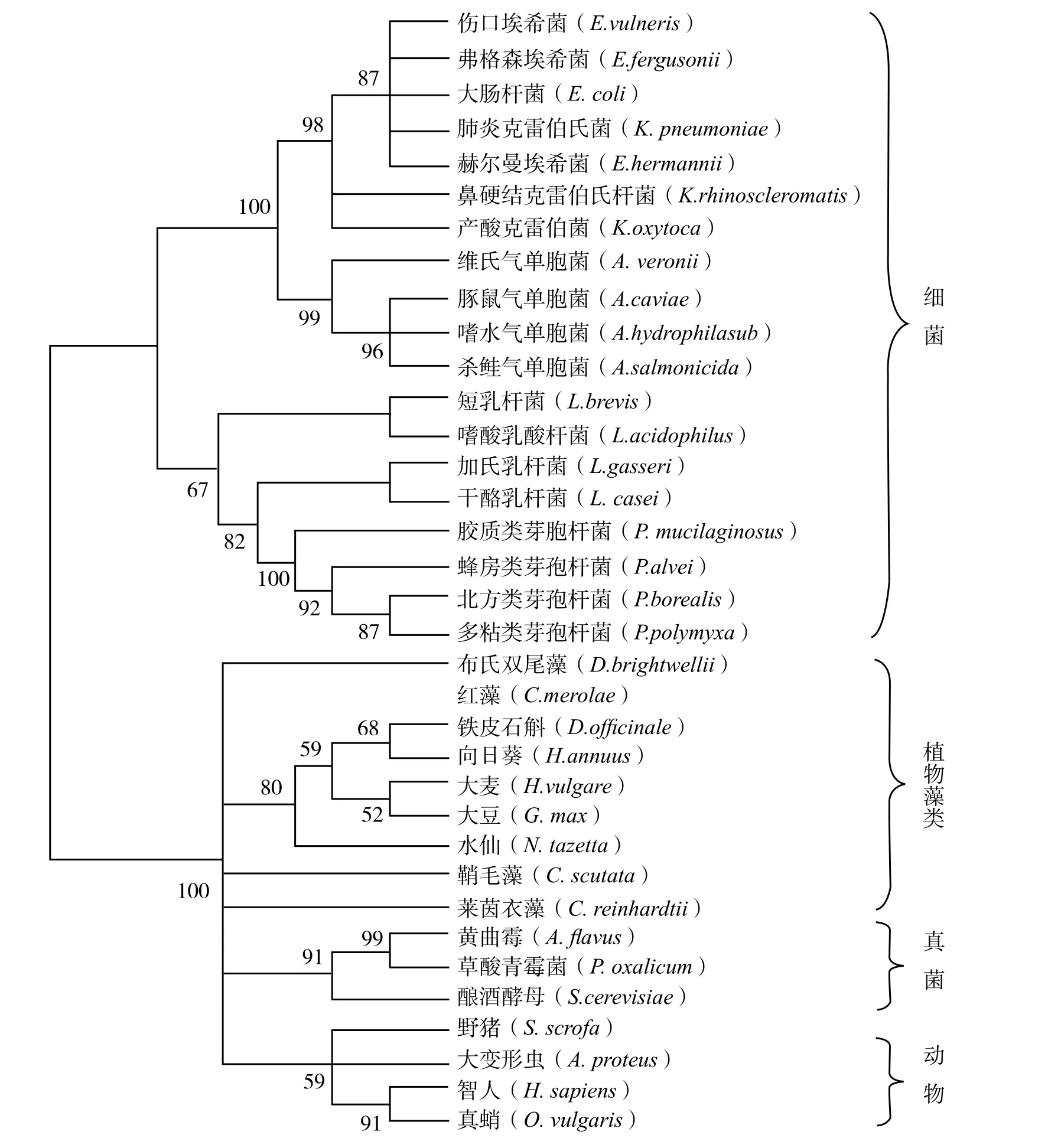
图4 蛋白系统发育树分析
4 结论
1)SWISS-MODEL系统选择的模板蛋白与建模蛋白可能属于不同类群的生物,模板与建模蛋白不存在类群或种属对称性。PROCHECK评估结果表明,预测得到的蛋白模型基本符合立体化学规则,有较高的合理性与可靠性,其中大部分属于高质量模型(落于最适区的氨基酸残基数>90%)。
2)用可视化分析软件PyMOL将蛋白叠合比对,结果表明MreB蛋白和actin蛋白虽为同源蛋白,氨基酸序列和结构上存在一定相似性,但存在特异性差异。
3)以MreB蛋白和actin蛋白为分子指标应用MEGA6软件构建的进化树基本能反映与传统分类系统一致的进化轨迹,但在某些细节方面显示出与传统分类系统相异的亲缘关系。
[1]胡松年,阎隆飞.肌动蛋白与真核生物的进化[J].动物学报,1999(4): 440-443.
[2]曲东明,韩梅,温进坤.肌动蛋白结合蛋白[J].细胞生物学杂志,2007(2):219-224.
[3]刘曦,张少斌,汪澈.植物肌动蛋白功能的研究进展[J].生物技术通报,2010(3):13-16.
[4]Reisler E, Egelman E H.Actin Structure and Function :What We Still Do Not Understand[J].Journal of Biological Chemistry,2007(50):36133-36137.
[5]van den Ent F, Johnson C M, Persons L, et al.Bacterial actin MreB assembles in complex with cell shape protein RodZ[J].The EMBO Journal,2010(6):1081-1090.
[6]陈晓燕,汪志平,杨灵勇.原核细胞骨架蛋白的结构与功能[J].细胞生物学杂志,2006(5):699-703.
[7]Hu B, Yang G, Zhao W, et al.MreB is important for cell shape but not for chromosome segregation of the filamentous cyanobacterium Anabaena sp.PCC 7120[J].Molecular Microbiology,2007(6):1640-1652.
[8]郎美娜.蛋白质三级结构比对方法及其应用[D].吉林大学,2009.
[9]赵东明,强小利,刘向荣.一种蛋白质结构同源建模的DNA算法[J].北京大学学报:自然科学版,2009(5):748-752.
[10]陈红梅,周俊祥.基于同源建模的蛋白质结构预测方法的研究[J].河南科学,2009(9):1108-1110.
[11]秦菠,张博,周艳芬,等.鲫鱼GABAARβ3亚基生物信息学分析与同源建模[J].世界农药,2014(2):27-33.
[12]王世佳,林浩鹏,李升康.拟穴青蟹(Scylla paramamosain)NOS蛋白结构分析及同源建模[J].汕头大学学报:自然科学版,2013(2):39-44.
[13]陆宗超,王邦平,李振兴.褐虾过敏原Cra c 8蛋白的结构分析和同源建模[J].食品科学,2012(9):177-181.
[14]张斌,东秀珠.FtsZ蛋白同源性分析在乳酸菌系统学研究中的应用[J].微生物学报,2005(5):661-664.
[15]张珍,平军娇,蔡振锋,等.千里光肌动蛋白基因(Actin)的生物信息学及功能分析[J].植物研究,2012(5):591-595.
