农杆菌介导创伤胚转化的应用
2015-10-21张丽君刘龙龙张建珍孙毅康国帅周建平崔林
张丽君 刘龙龙 张建珍 孙毅 康国帅 周建平 崔林

摘要
[目的] 優化农杆菌介导创伤胚转化的方法,提高转化率,培育具有特定功能的转基因品种,改善作物的生存能力和生态环境适应力。[方法]参照农杆菌划胚介导植物萌发种子基因转化方法,以燕麦、玉米和高粱的萌发种子为试验材料,农杆菌菌株LBA4404(含质粒P3301ubiAc)侵染转化燕麦、玉米和高粱的萌发种子,优化转化条件,探索燕麦、玉米和高粱遗传转化体系,探讨菌液浓度、种子萌发时间、超声波功率、乙酰丁香酮和草丁膦浓度对3种作物的影响并进行比较分析。[结果]农杆菌菌液浓度为0.6>OD600≥0.4 时转化效果最佳;第1次超声波功率为900 W,处理时间为10 min;第2次超声波功率为200 W,处理时间为4 min效果最佳。转化效率最高;添加乙酰丁香酮对燕麦、高粱和玉米的发芽有明显促进作用,但转化效果有明显区别;燕麦、玉米和高粱的转化植株对草丁膦的耐受性差异不大,与非转化植株相比,0.8 mg/L 除草剂胁迫下燕麦、玉米和高粱种子萌发受到一定程度的抑制。用1 mg/L 除草剂溶液对T0和T1代转化植株幼苗进行筛选,转化植株的存活率高于对照。[结论]经除草剂筛选和PCR对T0和T1代幼苗检测,初步证明获得了转化植株。
关键词 植物转化;燕麦;玉米;高粱
中图分类号 S188 文献标识码 A 文章编号 0517-6611(2015)03-025-04
Trauma Embryo of Genetic Transformation System with Agrobacterium Mediated Method
ZHANG Lijun1,2, LIU Longlong1,ZHANG Jianzhen2, CUI Lin1* et al
(1. Crop germplasm resources research institute, Shanxi Academy of Agricultural Sciences; Key Laboratory of Crop Gene Resources and Germplasm Enhancement on Loess Plateau, Ministry of Agriculture, P. R. China, Taiyuan, Shanxi 030031;2. Research Institute of Applied Biology,Shanxi University,Taiyuan,Shanxi 030001)
Key words [Objective]The purpose was to optimize agrobacteriummediated plant germination seed transformation method,increase conversion rate, breed GM varieties with specific functions, and improve viability and adaptability of crops. [Method]This paper consulted agrobacteriummediated plant germination seed transformation method and selected germinating seeds of oat, maize and sorghum as test materials. Germinating seeds of oat, maize and sorghum were infected and transformed by agrobacterium strain, which included plasmid P3301ubiAc. Transformation conditions were optimized. Genetic transformation systems of oat, maize and sorghum were studied. Concentration of bacterium, seed germinating time, ultrasonic power, and influence of concentration of acetosyringone and glufosinate on the above three crops were compared and analyzed. [Result]The experiment showed that when 0.6>OD600≥0.4, transformation achieved the best effect; Ultrasonic power was 900 W at the first time and treatment time was 10 minutes; Ultrasonic power was 200 W at the second time and transformation achieved the best effect when treatment time was 4 minutes; Acetosyringone could affect germination of oat, sorghum and maize significantly. It could increase transformation rate of maize and lower that of sorghum, but for oat, its effect was not obvious; in terms of tolerance to glufosinate, the difference was not significant among transformed plants of oat, maize and sorghum. Compared with nontransformed plants, seed germination of oat, maize and sorghum were restrained to some degree under the stress of 0.8 mg/L herbicide solution. With 1 mg/L herbicide solution to select seedlings of T0 and T1 transformed plants, the result showed survival rates of transformed plants is higher than those of control group. [Conclusion ]After herbicide selection and PCR test on T0 and T1 seedlings, it was proved preliminarily that transformed plants were got.
Key words Plant transformation;Oat;Maize;Sorghum
基金项目 国家燕麦荞麦产业技术体系(CARS08A1);山西省农科院博士基金项目(YBSJJ209)。
作者简介
张丽君(1981-),女,河北行唐人,助理研究员,博士,从事燕麦遗传育种研究。*通讯作者 。
收稿日期 20141203
随着生物技术的快速发展,植物基因工程在农作物品种改良中的应用越来越受到人们的重视,利用植物基因工程改良植物品质、增强抗性等是一种行之有效的方法,以弥补常规育种技术的不足,缩短育种周期。因此利用基因工程育种技术可加速选育出优质、抗逆的转基因新品种,满足山西高原生态建设和农业生产的需求。
农杆菌介导种子萌发的方法[1]是以植物萌发种子为受体,在种子萌发过程中对受体植物萌发种子生长点部位进行微创,借助于超声波的生物学效应,引起细胞壁和质膜的破损或可逆的质膜透性改变,为细胞内外发生物质交换创造条件。萌发的种子经过超声波处理后,立即转移到携带外源基因片段的农杆菌中进行共培养,将外源基因转移到受体基因组中,并通过对种子或幼苗的直接筛选,对植株叶片DNA进行PCR扩增和Southern杂交,进一步确定转化株。笔者以燕麦、玉米、高粱的种子作为外植体,采用农杆菌介导种子萌发的方法,进行转化研究。
1 材料与方法
1.1 植物材料及供体质粒
植物材料为燕麦品燕2号、玉米昌7-2、 高粱晋杂5号,种子预先精选备用。质粒载体为P3301ubiAc的Cry1Ac基因;启动子为Ubi,终止子为Nos(图1), 农杆菌菌株是LBA4404。标记基因为卡那霉素(Km),筛选基因为Km和链霉素(Streptomyces hygroscopicus)。菌株基因组中包含一个抗除草剂标记基因Bar基因。Bar 基因编码草丁膦乙酰 CoA 转移酶( PAT) ,可催化草丁膦( PPT) 的自由氨基乙酰化,从而使除草剂草丁膦失活。植物特别是单子叶植物对 Bar 基因编码的 PAT 酶作用的底物 PPT 内源抗性较低,且Bar基因表达检测方法较简便,因而Bar基因也被广泛用作植物基因转化试验的选择性标记基因和分子生物学研究的报告基因。
图1 质粒p3301ubiAc的物理图谱
1.2 农杆菌的制备
取含有质粒P3301ubiAc的农杆菌菌株LBA4404单菌落接种于浓度50 mg/L Km和100 mg/L的链霉素LB液体培养基进行菌液培养,OD600分别设置为0.2、0.4、0.6、0.8备用(临时放置于4 ℃保存)。
1.3 种子萌发时间对转化的影响
将种子于0.1% 氯化汞浸泡2 min左右,70%乙醇浸泡10 min左右灭菌;最后用无菌水漂洗3~5次以上,消毒后的种子进行预培养,预培养时间为4、12、20 h,每个处理用100粒种子,重复3次。于摇床上(120 r/min)28 ℃培养,让种子充分吸水膨胀。
1.4 超声波处理对转化的影响
超声波处理分为2次:微创伤后进行第一次超声波处理,工作频率设置4个处理,分别为0(CK)、300、600、900 W;工作时间设置3个处理,分别为0(CK)、5、10 min,每个处理含200粒种子,重复3次;第1次超声波处理后的微创伤种子浸泡在含有目的基因农杆菌菌液中进行第2次超声波处理,工作频率设置4个处理,分别为0(CK)、100、200、300 W;工作时间设置3个处理,分别为0(CK)、4、8 min。
1.5 共培养时间对转化的影响
将第2次超声处理后的微创伤种子浸泡在含有目的基因农杆菌菌液中,于摇床上振荡(120 r/min)培養1~3 d,并在种胚露白后停止振荡培养;将露白种子先用无菌水漂洗3~5次,然后播种大田中,记录播种种子的颗粒数和出苗情况。
1.6 不同植物种子的除草剂耐受试验
在生化培养箱中进行种子萌发试验,培养液和补给液均为草丁膦溶液。草丁膦浓度设置为0.8、0.6、0.4、0.2 mg/L和8、6、4、2 mg/L,每个处理20粒种子,每个处理设3次重复。14 d后观察种子萌发以及出芽情况。将共培养后的材料种植在大田中,到幼苗成长至4~5叶期喷雾草丁膦溶液进行除草剂筛选。7 d后调查成活苗数;20 d后再次喷雾草丁膦溶液进行筛选,7 d后调查成活苗数,成活苗可以初步认定为草丁膦抗性苗。在1 mg/L草丁膦存活的植株经自交收获种子,每个作物选500粒种子,第2年大田播种,以未转化种子同期播种作为对照,各品种五叶期用1 mg/L草丁膦对其进行喷洒,7 d后调查成活苗数。
1.7 PCR检测
采用CTAB法[2]提取总DNA,引物Primer1:5′CTGACCGTGACCGTGCTG3′;Primer2:5′TGGTGCCGTAGGCGAACT3′,反应程序:95 ℃预变性2 min,95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,30个循环后,于72 ℃延伸10 min ,产物片段长度为500 bp。扩增产物在1.0%的琼脂糖凝胶电泳分离,分析扩增产物的特异性。
2 结果与分析
2.1 菌液浓度对转化率的影响
将试验菌液浓度OD600设置为0.2、0.4、0.6和0.8。从表1可以看出,不同生长时期的农杆菌都具有转化能力,但转化效率有一定差别。0.4﹥OD600≥0.2时,农杆菌还处于生长期,浓度过低,对其的侵染程度有限。当农杆菌生长至对数期时,微创伤伤口自我修复完成。当0.6﹥OD600≥0.4时种子的转化率最高,此阶段农杆菌尚未达到对数生长期的旺盛期,在与种子的共培养阶段,农杆菌仍处于对数生长期并很快达到旺盛期,此时微创伤伤口也未完成自我修复,从而促进TDNA转移和整合到宿主植物基因组中;而当OD600≥0.6时,转化率有所降低,由于菌液浓度已达到旺盛的对数生长期,在种子的共培养阶段菌液的浓度仍在增长并很快达到饱和状态,达到饱和状态的农杆菌不利于TDNA转移和整合到宿主植物的基因组中。由此可知,当农杆菌生长快达到对数生长期(0.6﹥OD600≥0.4) 时,转化效率最高。
表1 菌液浓度对转化率的影响
%
菌液浓度(OD600)燕麦高粱 玉米
0.4﹥OD600≥0.22.55.43.1
0.6﹥OD600≥0.47.014.99.2
0.8﹥OD600≥0.63.88.95.3
OD600≥0.81.66.12.7
2.2 种子萌发对转化率的影响
从表2可以看出,燕麦的种子较小,种皮吸胀时间短,故萌发时间不宜太长,4 h转化率最高,为最佳时间。玉米种子较大,8 h转化率最高。
表2 种子萌发时间对转化率的影响
%
种子萌发时间∥h燕麦高粱玉米
452.3838.7317.64
636.7962.1431.92
812.1321.1749.38
43卷3期 张丽君等 农杆菌介导创伤胚转化的应用
2.3 超声波对转化率的影响
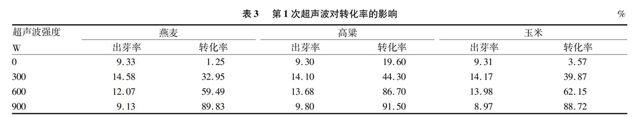
将第1次超声波功率分别设置为0(CK)、300、600、900 W,结果表明,燕麦、高粱和玉米表现结果相一致,在第1次超声波處理时,超声波功率为300 W时种子的出芽率最高,随着功率的增加而降低,可能是由于超声波可以促进种子萌发,促使种子细胞的细胞壁和原生质发生水合,加速原生质从凝胶状态转变为溶胶状态。各种酶开始活化,呼吸和代谢作用急剧增强。超声波功率为900 W和0时,种子的发芽率接近,说明相对较低的超声波功率对种子发芽率有促进作用。而转化率则相反,随着超声波功率的增加,转化率随之提高(表3),说明超声波的空化作用对促进TDNA转移和整合到宿主植物基因组都有明显的促进作用,超声波处理功率为900 W时,处理时间10 min对萌发种子的转化率最高。第1次超声波处理后,加入农杆菌菌液进行第2次超声波处理。第2次超声波处理设置为0(CK)、100、200、300 W;工作时间设置3个处理,分别为0(CK)、4、8 min。第2次超声波处理功率的对照(CK)设置为第一次超声波处理功率900 W处理后的种子。超声波处理本身会对农杆菌造成一定伤害,因此选择低浓度的超声波功率对其进行处理,结果表明,第2次超声波功率对燕麦、玉米和高粱的转化率都有促进作用。超声波功率为200 W时,处理时间4 min对转化效果最佳。
表3 第1次超声波对转化率的影响
%
超声波强度
W
燕麦
出芽率转化率
高粱
出芽率转化率
玉米
出芽率转化率
09.331.259.3019.609.313.57
30014.5832.9514.1044.3014.1739.87
60012.0759.4913.6886.7013.9862.15
9009.1389.839.8091.508.9788.72
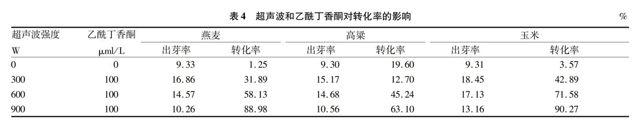
2.4 乙酰丁香酮对转化率的影响
植物伤口处的细胞分泌大量的酚类化合物、中性糖,酚类化合物如乙酰丁香酮(AS)和羟基乙酰丁香酮(HO-AS)等,一些中性糖如L-阿拉伯糖、D-木糖等,上述物质既是根瘤农杆菌的趋化物,又是农杆菌中毒性基因Vir表达的诱导物,在它们的作用下,导致T-DNA的加工和转移,从而侵染植物细胞。作为主要诱导物的AS和HO-AS等酚类物质,主要在双子叶植物细胞壁中合成,通常不存在于单子叶植物中,所以在转化过程中人为添加AS 可以促进根癌农杆菌感染单子叶植物[3-4]。在不同超声波功率处理后,将AS添加到共培养液中,AS对萌动种子划胚处理后转化率的影响见表4。由表4可知,与超声波处理后未添加AS相比,在共培养液中加入100 μmol/L乙酰丁香酮3种作物种子出芽率明显提高,但转化率3种作物表现不同,燕麦中添加AS无明显变化,玉米的转化率有所提高,高粱的转化率反而降低。可能由于3种作物对AS浓度要求不同,导致转化率不同。
2.5 共培养对转化率的影响
共培养是农杆菌中TDNA携带外源基因进入植物细胞的关键时期,此过程发生之后,农杆菌的继续存在已没有必要,且微创伤伤口也完成了自我修复。由于转化材料为种子,需要考虑种子的发芽情况,共培养时间以2 d较合适。共培养时间太短,农杆菌没有充分地对植物进行转化,转化率较低。而共培养时间太长,胚细胞呼吸作用逐渐加强,酶的活动逐渐旺盛,加速消耗氧气,使得共培养液中氧气含量减少,营养情况不良并容易产生、大量积累次级代谢产物,可能产生有害物质。另外,种子发芽在移栽过程中会造成大批量种子受伤死亡。
2.6 除草剂对转化率的影响
从表5可以看出,在0.8 mg/L草丁膦的胁迫下,燕麦、玉米和高粱的种子只有52%、61%和43%能够萌发,与对照相比,萌发缓慢。在2 mg/L草丁膦胁迫下,有33%、45%和37%的种子仍能够缓慢萌发,但已不能正常生长。大田喷雾试验以实验室数据为基础,选用1 mg/L的草丁膦对其进行喷洒试验,第1次喷洒草丁膦溶液后,对照植株有少量存活,第2次喷洒草丁膦溶液7 d后,对照几乎全部死亡。第2年各作物五叶期用1 mg/L草丁膦对其进行喷洒试验,从表6可以看出,T1代转化植株生长早期喷洒草丁膦后各作物存活率明显高于T0代,达50%以上。
2.7 PCR检测
对经草丁膦筛选的抗性植株提取DNA进行PCR扩增,以提取的抗性植株DNA作为模板,用Cry1AC基因一对特异性引物进行PCR特异片段的扩增,以未转化植株作为阴性对照,以质粒DNA作为阳性对照,进行PCR检测。其中部分株系与阳性对照扩增出的条带完全相同,而对照DNA则未扩增出相应的条带,初步说明外源基因已导入植株中(图2)。
3 结论与讨论
在农杆菌介导的植物转化过程中进行超声波处理,利用超声波的空化作用在外植体的表面和深层形成许多的微伤口,大量微伤口的存在为农杆菌的感染提供了更多的机会,使外源基因容易进入,促进TDNA转移和整合到宿主植物的基因组中,提高农杆菌的转化活力[5]。但超声波处理时间不宜太长,由于超声波的热化作用,使超声波在介质中传播时,所产生的能量会不断地被介质吸收而使介质的温度升高[6] ,从而对外植体造成伤害。Santarem 等[7]、Trick等[8] 用扫描隧道显微镜观察到经过超声波处理的大豆子叶的表面和深层存在大量的微伤口,处理时间越长,外植体的损伤越严重,因此在实际利用时需要测定超声波处理的强度和时间。在该研究中前后2次使用超声波處理,第1次超声波处理的目的是使种子经过超声波处理后处于一种“感受态”的状态,有利于促进T-DNA转移和整合到宿主植物的基因组中,提高基因的转化率。第2次超声波处理的目的是使带有目的基因的菌在超声波处理时处于一种“避难”行为当中,从而加快T-DNA转移和整合到宿主植物的基因组中。第1次超声波处理功率900 W,处理时间为10 min,第2次超声波功率为200 W时,处理时间为4 min时对转化效果最佳。
转基因植物的研究目的主要在于改善植物抗逆、抗除草剂等性质,提高产量和品质,作为生物反应器等方面[9]。目前我国转基因农作物和林木有22种,转基因植物中转入的性状以抗除草剂为多,约超过40%,其次为抗虫、抗病毒和抗逆性等性状[10]。在禾本科作物中,玉米建立了良好的遗传转换体系,具有外源基因单拷贝插入、遗传稳定、无载体骨架插入、目的基因表达合适、对玉米自身性状无影响等特点。国外大公司及部分公立研究机构建立了相对成熟的玉米转基因技术体系。全球 1.77 亿hm2玉米种植面积中有 32%是转基因玉米[11]。国内玉米转基因技术体系研究起步较晚,初步建立了玉米规模化转基因技术体系。与玉米相比,高粱转基因研究工作相对滞后,遗传转化体系不稳定、转化效率偏低、外源基因表达量低或不表达。高粱的未成熟胚、幼穗、茎尖以及来自未成熟胚或幼穗经诱导产生的胚性愈伤组织均是遗传转化的理想受体,可采用农杆菌介导法、基因枪法、电激法、花粉管通道法、显微注射法和原生质体化学(PEG)处理法等方法进行遗传转化[12]。相比之下,燕麦的转基因处于落后状态,目前国内外成功转化于燕麦的基因有大麦的HVA1(甲肝外壳蛋白)基因[13],抗除草剂Bar基因[14]和PPIP基因
(类产碱假单胞菌杀虫蛋白基因)[15]。而国内报道的只有张
艺[15]和王迅婧[16]均获得了转化植株,但均未确定外源基因在后代中能否稳定表达。农杆菌介导种子萌发方法的优点是外植体来源不受时间限制,不需要建立植株再生体系,免去组织培养等复杂的操作。目前在玉米[17]、大豆[18]、高粱[19]等作物均获得了转基因植株,但在作物上应用还不够成熟[20]。农杆菌介导种子萌发方法的优化和转化过程中的影响因素仍需进一步研究。该试验运用植物萌发种子基因转化法对燕麦、高粱和玉米3种作物进行遗传转化,建立了该方法基本的遗传转化条件,并对3种作物的萌发时间、菌液浓度、共培养时间、超声波功率、乙酰丁香酮浓度、草丁膦的敏感性进行了比对,优化农杆菌介导种子萌发的方法,提高转化效率。随着农杆菌介导种子萌发方法的改进、转化效率的提高,农杆菌介导种子萌发的方法将为作物分子育种和基因功能研究提供有力的方法保障。
参考文献
[1]
孙毅,王景雪,刘少翔,等.农杆菌介导植物萌发种子基因转化方法:中国,ZL 01104185.8[P].2001-07-11.
[2] 王关林,方宏筠.植物基因工程[M].2版.北京:科学出版社,2002:742-744.
[3] 刘志学,马向前,何艺园,等.农杆菌介导遗传转化中辅助处理方法的改良[J].复旦大学学报:自然科学版,1999,38(5):601-604.
[4] 张丽君,程林梅,杜建中,等.农杆菌介导普那菊苣遗传转化体系的建立[J].草地学报,2011,19(6):1042-1050.
[5] 邹湘辉,庄东红, 胡忠,等.负压和超声波处理对农杆菌介导的花生遗传转化效率的影响[J].中国油料作物学报,2004,26(1):12-16.
[6] 邱树毅,姚汝华,宗敏华.超声波在生物工程中的应用[J].生物工程进展,1999,19(3):45-48.
[7] SANTAREM E R,TRICK H N,ESSIG J S,et al.Sonication-assisted Agrobacterium-mediated transformation of soybean immature cotyledons :optimization of transient expression[J].Plant Cell Reports,1998,17:752-759.
[8] TRICK H N,FINER J J.Sonication- assisted Agrobacterium-mediated transformation of soybean embryogenic suspension culture tissue[J].Plant Cell Reports,1998,17:482-488.
[9] 萬建民.我国转基因植物研发形势及发展战略[J].生命科学,2011,23(2):157-167.
[10] 田娅红,张鼎华.植物转基因研究进展及安全性分析[J].廊坊师范学院学报:自然科学版,2014,14(4):89-93.
[11] JAMES C.2013 年全球生物技术/转基因作物商业化发展态势[J].中国生物工程杂志, 2014, 34(1): 1-8.
[12] 朱莉,郎志宏,李桂英,等.高粱遗传转化研究进展[J].生物技术通报,2011(1):1-7.
[13] ORABY H F,RANSOM C B,KRAVCHENKO A N, et al.Barley HVA1 Gene Confers Salt Tolerance in R3 Transgenic Oat[J].Corp Sci,2005, 45:2218-2227.
[14] 万士梅,蒯本科.外源基因(Bar)在转基因燕麦(Avena sativa L.)后代中的遗传与表达[J].复旦学报,1998,37(4):450-454.
[15] 张艺.燕麦遗传转化体系的建立和披碱草再生体系的建[D].成都:四川大学,2007.
[16] 王迅婧.燕麦组织培养和农杆菌介导的燕麦遗传转化体系的建立[D].长春:东北师范大学,2012.
[17] WANG J, LI Y, SUN Y.Maize genetic transformation by co一eultivating germinating seeds with Agrobacterium tumefaeiens[J].Biotechnology&APPlied Biochemistry,2007,46:51-55.
[18] 张婷婷.植物非组培转化方法获得转基因植株[D].太原:山西大学,2011.
[19] 杜建中,孙毅,郝曜山,等.非组培转化法获得转基因植株及其Basta耐受性研究[J].西北植物学报,2012,32(2):231-240.
[20] 任海红,任小俊,王英,等.非组培遗传转化法在农作物上的应用[J].山西农业科学,2010,38(11):85-88.
