氯沙坦对小鼠前脑缺血再灌后期脑损伤的保护作用
2015-10-21马云鹏乔圆廖雁牛拴成梁月琴黄凌岸张振范彦英张轩萍
马云鹏 乔圆 廖雁 牛拴成 梁月琴 黄凌岸 张振 范彦英 张轩萍


摘要:目的研究AT1受体阻断剂氯沙坦对小鼠前脑缺血再灌后期的神经保护作用。方法将成年雄性昆明小鼠随机分为对照组、前脑缺血组、前脑缺血+氯沙坦给药组及氯沙坦单纯给药组,通过阻断双侧颈总动脉60 min建立前脑缺血模型,氯沙坦于缺血前14 d至再灌后20 d,每日腹腔注射1 mg/kg。比较再灌后不同时间点各组小鼠的体重和在水迷宫实验中的学习记忆能力差异。再灌21 d,对各组小鼠取脑、冰冻切片、进行甲苯胺蓝染色,观察海马CA1区神经元损伤情况。结果前脑缺血组小鼠再灌1 d体重即下降,再灌3 d下降程度达到最大,氯沙坦可显著提高缺血小鼠再灌3 d、7 d、14 d及21 d的体重恢复程度。再灌16 d进行水迷宫实验,前脑缺血组小鼠与对照组相比,训练第3天和第4天的平台潜伏期显著延长,而氯沙坦可显著缩短缺血小鼠的平台潜伏期。再灌21 d,前脑缺血组小鼠的海马CA1区神经元密度显著低于对照组,而氯沙坦显著抑制了神经元的缺失。结论 AT1受体阻断剂氯沙坦对小鼠前脑缺血的长期再灌注损伤具有保护作用。
关键词:前脑缺血;神经损伤;AT1受体阻断剂
中图分类号:R743.3R285.5文献标识码:A
doi:10.3969/j.issn.16721349.2015.01.021文章编号:1672
1349(2015)01005803
脑卒中目前除缺血后短时间内进行溶栓外,尚无较好的治疗手段[1]。AT1受体阻断剂,又称血管紧张素Ⅱ受体1亚型阻断剂(angiotensin Ⅱ type 1 receptor blockers),是目前最常用的高血压一线治疗药物之一。Lutterotti等最早在给予8% NaCl饮用的Dahl盐敏感大鼠上发现,给予AT1受体阻断剂氯沙坦能够暂时减少脑卒中的发生和进展[2]。Dai等[3]在大鼠局灶性脑缺血模型上发现,缺血前5 d侧脑室注射AT1受体阻断剂厄贝沙坦,可以显著改善脑缺血再灌24 h后的神经功能。随后,研究者还在全脑缺血、永久性局灶性脑缺血及培养的神经元OGD等多种脑缺血模型上,验证了AT1受体阻断剂对脑缺血损伤的神经保护作用[47]。但是,目前这些研究主要评价了AT1受体阻断剂对脑缺血早期(7 d以内)的保护作用,但尚不明确其对脑缺血后期(数周)的学习记忆功能及神经损伤的影响。
本课题拟利用小鼠双侧颈总动脉结扎引起的前脑缺血模型[8],研究临床上常用的AT1受体阻断剂氯沙坦对脑缺血再灌后期学习记忆功能及神经元损伤的作用。
1材料与方法
1.1实验动物雄性昆明小鼠24只,体重30 g~35 g,购自山西医科大學实验动物中心。所有的动物实验均遵照国家实验动物饲养和使用指南,动物饲养在温度控制的环境(22℃)中,12 h明暗循环,自由饮食和饮水。
1.2实验方法
1.2.1分组及给药方法将动物随机分为对照组(Control)、前脑缺血组(Bccao)、前脑缺血+氯沙坦给药组(Bccao+Losartan)和氯沙坦单纯给药组(Losartan)。氯沙坦于缺血前14 d至再灌后20 d,每日腹腔注射1 mg/kg。对照组和缺血组则给予生理盐水。
1.2.2前脑缺血模型制备以4%水合氯醛(400 mg/kg)腹腔注射麻醉,颈部正中切口,钝性分离出左右两侧颈总动脉,用缝线(60)结扎以阻断双侧颈总动脉血流,缺血60 min后恢复血流,并缝合创口。对照组及氯沙坦单纯给药组仅分离但不结扎双侧颈总动脉。术后动物能自主活动前利用小动物保温箱维持肛温在36.5 ℃~37.5 ℃。
1.2.3体重监测为评价小鼠脑缺血再灌损伤的程度,于手术前1 d及术后1 d、3 d、7 d、14 d及21 d对小鼠体重进行监测,并做记录。
1.2.4Morris水迷宫实验再灌16 d,利用水迷宫实验评价小鼠的空间学习记忆能力。参照文献[9],水池中分为四个对称象限Ⅰ、Ⅱ、Ⅲ、Ⅳ,在池边有不同的可见图案作为标志。水迷宫测试共5 d。前4 d为记忆获得阶段,在该阶段,将平台放于第1象限水下的固定位置;每天将每只小鼠分别由4个对称象限的预定位置,头向外侧放入水中,直到小鼠找到水下的平台并在上面停留超过5 s,则记录下小鼠寻找平台的时间,即平台潜伏期。测定时间最长为60 s。5 d时为测试阶段,在此阶段,撤去平台,将小鼠由Ⅱ、Ⅲ象限放入水中,测试小鼠在第1象限内的停留时间。实验通过摄像头录像,并通过辅助图像分析软件进行分析。
1.2.5病理切片及甲苯胺蓝染色前脑缺血再灌21 d,以4%水合氯醛腹腔注射麻醉小鼠,经左心室插管灌流。灌流液依次采用生理盐水及4%多聚甲醛固定液。后固定,分别用15%和30%的蔗糖溶液进行脱水。制备厚度为16 μm的海马冠状切片。染色时以0.01 mol/L PBS洗5 min,重复3次;1%甲苯胺蓝染色30 min;0.5%盐酸酒精分化(3~10)s;95%、100%乙醇脱水各2 min,各重复两次;二甲苯透明,封片。对海马CA1区的正常神经元进行计数。
1.3统计学处理计量资料以均数±标准差(x±s)表示。采用SPSS 15.0软件处理,组间均数比较采用单因素方差分析(Oneway ANOVA)。P<0.05表示有统计学意义。
2结果
2.1氯沙坦对小鼠前脑缺血再灌后不同时间点体重变化的影响前脑缺血再灌1 d,小鼠体重出现了下降(见图1),但组间的体重下降程度尚无明显差异。前脑缺血组小鼠再灌3 d体重下降程度达到最大,再灌14 d体重恢复至缺血前水平;给予氯沙坦可显著提高缺血小鼠再灌3 d、7 d、14 d、21 d的体重恢复程度。氯沙坦单纯给药组小鼠体重增加的程度与对照组相比无统计学意义。
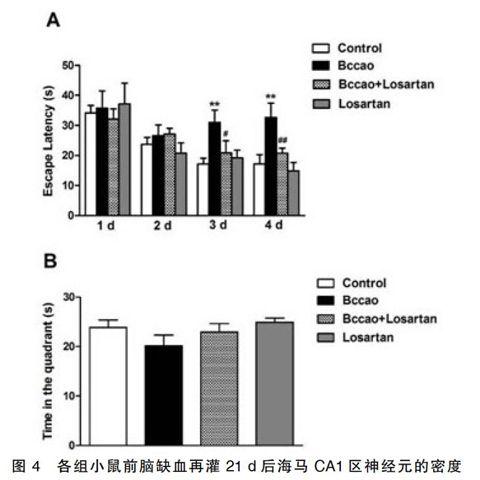
2.2氯沙坦对小鼠前脑缺血再灌后期空间学习记忆能力的影响在学习记忆获得阶段的1 d,各组平台潜伏期并无明显差异(见图2)。随着训练天数的增加,对照组的平台潜伏期逐渐缩短。与对照组相比,前脑缺血组小鼠的学习记忆获得能力显著受损伤,表现为训练第3 天和第4 天平台潜伏期显著延长。而前脑缺血+氯沙坦给药组在训练第3天和第4天平台潜伏期均显著短于前脑缺血组,提示氯沙坦显著改善了小鼠前脑缺血再灌后期学习记忆的获得能力。另外,氯沙坦单纯给药组在学习记忆获得阶段的平台潜伏期与对照组相比无统计学意义。在测试阶段,各组小鼠在第Ⅰ象限的停留时间都没有统计学意义(见图3),前脑缺血及给予氯沙坦并未对成学习记忆的保持能力造成明显影响。
2.3氯沙坦對小鼠前脑缺血再灌后期海马CA1区神经元损伤的影响甲苯胺蓝染色结果显示(见图4),前脑缺血组小鼠的海马CA1区神经元密度与对照组相比,下降了(38.04±14.27)%(P<0.01);而给予氯沙坦明显抑制了前脑缺血再灌引起的CA1区神经元缺失(P<0.05)。
3讨论
本研究发现AT1受体阻断剂对小鼠前脑缺血的长期再灌注损伤具有保护作用,表现为再灌后体重恢复加快、空间学习记忆能力改善以及神经元损伤减轻。AT1受体阻断剂对脑缺血再灌早期的神经损伤具有保护作用[1012]。脑缺血后动物体重下降的程度可以部分反映缺血再灌损伤的严重程度[13,14]。氯沙坦不仅可明显促进前脑缺血再灌后3 d和7 d的体重恢复,对再灌后期(14 d 和21 d)的体重恢复也有促进作用。对正常小鼠的体重变化并无影响。该药物对脑缺血再灌早期和后期的神经损伤可能均具有保护作用。氯沙坦对小鼠脑缺血再灌后期海马CA1区神经元损伤具有较强的保护作用。脑缺血再灌注引发神经元损伤,往往同时伴随着学习记忆功能的下降[15]。大剂量氯沙坦(10 mg/kg)对正常小鼠学习记忆能力有提高作用[16]。连续多日给予正常小鼠小剂量的氯沙坦(1 mg/kg),对其空间学习记忆的获得能力并无明显改善作用。然而,该剂量下的氯沙坦可明显改善小鼠前脑缺血再灌16 d后的空间学习记忆的获得能力。氯沙坦对脑缺血再灌后期的神经元损伤和学习记忆功能均具有明显的改善作用。
AT1受体阻断剂氯沙坦具有抗脑缺血再灌后期损伤的作用。由于该药物在脑缺血再灌后的不同阶段均具有明显的神经保护作用,该药物有望应用于对缺血性脑卒中特别是伴有高血压患者的治疗,但其具体机制还有待更深入的研究。
参考文献:
[1]Zhang LF,Yang J,Hong Z,et al.Proportion of different subtypes of stroke in China[J].Stroke,2003,34(9):20912096.
[2]von Lutterotti N,Camargo MJ,Campbell WG,et al.Angiotensin II receptor antagonist delays renal damage and stroke in saltloaded Dahl saltsensitive rats[J].J Hypertens,1992,10(9):949957.
[3]Dai WJ,Funk A,Herdegen T,et al.Blockade of central angiotensin AT1 receptors improves neurological outcome and reduces expression of AP1 transcription factors after focal brain ischemia in rats[J].Stroke,1999,30(11):23912399.
[4]Sugawara T,Kinouchi H,Oda M,et al.Candesartan reduces superoxide production after global cerebral ischemia[J].Neuro Report,2005,16(4):325328.
[5]Kobayashi T,Kawamata T,Shibata N,et al.Angiotensin II type 1 receptor blocker telmisartan reduces cerebral infarct volume and periinfarct cytosolic phospholipase A2 Level in experimental stroke[J].J Neurotrauma,2009,26(12):23552364.
[6]Wu X,Kihara T,Hongo H,et al.Angiotensin receptor type 1 antagonists protect against neuronal injury induced by oxygenglucose depletion[J].Br J Pharmacol,2010,161(1):3350.
[7]Zhang TL,Fu JL,Geng Z,et al.The neuroprotective effect of losartan through inhibiting AT1/ASK1/MKK4/JNK3 pathway following cerebral I/R in rat hippocampal CA1 region[J].CNS Neuroscience & Therapeutics,2012,18(12):981987.
[8]Ginsberg MD,Busto R.Rodent models of cerebral ischemia[J].Stroke,1989,29(12):627642.
[9]Vorhees CV,Williams MT.Morris water maze:procedures for assessing spatial and related forms of learning and memory[J].Nat Protoc,2006,1(2):848858.
[10]Faure S,Bureau A,Oudart N,et al.Protective effect of candesartan in experimental ischemic stroke in the rat mediated by AT2 and AT4 receptors[J].J Hypertension,2008,26(10):20082015.
[11]Sugawara T,Kinouchi H,Oda M,et al.Candesartan reduces superoxide production after global cerebral ischemia[J].Neuro Report,2005,16(4):325328.
[12]Lou M,Blume A,Zhao Y,et al.Sustained blockade of brain AT1 receptors before and after focal cerebral ischemia alleviates neurologic deficits and reduces neuronal injury,apoptosis,and inflammatory responses in the rat[J].Cerebral Blood Flow & Metabolism,2004,24(5):536547.
[13]Papas S,Crepel V,Hasboun D,et al.Cycloheximide reduces the effects of anoxic insult in vivo and in vitro[J].Eur J Neurosci,1992,4(8):758765.
[14]Zhang F,Wang S,Signore AP,et al.Neuroprotective effects of leptin against ischemic injury induced by oxygenglucose deprivation and transient cerebral ischemia[J].Stroke,2007,38(8):23292336.
[15]Soares LM,Schiavon AP,Milani H,et al.Cognitive impairment and persistent anxietyrelated responses following bilateral common carotid artery occlusion in mice[J].Behav Brain Res,2013,249:2837.
[16]Raghavendra V,Chopra K and Kulkarni SK.Involvement of cholinergic system in losartaninducedfacilitation of spatial and shortterm working memory[J].Neuropeptides,1998,32(5):417421.
(收稿日期:20140328)
(本文編辑王雅洁)
