枸杞中黄酮类化合物提取与分离纯化工艺的研究进展
2015-10-21于惠康磊等��
于惠 康磊等��
摘要 近几年,随着枸杞的化学成分和药理作用的广泛研究,枸杞总黄酮因具明显的抗氧化、清除自由基、提高免疫力等活性而逐渐成为研究热点,因此人们采用多种方法对枸杞黄酮进行提取分离。在此从枸杞黄酮的提取和分离提纯两方面进行总结,为今后的分离提纯提供参考依据。
关键词 枸杞;黄酮;提取;分离纯化;研究进展
中图分类号 S567;TS225.1 文献标识码
A 文章编号 0517-6611(2015)05-062-03
Research Progress of Separation and Extraction Flavones in Lycium barbarum
YU Hui1, 2, KANG Lei1, 2, ZHANG Rui1, 2 et al (1. State Key Testing Laboratory of Coal Chemical, Yinchuan, Ningxia 750002; 2. Chemical Laboratory Center of Ningxia Baota, Yinchuan, Ningxia 750002)
Abstract In recent years, the chemical composition and pharmacological function of Lycium barbarum has been extensively studied, the total flavones in Lycium barbarum has been gradually become a hot topic because of significant antioxidation, removal of the free radicals, enhancing immunity and other activities. Thus, many researchers used variety methods to separate and extract the total flavones from Lycium barbarum. The separation and extraction of total flavones from Lycium barbarum were summarized, providing a reference for separation and purification in future.
Key words Lycium barbarum; Flavones; Extraction; Separation and purification; Research progress
基金項目 宁夏自然科学基金项目(NZ13255)。
作者简介 于惠(1986-),女,辽宁凌源人,工程师,硕士,从事分离型功能高分子材料研究。
收稿日期 20141226
枸杞 (Lycium Barbarum)为茄科枸杞属,多年生落叶小灌木植物,是我国传统的药食两用同源植物之一[1]。枸杞的药用部位较多,明朝李时珍《本草纲目》记载:“春采枸杞叶,名天精草;夏采花,名长生草;秋采子,名枸杞子;冬采根,名地骨皮”。枸杞子为枸杞的成熟干燥果实,其活性成分主要包括色素类、多糖类、黄酮类化合物、多种氨基酸、维生素及微量元素[2]。枸杞子具有滋补肝肾、益精明目之功效,现代临床上广泛用于调节免疫功能[3]、抗氧化[4]、抗辐射[5]、抗肿瘤[6]、清除自由基[7]、促进益生菌细胞生长及抗衰老[8]等。枸杞叶,又名天精草,为茄科植物枸杞或宁夏枸杞的嫩茎叶,功能补肝益肾、生津止渴、虚劳发热。枸杞叶中的活性成分与枸杞子类似,其蛋白质含量极其丰富,另外据报道枸杞叶中含有丰富的有机锗,具有增强免疫力、延缓衰老的功效[9]。枸杞根皮,又称为地骨皮,为茄科、枸杞属植物枸杞的根皮,可入药,具有清热、凉血、降压、清肺降火等功效。我国枸杞有7个种3个变种,其中以宁夏地区生产的宁夏枸杞 (Lycium Barbarum L.) 最为著名[10],青海、甘肃等地的枸杞品质也很高。近几年,枸杞的化学成分和药理作用被广泛的研究,作为枸杞中重要的活性物质之一,枸杞总黄酮因具明显的抗氧化、清除自由基、降血脂、降血糖、治疗心脑血管疾病、抗肿瘤、抗衰老、提高免疫力等活性而逐渐成为研究热点[11-12]。
枸杞中黄酮类化合物的提纯,主要包括以下两方面:一方面是提取,基于植物不同部位所含黄酮类化合物的结合状态不同,如在花、果、叶中以甙为主要存在形式,在木质部分以甙元为主要存在形式,需要根据被提取物的类型和理化性质选择合适的提取溶剂和提取方法;另一方面是分离纯化,目的是尽可能充分将黄酮类化合物与其他成分分开,并进一步分离得到黄酮类成分单体。笔者在此对近年来枸杞中黄酮类化合物的提取与分离纯化工艺的研究进展进行了系统总结。
1 提取方法
1.1 有机溶剂提取法
有机溶剂提取法是国内外使用最为广泛的一种提取方法,主要以乙醇、甲醇、石油醚等有机溶剂作为提取溶剂,在索氏提取器中进行抽提。通常采用乙醇作为提取溶剂,提取的过程中,乙醇的浓度对黄酮类化合物的提取存在影响。高浓度的醇(90%~95%)适用于提取黄酮甙元类化合物,而低浓度的醇(60%~70%)更适合提取黄酮甙类化合物[13]。该方法操作简单、成本低,易于大规模生产,但工艺繁琐,杂质含量也较高,回收率低。李铭芳等采用70%的乙醇为溶剂回流提取宁夏枸杞中的总黄酮,通过正交试验,研究发现最优提取条件为提取温度70 ℃、提取时间2.0 h、固液比为1∶20[14]。刘兰英等以70%乙醇对枸杞叶进行回流提取,并通过正交试验确定了提取工艺条件为70%乙醇、料液比1∶8、提取时间3 h、提取3~8 nm碎粒,黄酮得率为3.72%[15]。
1.2 超声辅助提取法
超声波的作用机理是在被提取样品和溶剂之间产生声波空化效应[16],破坏植物细胞并加速溶剂分子之间的运动,使植物细胞中的有效成分较易溶解于溶剂中,加速了植物有效成分的浸出提取。另一方面,超声提取過程中的空化作用还会增大样品与提取溶剂之间的接触面积,从而提高植物中活性成分从固相转移到液相的传质速率[17]。因此,对植物有效成分采用超声提取,可以在很大程度上加快提取速度,缩短了提取时间,进而提高了天然产物中活性成分的提取速率和提取量。该方法节省提取时间、提高提取效率、试验设备简单、操作方便,在工业生产中具有较为广阔的应用前景。王汉卿等通过正交试验优选出超声辅助提取枸杞叶总黄酮的最佳工艺条件为乙醇体积分数 65%、乙醇用量 1∶60、超声提取时间 35 min、超声温度 70 ℃;利用优选出的最佳超声提取工艺测定比较不同采收期枸杞叶中的总黄酮含量,结果为5月中旬含量最高[18]。孙化鹏等通过正交试验法优选出超声辅助提取枸杞叶总黄酮的最佳工艺条件为乙醇浓度75%、乙醇用量1∶40、超声提取时间30 min、超声提取温度50 ℃[19]。
1.3 微波辅助萃取法
微波萃取又称微波辅助萃取(Miacrowaveassisted extraction,MAE),是利用微波的热效应对样品及其有机溶剂进行加热,从而将目标组分从样品基体中分离出来的一种新型高效分离技术。微波萃取过程是高频电磁波穿透萃取介质到达物料内部,微波能转化为热能,物料内部的温度迅速上升,使物料内部的压力超过细胞壁膨胀所能承受的压力,导致细胞膨胀破裂,从而促使有效成分自由流出,并溶解于萃取介质中[20]。微波加热不同于传统的加热模式,即热量由外向内传递,而是直接作用于内部和外部的介质分子,使整个物料同时被加热,即“体加热过程”,从而可克服传统的传导式加热方式所存在的升温较慢的缺陷。同时,微波所产生的电磁场可加速被萃取组分的分子由固体内部向固液界面扩散的速率,从而使萃取速率提高数倍,并能降低萃取温度,最大限度地保证萃取物的质量[21]。
与其他的提取方法相比较,微波辅助萃取具有如下优点:①选择性好。由于样品中各组分对微波的吸收能力存在差异,从而导致其温度不同,致使各组分从基体中分离的速度也存在差异。因此,微波萃取能对萃取体系中的不同组分进行选择性加热,可以使目标组分直接从基体中分离。②热效率较高。微波加热是内外同时加热的模式,由微波能量直接转化为热能,没有热传递造成的温度梯度和热量损失,因而加热均匀,热效率较高。③质量稳定。可以在较低的温度下完成萃取,有效地保护了被提取物的有效成分。④操作简单。微波萃取无需干燥等预处理,简化了工艺,减少了投资。
巨敏等以枸杞为原料,用乙醇作为提取剂,采用微波提取法对枸杞中总黄酮进行提取,以二次同归正交试验设计对结果进行优化分析,得出的最佳条件为乙醇浓度68.3%、微波时间100 s、微波温度73 ℃、微波功率300 W、液料比14.7∶1.0(ml/g),在最佳条件下,总黄酮的提取率为19.52 mg/g[22]。孙波等以芦丁为对照品,采用单因素试验和正交试验时影响枸杞总黄酮提取率的因素进行了考察,并优选出最佳提取工艺为乙醇浓度70%、料液比1∶30(g/ml)、微波辐射功率400 W、温度120 ℃、提取时间8 min,在此条件下枸杞总黄酮的含量为18.3 mg/g[23]。
1.4 磁场强化萃取法
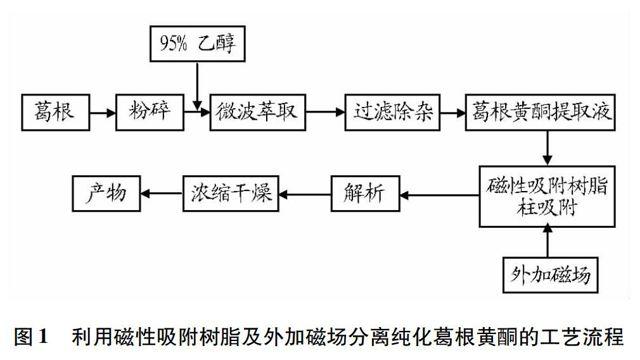
磁场强化萃取是一种借助外加磁场以强化化工分离过程的新技术,被称为“绿色分离技术”,它可以利用磁场产生的特殊能量来改变抗磁性物质的微观结构,使其理化性质发生变化[24],同时通过影响反应速率来起到强化萃取的作用。周芸等以新鲜枸杞为原料,采用磁场强化萃取法提取枸杞黄酮,通过正交试验,得出优化磁场处理的最佳条件为:在磁感应强度 640 mT、磁化时间 40 min、磁化温度 65 ℃、浸提回流时间 60 min 的条件下,枸杞黄酮的提取率可达290.81 mg/100g[25]。李冰等发明一种利用磁性吸附树脂及外加磁场分离纯化葛根黄酮的方法,具体的工艺流程如图1所示。首先,将葛根粉碎置于微波萃取罐中,加入95%乙醇,微波萃取除去杂质后得葛根黄酮提取液;其次,将磁性吸附树脂装入树脂柱,置于可调磁场中,将葛根黄酮提取液流过树脂柱,收集解吸液,浓缩干燥后得葛根黄酮产品[26]。
1.5 高压均质提取法
高压均质提取法是指利用柱塞泵将被分离物保持在一定的压力条件下,液料高速流过一个狭窄的缝隙时而受到强大的剪切力,同时还有液料与金属环接触产生的碰撞力以及由于静压骤降和骤升而产生的孔爆发力等综合力的作用,使原料中不透明、粒径较大的悬浊液转化成稳定细小的悬浊液的过程[13]。高压均质提取法可以将样品中的组成结构破粹到纳米级,利于目标成分的溶出,大大提高了样品的提取率。同时,操作时温度较低,因此对样品的破坏力较小,可以保持样品原有的性质。因此,该方法将在天然活性成分的提取方面展现越来越重要的作用[27]。
刘增根等考察了高压均质提取柴达木枸杞叶有效成分的最佳工艺及对有效成分进行了纯化,发现高压均质提取柴达木枸杞叶总黄酮的最佳工艺条件为乙醇体积分数 80%、料液比 1∶10、均质压力 60 MPa、提取时间 30 min,在该条件下,提取物中芦丁质量分数为 10.53%,总黄酮质量分数为32.61%[28]。
2 分离纯化方法
2.1 大孔吸附树脂吸附分离法
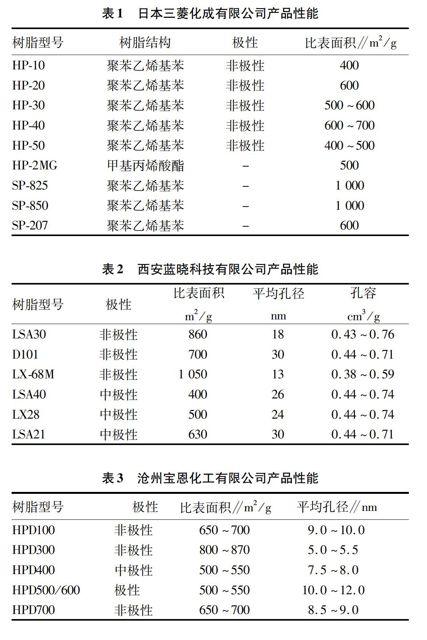
大孔吸附树脂(Macroporous Adsorption Resin,MAR)是由功能单体、交联剂等可聚合成分与致孔剂、分散剂等添加剂经悬浮或反相悬浮聚合制备而成的一类球状的多孔高分子吸附分离材料,其内部存在大大小小、形状各异、相互贯通的孔穴,即使在干燥状态下,其内部均具有较高的孔隙率,且存在大孔结构(一般在100~1 000 nm)。MAR不同于离子交换树脂,其本身不含可交换性功能基,它的吸附性主要依靠范德华力(包含色散力、定向力和诱导力等)和氢键的作用,同时,网状结构和很高的比表面积又赋予其良好的吸附性能和筛分性能,因此,MAR是一类不同于离子交换树脂的、集吸附和筛分性能为一体的分离型功能高分子材料。目前,国内外MAR的生产厂家主要有美国RohmHass、日本三菱化成公司、天津南开大学化工厂、华北制药厂树脂分厂、西安蓝晓科技有限公司、西安蓝深特种树脂有限公司、沧州宝恩化工有限公司、天津海光化工有限公司等,部分厂家产品的性能如表1~3所示[29-30]。
目前,MAR主用于皂苷类、黄酮及其苷类、蒽醌及其苷类、酚酸类、色素类及生物碱类等的分离纯化。利用MAR分离纯化中草药中的有效成分,有以下几点优势:首先,由于MAR独特的吸附性和筛分性,利用MAR分离纯化了多种单味中草藥的有效成分,这为其他中草药的提取研究奠定了基础;其次,不断有新的MAR问世,这为中草药有效成分的分离富集提供了可供选择的保障。
胡晓莲等通过优选MAR,并考察其工艺参数,筛选合适的吸附树脂DA201,最佳的工艺条件为上样量10柱床体积(BV)、上样液浓度15 mg/ml、上样液流速1 BV/h,上样液pH=3,解吸洗脱剂乙醇浓度为40%、乙醇用量8 BV,富集纯化总黄酮得率75.85%,总黄酮纯度35.70%[31]。何彦峰等通过比较11种MAR的静态吸附解吸性能,筛选出适合纯化柴达木枸杞总黄酮的树脂类型HPD400;并进行动态吸附解吸试验,利用单因素和响应面法优化MAR纯化柴达木枸杞总黄酮,得到的的最佳工艺条为:以16.0 ml pH为4.0的柴达木枸杞总黄酮粗提液上柱,流速1.0 ml/min,充分吸附后用3 BV去离子水洗柱,然后用23.0 ml 80%乙醇溶液以流速1.0 ml/min进行解吸,枸杞黄酮的平均回收率为89.92%,含量为27.62%,约为纯化前总黄酮含量的5倍左右[32]。
2.2 高效液相色谱法(HPLC)
高效液相色谱法(High Performance Liquid Chromatography,HPLC)又称“高压液相色谱”,以液体为流动相,采用高压输液系统,将具有不同极性的单一溶剂或不同比例的混合溶剂、缓冲液等流动相泵入装有固定相的色谱柱,在柱内各成分被分离后,进入检测器进行检测,从而实现对试样的分析。HPLC具有高压、高效、高速、高灵敏度及应用范围广的特点。
董静洲等对宁夏枸杞果实黄酮提取液进行色谱柱分离,检测波长为259 nm,流动相 A为1.0%乙酸,流动相 B为甲醇,流速为1.0 ml/min;并对我国宁夏枸杞六大产区的枸杞果实总黄酮提取液进行了 HPLC 分离和 HPLC 指纹图谱比较[33]。张自萍等以10个宁夏不同产地的宁夏枸杞主栽品种“宁杞I号”样品建立枸杞黄酮类化合物指纹图谱共有模式,采用“中药色谱指纹图谱相似度评价系统”软件进行数据处理,对15个不同来源的枸杞样品进行了分析[34]。
安徽农业科学 2015年
3 展望
近几年,随着人们对枸杞黄酮的化学成分和药理作用不断深入研究,使枸杞黄酮愈来愈受到人们的重视。因此,通过不断地探索枸杞黄酮提取和分离纯化工艺研究的新方法,仍将是提纯枸杞黄酮的热点研究方向。
参考文献
[1]
国家药典委员会.中国药典第一部[S].北京:中国医药科技出版社,2010:225-226.
[2] 王业勤,李勤生.天然类胡萝卜素[M].北京:中国医药科技出版社,1997:68-78.
[3] LIN F Y,LAI Y K,YU H C,et al.Effects of Lycium barbarum extract on production and immunomodulatory activity of the extracellular polysaccharopeptides from submerged fermentation culture of Coriolus versicolor [J].Food Chemistry,2008,110(2):446-453.
[4] MA M,LIU G H,YU Z H,et al.Effect of the Lycium barbarum polysaccharides administration on blood lipid metabolism and oxidative stress of mice fed high-fat diet in vivo[J].Food Chemistry,2009,113:872-877.
[5] QIAN J Y,LIU D,HUANG A G.The efficiency of flavonoids in polar extracts of Lycium chinense Mill fruits as free radical scavenger[J].Food Chemistry,2004,87(2):283-288.
[6] CHAO J C J,CHIANG S W,WANG C C,et al.Hot waterextracted Lycium barbarum and Rehmannia glutinosa inhibit proliferation and induce apoptosis of hepatocellular carcinoma cells[J].World J Gastroenterol,2006,12(28):4478-4484.
[7] HSU H Y,YANG J J,HO Y H,et al.Difference in the effects of radio protection between aerial and root parts of Lycium chinense[J].Journal of Ethnopharmacology,1999,64(2):101-108.
[8] YU M S,LEUNG S K Y,LAI S W,et al.Neuroprotective effects of anti-aging oriental medicine Lycium barbarum against β-amyloid peptide neurotoxicity[J].Experimental Gerontology,2005,40(8/9):716-727.
[9] ROMAGNOLO D F,SELMIN O I.Flavonoids and cancer prevention:a review of the evidence[J].Journal of Nutrition in Gerontology and Geriatrics,2012,31(3):206-238.
[10] 张云霞,王萍,刘敦华.枸杞活性成分的研究进展[J].农业科学研究,2008,29(2):79-83.
[11] 杨文君,肖明,吕新,等.不同采摘期对柴达木枸杞外观性状及活性成分影响[J].农产品加工,2014(15):50-52.
[12] 刘安军,刘慧慧,郭丹霄,等.大孔吸附树脂分离纯化枸杞叶总黄酮的研究[J].现代食品科技,2012,28(3):292-296.
[13] 马婷婷.宁夏枸杞叶黄酮类化合物的提取、纯化及抗氧化活性作用研究[D].银川:宁夏大学,2012.
[14] 李铭芳,李淑芳,汪小强,等.枸杞中总黄酮的分析方法及提取工艺研究[J].天津农业科学,2011,17(1):46-50.
[15] 刘兰英,曹有龙,赵友谊.枸杞黄酮提取工艺研究[J].安徽农业科学,2011,39(30):18490-18491.
[16] 李伟,刘亚青.超声波的空化作用在聚合物化工中的应用[J].科技情报开发与经济,2007,17(1):132-134
[17] 许忠华,张洪波.超声清洗的空化作用机理[J].哈尔滨铁道科技,2009,4(2):3-5.
[18] 王汉卿,王文苹,闫津金,等.超声提取枸杞叶中总黄酮提取工艺及其不同采收期含量变化研究[J].中国实验方剂学杂志,2011,17(8):44-47.
[19] 孙化鹏,钟晓红,张珉,等.超声提取枸杞叶总黄酮的工艺研究[J].现代生物医学进展,2009,9(14):2645-2648.
[20] 贾淑云.微波萃取技术在中药有效成分提取中的应用[J].中国处方药,2014,12(3):34-35.
[21] 马玉哲,张俊杰,李红霞.中药有效成分提取分离技术最新进展[J].河北理工大学学报:自然科学版,2009,31(1):99-101.
[22] 巨敏,杨鹏,朱沛沛,等.二次回归正交优化枸杞中总黄酮提取工艺的研究[J].中国酿造,2011(10):94-96.
[23] 孙波,王琨,郝鹏程,等.枸杞总黄酮微波辅助提取工艺的优化[J].安徽农业科学,2012,40(12):7377-7379.
[24] 杜娟,冯瑞玉,赵静,等.磁场改变物质理化性质及其分离效果的研究进展[J].河北化工,2006,29(11):21-24.
[25] 周芸,张珍,张盛贵,等.正交试验优化磁场法提取枸杞黄酮工艺[J].食品科学,2012,33(18):98-101.
[26] 李冰,赵巍,李琳,等.利用磁性吸附树脂及外加磁场分离纯化葛根黄酮的方法:中国,200710026481[P].2007-08-01
[27] 许亮,师俊玲,陈志娜,等.大孔树脂分离纯化宁夏枸杞总黄酮的研究[J].离子交换与吸附,2011,27(3):202-211.
[28] 刘增根,党军,江磊,等.柴达木枸杞叶有效成分高压均质提取及纯化[J].精细化工,2011,28(4):350-354.
[29] 郭丽冰,王蕾.常用大孔吸附树脂的主要参数和应用情况[J].中国现代中药,2006,8(4):26-32.
[30] 郭立玮.中药分离原理与技术[M].北京:人民卫生出版社,2009:501-510.
[31] 胡晓莲,张华.大孔吸附树脂富集枸杞子中总黄酮的工艺研究[J].食品与药品,2013,15(2):94-97.
[32] 何彥峰,杨仁明,胡娜,等.大孔吸附树脂纯化枸杞总黄酮的研究[J].食品工业科技,2012,33(18):274-278.
[33] 董静洲,王瑛.宁夏枸杞主要产区枸杞子总黄酮的测定与分析研究[J].食品研究与开发,2009,30(1):36-40.
[34] 张自萍,廖国玲,李弘武.宁夏枸杞黄酮类化合物HPLC指纹图谱研究[J].中草药,2008,39(1):103-105.
责任编辑 黄小燕 责任校对 况玲玲
