铁皮石斛HDR基因克隆及真菌诱导子对其表达和生物碱含量的影响
2015-10-21林艳君赖钟雄
林艳君 赖钟雄

摘 要 以铁皮石斛原球茎为材料,采用同源克隆的方法,成功得到了铁皮石斛Do-HDR基因的全长,并通过qPCR对其相对表达量进行分析。结果表明:Do-HDR基因全长1 784 bp(GenBank登录号KJ946381),5′UTR为40 bp,3′UTR为361 bp,开放阅读框为1 382 bp,编码460个氨基酸。生物信息学分析结果表明,该基因编码的蛋白为稳定的亲水蛋白,不具有跨膜结构,不含信號肽,定位于内质网。采用灭活的尖孢镰刀菌菌液作为诱导子,分别以0、100、200、500、1 000 mg/L的浓度培养3 d后测定总生物碱含量,结果表明,总生物碱含量呈现先上升后下降的趋势;当诱导子浓度为200 mg/L时,总生物碱含量达到最大值。在此基础上通过qPCR分析Do-HDR基因的相对表达量,结果发现Do-HDR基因相对表达量在诱导子浓度为200 mg/L时也到达最大值。因此,推测Do-HDR基因与生物碱的合成与积累有关。
关键词 铁皮石斛;Do-HDR基因;基因克隆;qPCR;生物碱
中图分类号 S682.31 文献标识码 A
铁皮石斛(Dendrobium officinale Kimura et Migo)是兰科石斛属多年生附生草本植物,是一味珍贵的药材,《神农本草经》中将其列为上品,味甘平,具有补五脏虚劳、羸瘦、强阴的功效,久服厚肠胃,轻身延年,有益胃生津、滋阴清热的功效[1]。大量研究结果表明,铁皮石斛对肿瘤、眼科疾病、肠胃疾病、糖尿病等有一定的作用[2-4]。现代药理学研究结果表明,铁皮石斛主要药用成分有多糖、菲类、联苄母核类、氨基酸、生物碱类等[5-6]。其中生物碱是最早被分离鉴定的物质,而石斛碱型生物碱是铁皮石斛生物碱中最主要的组分,具有保护神经元、止痛退烧、保护胃肠道等作用,且对阿耳茨海默氏病具有一定的作用[7-9]。1964年犬伏康夫等确定石斛碱具有倍半萜骨架结构,而石斛碱型生物碱的倍半萜骨架通过萜类化合物的生物合成途径合成。长期以来,以甲羟戊酸为前体的甲羟戊酸途径(mevalonate pathway, MVA pathway)被认为是萜类合成的唯一途径,直到20世纪90年代,法国学者Rohmer等[10]提出一条新的途径-甲基赤藓糖磷酸(methylerythritol phosphate,MEP)途径。有研究结果认为倍半萜、三萜通过传统的MVA途径合成,而单萜、双萜、四聚类萜烯则通过MEP途径合成[11],但也有研究结果表明,倍半萜可经由MEP途径合成[12-13],萜类合成的2条途径并非孤立的存在,而是共同提供萜类合成所需的前体物质IPP和DMAPP,在拟南芥[14]、烟草[15]中均发现了此现象,但2条途径在萜类物质合成的过程中各自做出多少贡献还不清楚。4-羟基-3-甲基-2-(E)-丁烯基-4-磷酸还原酶(4-hydroxy-3-methyl-2-(E)-butenyl-4-diphosphate reductase. HDR)是MEP途径中的最后一个酶,该酶催化HMBPP生成IPP和DMAPP。在银杏[16]、拟南芥[17]、丹参[18]等多种植物中已经克隆得到了HDR基因,但铁皮石斛中的HDR基因研究仍未见报道。本研究通过同源克隆和RACE相结合的方法,获得Do-HDR基因的全长,在真菌诱导子处理后测定其生物碱含量的变化,并通过qPCR分析其相对表达量,以期对铁皮石斛生物碱合成与积累的分子机制研究提供一定的参考。
1 材料与方法
1.1 材料
铁皮石斛(Dendrobium officinale Kimura et Migo)原球茎,产地为福建连城,2010年开始由福建农林大学园艺植物生物工程研究所继代保存。
1.2 方法
1.2.1 总RNA的提取和cDNA的合成 采用Tripure法进行总RNA的提取。利用Fermentas公司的RevertAidTMFirst Strand cDNA Synthesis Kit 试剂盒进行cDNA的逆转录,所得产物用于基因保守区、ORF及3′RACE的扩增,5′RACE扩增所用cDNA用Clotech试剂盒进行逆转录。
1.2.2 铁皮石斛Do-HDR基因的引物设计与PCR扩增 (1)Do-HDR基因的保守区克隆。采用同源克隆的方法,利用反转录的cDNA第一链为模板进行PCR扩增,对其目的片段进行回收、连接、克隆、转化、测序。各阶段所有引物序列及退火温度见表1。
(2)Do-HDR基因的3′端克隆。根据已经得到的Do-HDR基因保守区序列,设计2条顺式上游引物,以GeneRacerTM 3′Primer作为下游引物,以反转录的第一链cDNA为模板,进行第1轮扩增,将第1轮产物稀释10倍后作为第2轮扩增的模板,下游引物为GeneRacerTM 3′Nestd Primer,经琼脂糖凝胶电泳检测后回收目的片段,然后进行连接、克隆、转化、测序。
(3)Do-HDR基因的5′端克隆。方法同3端克隆,所用下游引物为UPM。
(4)Do-HDR基因的拼接验证。在基因5′和端3′端设计引物,以cDNA第一链为模板,进行PCR扩增,并验证cDNA拼接结果。
1.2.3 PCR参数设置 94 ℃预变性3 min;94 ℃变性45 s,退火45 s(退火温度根据不同扩增片段Tm值设置),72 ℃延伸(延伸时间根据扩增片段长度设定)。
1.2.4 真菌诱导子制备方法 参照Wang等[19]的方法,用马铃薯葡萄糖液体培养基培养尖孢镰刀菌(Fusarium oxysporum,菌种由福建农林大学植物保护学院王永栋赠送)。采用苯酚硫酸法测定总糖含量,以总糖浓度标定诱导子浓度。
1.2.5 样品处理方法 以1/2MS为基本培养基,加入50 g/L土豆煮沸,滤去土豆渣后土豆汁同培养基混合,白糖20 g/L,pH为5.4。分别加入0、100、200、500、1 000 mg/L尖孢镰刀菌诱导子,摇床转速设置为90 r/min。培养温度为(25±2)℃,光照时间为12 h/d,光照强度为2 000 lx左右,培养3 d后收获,所得样品分别取0.2 g,提取总RNA后合成qPCR所用的cDNA,其余烘干备用。
1.2.6 不同浓度尖孢镰刀菌诱导子处理下Do-HDR基因的qPCR 根据TaKaRa PrimeScript RT reagent Kit(Perfect Real Time,TaKaRa)试剂盒的步骤反转录合成所需的cDNA。定量反应所用的PCR反应体系如下:SYBR 10 μL,上、下游引物各0.4 μL,各个样本cDNA 1 μL,加H2O至20 μL。PCR扩增程序为:95 ℃预变性5 min;95 ℃变性10 s,58 ℃退火10 s,72 ℃延伸10 s,40个循环;40 ℃冷却30 s。每个反应重复3次,以18SrRNA为内参基因,用相对定量法对目的基因的转录水平进行分析。
1.2.7 总生物碱的测定 (1)样品生物碱的提取。参考丁亚平等[20]的方法提取样品的生物碱。
(2)标准曲线的制作。采用酸性染料比色法测定总生物碱,具体步骤:精密称取1.00 mg石斛碱对照品,用氯仿溶解后定容至100 mL。分别吸取1.0、2.0、3.0、4.0、5.0 mL石斛碱溶液加入60 mL分液漏斗,补充氯仿至体积为10 mL;然后加入5 mL邻苯二甲酸氢钾-氢氧化钠(pH4.5)及1.0 mL溴甲酚绿(0.04%)溶液,剧烈振荡3 min,静置30 min;再用氯仿并干燥的药棉过滤氯仿层,取续滤液6 mL,加入0.01 mol/L氢氧化钠无水乙醇溶液,摇匀后静置备用。用未加石斛碱对照品的空白组做对照,在波长620 nm处分别测定吸光度。以稀释后的石斛碱浓度为横坐标,样品的吸光度为纵坐标制作标准曲线。
(3)样品生物碱的测定。取2 mL制备好的待测液,加入分液漏斗,补充氯仿至10 mL,其余步骤参照标准曲线制作方法。
2 结果与分析
2.1 Do-HDR基因序列全长的获得
采用同源克隆的方法,以铁皮石斛原球茎cDNA第一链为模板,通过PCR扩增得到Do-HDR基因的保守区,为一段383 bp的片段;在此基础上进行3′RACE和5′RACE,分别得到787 bp和789 bp的片段,与估计长度相符;利用DNAMAN6.0拼接序列,得到基因全长为1 784 bp。再设计1对引物验证拼接结果,验证片段长度为1 715 bp,与拼接结果相符并包含了完整的开放阅读框,将该基因命名为Do-HDR,GenBank登录号为KJ946381。测序结果显示:Do-HDR基因5′UTR为40 bp,3′UTR为361 bp,Poly(A)尾巴仅为10 bp,开放阅读框为1 382 bp,编码460个氨基酸。
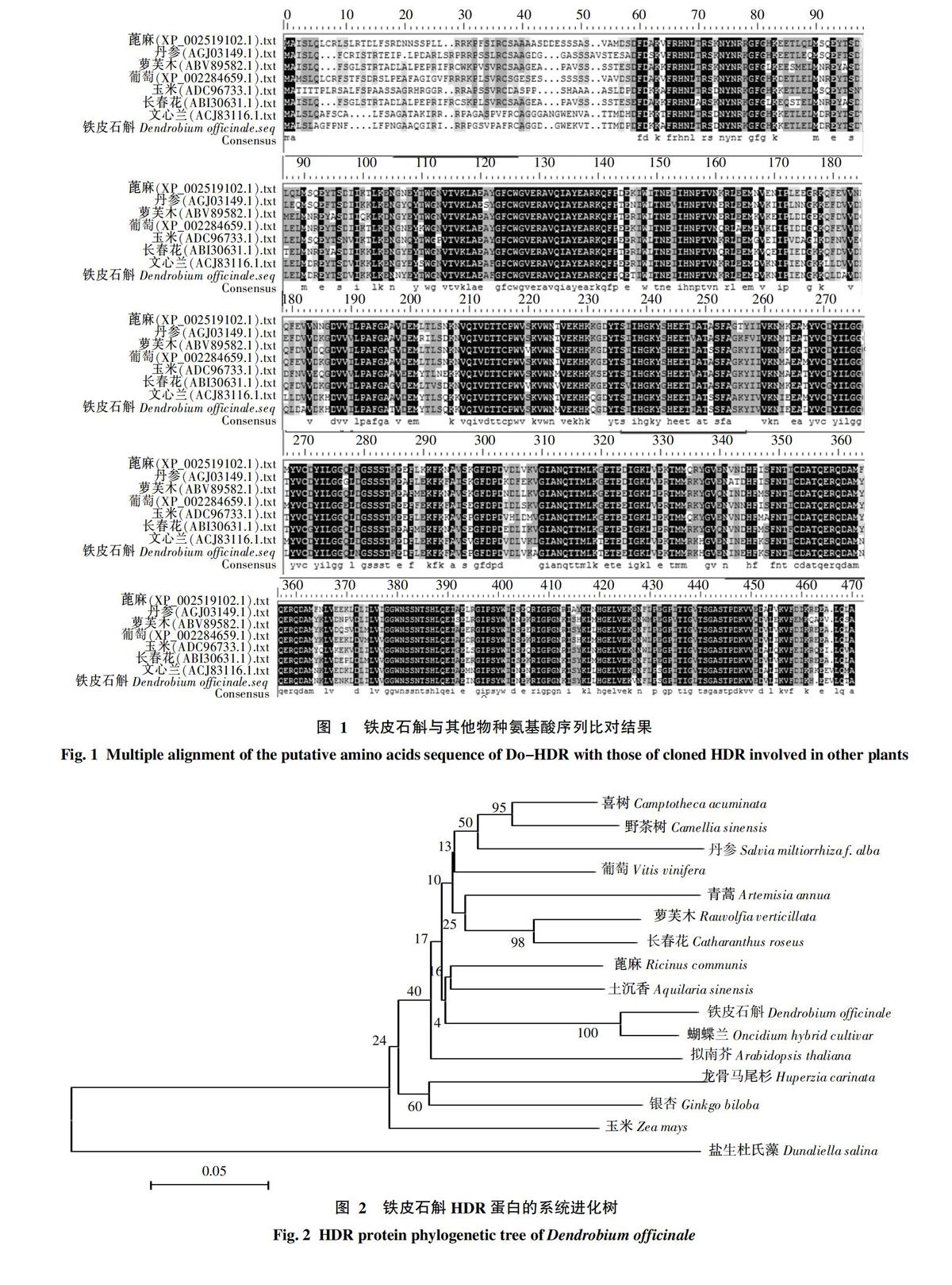
将拼接所得Do-HDR基因序列在NCBI的GenBank数据库中与其他物种Blast比对,结果发现该基因与其他HDR基因有比较高的同源性,与文心兰的序列同源性达到89%,与毛果杨的序列同源性达到78%,与野茶树的序列同源性达到77%,与喜树的序列同源性达到77%。此外,用DNAMAN程序对蓖麻、丹参、萝芙木、葡萄、玉米、长春花、文心兰的氨基酸序列同笔者克隆所得铁皮石斛氨基酸序列进行多序列比对(图1),结果表明,不同物种间的HDR基因氨基酸序列同源性很高。
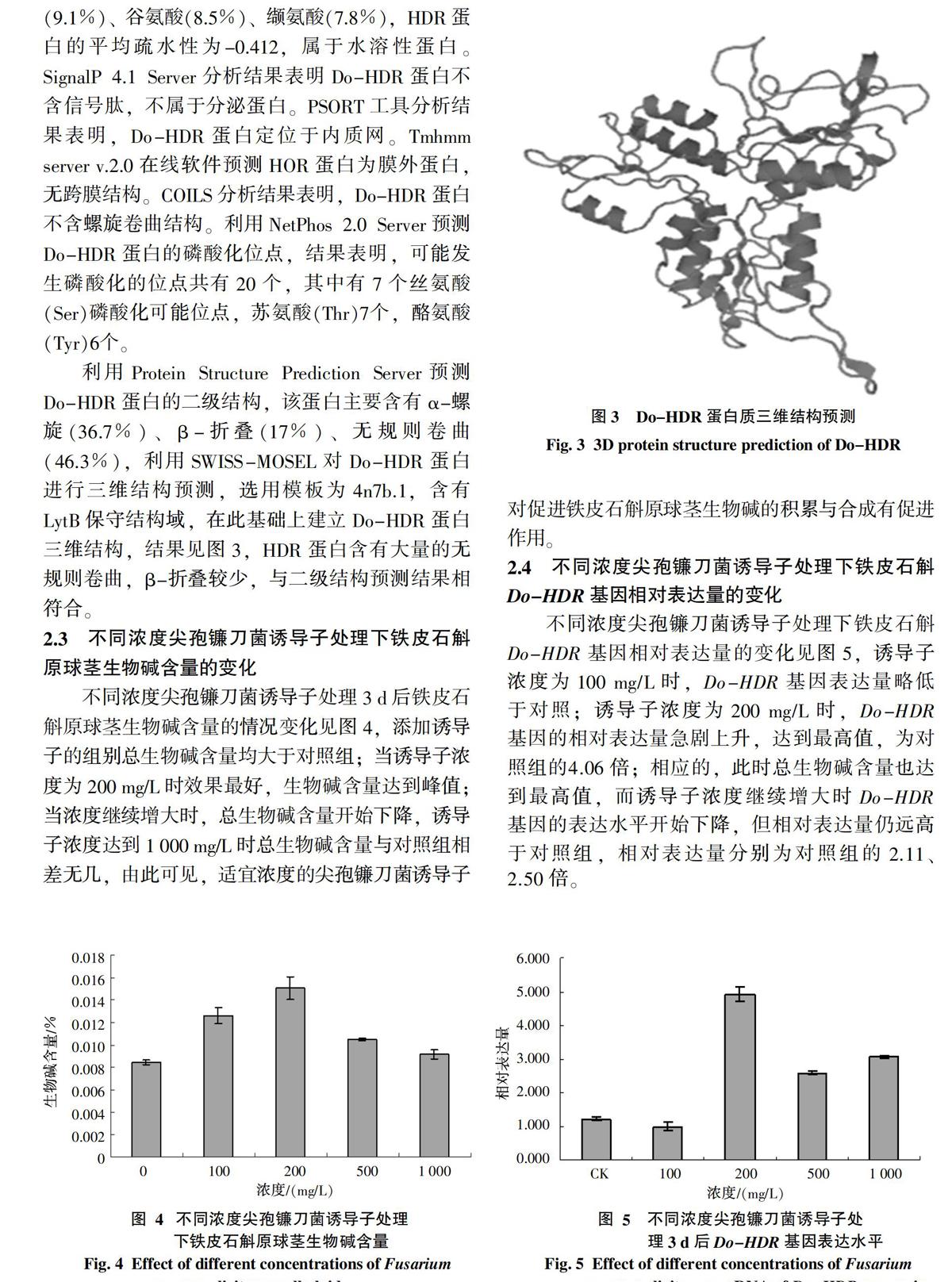
将Do-HDR与GenBank中的15种植物的15种蛋白进行比对,利用MEGA5.05构建进化树,并分析聚类关系,结果见图2,铁皮石斛与蝴蝶兰聚为一类,因此推测铁皮石斛与蝴蝶兰亲缘关系最近。
2.2 生物信息学分析
利用ExPAsy Protparam在线预测理化性质,Do-HDR所编码的蛋白质相对分子量为51 877.0,理论等电点为5.91,含量最高的氨基酸为赖氨酸(9.1%)、谷氨酸(8.5%)、缬氨酸(7.8%),HDR蛋白的平均疏水性为-0.412,属于水溶性蛋白。SignalP 4.1 Server分析结果表明Do-HDR蛋白不含信号肽,不属于分泌蛋白。PSORT工具分析结果表明,Do-HDR蛋白定位于内质网。Tmhmm server v.2.0在线软件预测HOR蛋白为膜外蛋白,无跨膜结构。COILS分析结果表明,Do-HDR蛋白不含螺旋卷曲结构。利用NetPhos 2.0 Server预测Do-HDR蛋白的磷酸化位点,结果表明,可能发生磷酸化的位点共有20个,其中有7个丝氨酸(Ser)磷酸化可能位点,苏氨酸(Thr)7个,酪氨酸(Tyr)6个。
利用Protein Structure Prediction Server预测Do-HDR蛋白的二级结构,该蛋白主要含有α-螺旋(36.7%)、β-折叠(17%)、无规则卷曲(46.3%),利用SWISS-MOSEL对Do-HDR蛋白进行三维结构预测,选用模板为4n7b.1,含有LytB保守结构域,在此基础上建立Do-HDR蛋白三维结构,结果见图3,HDR蛋白含有大量的無规则卷曲,β-折叠较少,与二级结构预测结果相符合。
2.3 不同浓度尖孢镰刀菌诱导子处理下铁皮石斛原球茎生物碱含量的变化
不同浓度尖孢镰刀菌诱导子处理3 d后铁皮石斛原球茎生物碱含量的情况变化见图4,添加诱导子的组别总生物碱含量均大于对照组;当诱导子浓度为200 mg/L时效果最好,生物碱含量达到峰值;当浓度继续增大时,总生物碱含量开始下降,诱导子浓度达到1 000 mg/L时总生物碱含量与对照组相差无几,由此可见,适宜浓度的尖孢镰刀菌诱导子对促进铁皮石斛原球茎生物碱的积累与合成有促进作用。
2.4 不同浓度尖孢镰刀菌诱导子处理下铁皮石斛Do-HDR基因相对表达量的变化
不同浓度尖孢镰刀菌诱导子处理下铁皮石斛Do-HDR基因相对表达量的变化见图5,诱导子浓度为100 mg/L时,Do-HDR基因表达量略低于对照;诱导子浓度为200 mg/L时,Do-HDR基因的相对表达量急剧上升,达到最高值,为对照组的4.06倍;相应的,此时总生物碱含量也达到最高值,而诱导子浓度继续增大时Do-HDR 基因的表达水平开始下降,但相对表达量仍远高于对照组,相对表达量分别为对照组的2.11、2.50倍。
3 讨论与结论
铁皮石斛作为一种名贵中草药,具有很高的药用价值,其所含有的石斛碱是主要的药用成分之一,但铁皮石斛植株生长缓慢,野生资源匮乏,依靠野生资源无法满足市场需求。而铁皮石斛原球茎生长周期短,产量大,可实现工厂化生产,能够作为石斛碱提取的原材料[21]。
3.1 真菌诱导子促进铁皮石斛生物碱的合成和积累
植物能够通过快速调控次生代谢途径,产生特定的次生代谢物,在感染区域建立局部过敏反应,从而抵挡微生物的入侵[22]。而真菌诱导子(fungal elicitor)在植物和微生物的互相作用中作为一种特定的化学信号,能够通过诱导特定基因的表达,从而活化特定的代谢途径,促进代谢产物的生成或者积累[23]。许多研究结果表明[24-25],真菌诱导子对次生代谢产物的合成与积累有良好的促进作用,本研究中运用尖孢镰刀菌诱导子处理铁皮石斛原球茎成功的提高了生物碱含量。张向飞等[26]的研究结果表明,镰刀菌诱导子处理长春花愈伤组织16 h后,长春质碱的含量能够达到对照组的3倍多。文涛等[27]用黑曲霉诱导子处理使虎杖中白藜芦醇的含量达到对照组的2.25倍。诱导子的浓度很大程度上影响了植物的次生代谢过程,高浓度的诱导子对植物的生长不利,而低浓度的诱导子又无法高效诱导次生代谢产物的生成[28],本研究结果表明,当尖孢镰刀菌诱导子的浓度为200 mg/L时为最适浓度,生物碱含量最高。
3.2 Do-HDR基因可能参与调控铁皮石斛生物碱的合成与积累
铁皮石斛所含生物碱主要是具有倍半萜骨架的石斛碱,而倍半萜主要是通过甲羟戊酸途径合成,而一些研究结果表明,倍半萜也通过甲基赤藓糖磷酸途径合成[29],MEP途径也提供合成倍半萜所需的前体物质IPP和DMAPP,而HDR基因所编码的酶是催化前体物质合成IPP和DMAPP的直接物质,HDR基因是合成萜类物质的限速基因[30]。程琪庆等[31]的研究结果表明,SmHDR基因的相对表达量与丹参酮的含量呈正相关。在转HDR基因的银杏愈伤组织中,银杏内酯的含量显著高于对照组,进一步证明HDR基因对萜类合成的重要性[32]。本实验中,经过尖孢镰刀菌诱导子处理后。诱导子浓度为200 mg/L时总生物碱含量达到最高。荧光定量PCR的结果也表明,诱导子浓度为200 mg/L的组别Do-HDR基因相对表达量达到峰值,是对照组的4.06倍,之后开始下降,这一趋势与各组别生物碱含量的趋势大致相符,说明Do-HDR基因受尖孢镰刀菌诱导子的诱导,并与生物碱含量相关,推测Do-HDR基因参与促进铁皮石斛生物碱的合成与积累。
植物的次生代谢是一个非常复杂的过程,下一步的研究重点可能放在克隆与分析参与铁皮石斛生物碱合成途径的基因和功能验证上,为进一步研究植物的次生代谢途径提供更多的参考。
参考文献
[1] 中华人民共和国药典委员会. 中华人民共和国药典(一部)[S]. 北京: 中国医药科技出版社, 2010.
[2] 吴昊姝, 徐建华, 陈立钻,等. 铁皮石斛降血糖作用及其机制的研究[J]. 中国中药杂志, 2004, 29(2): 160-163.
[3] 冯 霞, 赵 欣. 铁皮石斛水提物对SD大鼠胃损伤的预防效果[J]. 江苏农业科学, 2013, 41(7): 294-296.
[4] 金乐红, 刘传飞,唐 婷. 石斛水溶性多糖的抗肿瘤作用及其机制的研究[J]. 健康研究, 2010, 31(3): 167-170.
[5] 张光浓, 毕志明, 王峥涛,等. 石斛属植物化学成分研究进展[J]. 中草药, 2003, 34(6): 5-8.
[6] 魏小勇, 方 花. 石斛屬药用植物分子生物学研究[J]. 上海中医药大学学报, 2005, 19(1): 47-49.
[7] Yang S, Gong Q, Wu Q, et al. Alkaloids enriched extract from Dendrobium nobile Lindl. attenuates tau protein hyperph osphorylation and apoptosis induced by lipopolysaccharide in rat brain[J]. Phytomedicine, 2014, 21(5): 712-716.
[8] Wang Q, Gong Q, Wu Q, et al. Neuroprotective effects of Dendrobium alkaloids on rat cortical neurons injured by oxygen -glucose deprivation and reperfusion[J]. Phytomedicine, 2010, 17(2): 108-115.
[9] 魏小勇. 石斛属植物生物碱研究进展[J]. 中国药事, 2005, 19(7): 445-447.
[10] Rohmer M, Knani M, Simonin P, et al. Isoprenoid biosynthesis in bacteria:a novel pathway for the early steps leading to isopentenyl diphosphate[J]. Biochem J, 1993, 295(3): 517-524.
[11] Tholl D. Terpene synthases and the regulation,diversity and biological roles of terpene metabolism[J]. Current Opinion in Plant Biology, 2006, 9(3): 297-304.
