P16基因抑制胃癌细胞转移的机制初步研究
2015-10-21朱崎欧瑜李杰通
朱崎 欧瑜 李杰通
摘要:目的: 将p16重组质粒转染人高转移胃癌细胞株MKN-28中,观察转染前以及转染后p16基因对胃癌细胞侵袭转移能力与运动能力的影响。在基因的水平探讨p16基因对于胃癌细胞转移的抑制机制。方法: 通过脂质体传染法顺利的将p16重组质粒转染到MKN-28细胞株中,根据Transwell小室测定法测定细胞穿膜侵袭的能力,利用SDS-PAM凝胶电泳法检测明胶酶的活性。结果: 在经过p16重组质粒转染后,根据显微镜下的计数显示,胃癌细胞能够穿透基底膜的数量与转染前相比具有明显的减少(p<0.05),具有统计学意义。细胞的运动能力也是差与转染前。PAM凝胶电泳显示负染带的宽度有明显的变窄,降解基质膜的转移能力明显下降。结论: p16基因抑制胃癌细胞的转移可能是通过对癌细胞的侵袭和运动能力的控制得以实现的。
关键词:p16基因;胃癌细胞;癌细胞转移
资助项目:湖南省教育厅科技计划项目(13C963)
胃癌是一种常见的消化系统恶性肿瘤,它严重危害着人们的身心健康,在全球肿瘤发病率以及死亡率中位居第2,给胃癌患者带来了很大的身体危害及心理压力[1]。并且目前胃癌的发病率在国内外均呈显著上升的趋势。临床医学上对于胃癌的治疗也是较为吸引人们的注目,目前利用肿瘤抑制基因对癌细胞的转移进行抑制成为研究的热点[2]。故本次研究利用p16转染人高转移胃癌细胞株MKN-28,研究转染前后p16基因对于胃癌细胞转移以及运动的能力的影响,旨在寻求一种能够为以后利用该基因进行癌症治疗的时候提供实验以及理论上的依据。
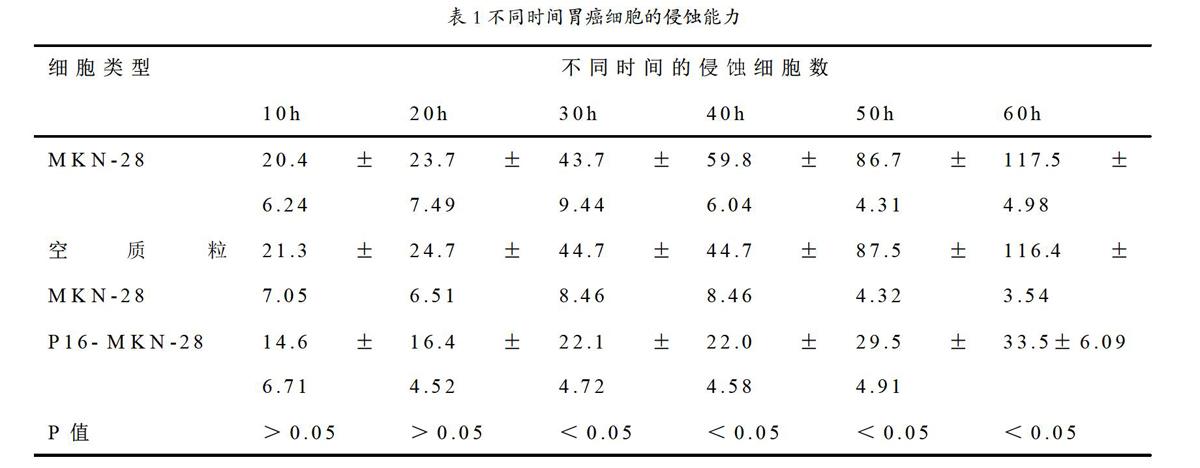
注:P值表示MKN-28与P16- MKN-28组间比较的结果。
1材料与方法
1.1主要试剂
P16重组质粒由本室进行构建,脂质体买自Invitrogen公司,RT-PCR试剂盒买自TaKaRa公司,RPMI1640培养基为Hyclone产品。G418及丙烯酰胺凝胶电泳试剂买自Sigma公司,Transwell细胞培养小室为Costor产品,纤维黏连蛋白和ECL试剂盒购自Invitrogen公司。
1.2细胞培养与处理
胃癌细胞株MKN-28接种于RPMI1640培养基,在37℃、含有50ml/LCO2 的湿润空气的恒温密闭式培养箱中进行培养。按照1×105/孔的细胞密度进行接种,并使用无血清培养液进行清洗。将脂质体稀释与无血清培养液中制备成混合溶液A。另将p16以及空白质粒稀释成B1和B2。然后将A与B溶液分别进行混合,并置室温放置20分钟。然后滴加混合液和无血清培养液,培养一定时间之后,换为G418完全培养液,然后筛选,扩大培养。设转染前胃癌细胞为空白对照组,而转染后为阴性对照组。
1.3细胞运动能力的测定
将实验用品先进行预冷处理,在室膜表面加入胶体,此时要注意涂抹要均匀,然后对着灯光轻轻拍打均匀。然后将其放在培养液中水化,然后在外膜上涂上纤维黏连蛋白,干燥。最后一定浓度的细胞放置于Transwell小室中进行培养,培养时间为10-60h,每10h小时为观察点。具体的观察方法为:将样品取出小室,用棉签擦去上室中的细胞,并用苏木素伊红染色,用树脂胶将其封片。400倍显微镜下在上下左右中五个不同的视野内将侵袭细胞进行计数,取平均。
1.4Western blot
将转染前后胃癌细胞置于细胞裂解液中,离心分离收集。配置一定含量的分离胶和浓缩胶,将样品与缓冲液等体积进行混合,并用蛋白质对参照物进行标记。电泳后使用清水以及缓冲液进行清洗,利用电转移法进行转膜。然后清洗干燥,加脱脂粉后封闭过夜。ECL试剂盒内的溶液等体积混合后滴加到膜上,温室孵育后用X线进行胶片曝光[2]。
1.5明胶酶活性检测
将细胞进行接种后,进行培养,然后离心分离去除细胞碎片,然后取长层液加入缓冲液后进行点样。电泳结束后,浸入孵育液中进行孵育,然后使用考马斯亮蓝进行染色,然后使用脱色液进行脱色,指导显示出白色条带为止。清洗观察。
1.6统计学分析
采用SPSS 15.0 统计学软件处理数据,结果采用均数±标准差表示, P<0.05为差异具有统计学意义。
2结果
2.1转染前后MKN-28胃癌细胞中p16蛋白的表达
进行转染重组质粒p16的实验组中在明确的蛋白位置出现p16的特异性目的蛋白质条带,但是转染空质粒以及转染前并没有出现这中特异性条带。
2.2转染前后MKN-28胃癌细胞的穿膜能力
显微镜下的细胞计数显示,随着实验时间的不断增长,具有侵袭能力的细胞数量呈增加的趋势。转染后胃癌细胞穿透基底膜的数量与为传染相比有很大程度上的减少,虽然在实验进行10h、20h的时候转染前后差异较小(p>0.05),但是30h以后,转染前后期差异较大(p<0.05),具有统计学意义。还能够看出,未转染和空质粒转的情况下,侵蚀细胞数没有很大差异。具体见表1。
2.3 转染前后MKN-28胃癌细胞明胶酶活性的情况
聚丙烯酰胺凝胶电泳的结果显示,转染后细胞的负染带宽度比转染前显著变窄,并且亮度也随之减弱,其转染前的积分吸光度值为31.2±0.56,转染后为27.8±0.51,两者相比具有统计学意义(P<0.05)。转染p16基因的胃癌细胞其基质膜降解和侵袭转移能力都有所下降。
3讨论
根据国内外大量的研究资料显示[3],抗遗传基因家族可以通过对肿瘤细胞間或者是肿瘤细胞外的细胞基质的作用进而影响到肿瘤细胞的浸润以及转移的能力,所以这里基因在控制肿瘤细胞转移的过程中显示出非常重要的作用。目前临床医学中已经证实,p16与胃癌细胞的转移具有很大的关系[4]。
侵袭、转移是胃癌等恶性肿瘤最为基本的性质,防止其转移和侵袭是降低死亡率的主要方法之一。而这些肿瘤细胞的运动能力是使其自身发生转移的重要作用。其主要的侵袭转移过程是先通过膜表面受体与基底膜发生粘附,然后它会释放出蛋白明胶酶并且将基底膜进行分解,之后才会运动穿过基底膜[4]。而p16基因可能会使其释放的明胶酶活性降低甚至是失去活性进而不能够使基底膜受到分解,所以会抑制癌细胞的转移与运动。
故本次研究采用p16基因作为胃癌细胞转移抑制剂,旨在探讨它对胃癌细胞的转移的抑制作用。研究结果显示,在胃癌细胞MKN-28进行转染后,在明确的蛋白位置出现p16的特异性目的蛋白质条带;转染后胃癌细胞穿透基底膜的数量与为传染相比有很大程度上的减少,虽然在实验进行10h、20h的时候转染前后差异较小(p>0.05),无统计学意义,但是30h以后,转染前后期差异较大(p<0.05),具有统计学意义。并且进过聚丙烯酰胺凝胶电泳测试后发现转染后细胞的负染带宽度比转染前显著变窄,其并且转染前的积分吸光度值为31.2±0.56,转染后为27.8±0.51,两者相比具有统计学意义(P<0.05)。
故p16基因对于抑制胃癌细胞的转移可能是通过对癌细胞的侵袭和运动能力的控制得以实现的,p16可以有效地对胃癌细胞的转移进行控制,为以后治疗研究胃癌的转移机制提供了依据。
参考文献:
[1]魏国华,杨春雨,杨静,高志安.Hp感染与p16基因甲基化在胃癌发生中的作用[J].肿瘤防治研究,2011,38(1):51-54.
[2]王犇,吕志发,谢勇.幽门螺杆菌感染、P16基因甲基化与胃癌[J].基础医学与临床,2014,34(9):1301-1304.
[3]周小潇,邓鑫,梁健,蒋曼君.胃宁颗粒对胃癌前病变基因甲基化的相关调控[J].时珍国医国药,2014,25(5):1037-1040.
[4]许春伟,葛畅,王鲁平.p16基因甲基化与结直肠锯齿腺瘤的Meta分析[J].诊断病理学杂志,2013,20(12):790-791+793.
