土壤水分对槟榔幼苗净光合速率和蒸腾速率的影响
2015-10-21陈歆刘贝贝彭黎旭
陈歆 刘贝贝 彭黎旭
摘 要 为实现槟榔幼苗标准化灌溉,采用盆栽实验,设置5个水分梯度[土壤相对含水量(30±5)%~(90±5)%],测定不同水分条件下槟榔幼苗的净光合速率(Pn)、蒸腾速率(Tr)、空气相对湿度(RH)、空气中CO2浓度(Ci)和气孔导度(Cond)等参数,研究各个因子对槟榔幼苗净光合速率(Pn)、蒸腾速率(Tr)的影响,采用回归分析分别拟合土壤水分与其净光合速率、蒸腾速率的数学模型。结果表明:(1)土壤相对含水量<60%时,影响槟榔幼苗Pn的主要因子是Cond、RH;土壤相对含水量≥60%时,影响槟榔幼苗Pn的主要因子是Ci、RH。(2)土壤相对含水量45%~60%时,影响槟榔幼苗Tr的主要因子是Cond、Vpdl;土壤相对含水量60%~70%时,影响槟榔幼苗Tr的主要因子是Cond和Ci;其余水分条件下影响槟榔幼苗Tr的主要因子都是Cond。(3)根据本次研究,拟合土壤水分对槟榔幼苗净光合速率和蒸腾速率的数学模型分别为Pn=-0.001 8x2+0.293 9x-5.567 9,R2=0.998 1;Tr=-0.001 6x2+0.265 2x-6.008 3,R2=0.943 8。
关键词 土壤水分;净光合速率;蒸腾速率;槟榔幼苗
中图分类号 S59 文献标识码 A
Abstract In order to finding the standard irrigation of betelnut seedlings five moisture gradient(soil relative water content of 30% to 90%)were used to build. The determination of betelnut seedlings under different water conditions of net photosynthetic rate(Pn), transpiration rate(Tr), air relative humidity(RH), air CO2 concentration(Ci)and stomatal conductance(Cond)parameters, which were using to build the mathematical model of photosynthetic capacity and study the contribution of each factors to the seedlings of betel nut net photosynthetic rate(Pn), transpiration rate(Tr). Results showed that:(1)the soil relative water content < 60%, Cond and RH were the main factor affecting the Pn of betelnut seedling. When the soil relative water content of 60% or more, the main factors affecting the betelnut seedling Pn was Ci and RH.(2)When the soil relative water content of 45%-60%, the main factors affecting the Tr of betelnut seedling were Cond and Vpdl. Soil relative water content of 60% to 70%, the main factors affecting the Tr of betelnut seedling were Cond and Ci, While under the rest of Soil moisture the condition of the main factors affecting to the Tr of betelnut seedling were Cond.(3)According to the study, the mathematical model about the soil moisture effect on the betel nut seedlingsphotosynthetic rate and transpiration rate were Pn=-0.001 8x2+0.293 9x-5.567 9, R2=0.998 1; Tr=-0.001 6x2+0.265 2x-6.008 3, R2=0.943 8.
Key words Soil moisture; Photosynthetic rate; Transpiration rate; Betelnut seedlings
doi 10.3969/j.issn.1000-2561.2015.11.018
檳榔(Areca catechu L.)为棕榈科(Palmae)热带经济、药用作物;是中国四大南药之首,国内主要分布在海南、台湾两省[1]。海南岛属典型热带海洋气候,干湿季节分明。目前岛内农户种植槟榔主要集中在土壤贫瘠的山坡地,由于槟榔具有一定抗逆性,海南多数农户对槟榔种植管理较为粗放,常忽略土壤改造和水肥管理,以至于槟榔植株出现收获期变短,产量变少的现象。尤其在每年3~5月槟榔开花期影响更为突出,抑制了槟榔成树后期挂果数量[2]。
目前槟榔产业成为海南农业中仅次于橡胶的第二大支柱产业,发展前景十分广阔[3]。国内多研究槟榔的药理效应[4-5],在其植物生理生态上的成果不多。在前期槟榔的田间水分管理研究中发现,槟榔对逆境(低温和干旱)表现出不同的反应机制[6-10]。水分胁迫时,槟榔幼苗叶片的丙二醛(MDA)含量、脯氨酸(Pro)含量、可溶性糖(SS)含量及可溶性蛋白含量均呈现上的升趋势,超氧歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)呈先升高后下降的趋势[6,9-10]。土壤水分过低,槟榔幼苗叶片的PSⅡ反应中心会出现不易逆转的破坏[8]。且传统的研究多数是从光响应的角度考虑光合作用[11-16]。基于此,研究槟榔幼苗水分控制生理,分析环境因子对槟榔幼苗净光合速率和蒸腾速率的影响因素,了解不同水分条件下影响光合能力的制约环境因素,旨在为槟榔幼苗移栽提供指导。
1 材料与方法
1.1 材料
供试材料为海南长蒂槟榔种5月生槟榔幼苗,取自海南省儋州市西庆农场。选取已有4~5片叶,叶色浓绿,生长健壮的若干槟榔苗。采用盆栽方式,每盆定植1株;移栽苗盆直径22 cm,高21.5 cm。在槟榔基地就地取土,将风干土通过1.3 cm筛后装盆,土壤有机质含量9.15 g/kg,pH5.88。每盆装土5.5 kg。
1.2 方法
1.2.1 试验设计 试验于2009年7~11月在海南省儋州市两院实验基地(E 109.496°,N 19.512°)防雨大棚里进行。试验为随机区组设计,设土壤相对含水量分别为:30%±5%(T1)、45%±5%(T2)、60%±5%(T3)、75%±5%(T4)和90%±5%(T5)共5个处理。每个处理设置6个重复。
土壤水分测定。于2009年7月1~7日用称重法测定盆中土壤饱和含水量和土壤相對含水量(SRWC)即田间持水量的百分数。使用土壤水分速测仪(TDR-3A型,锦州阳光科技发展有限公司)测定与土壤相对含水量相对应的容积含水量,然后建立单位盆中土壤容积含水量和土壤相对含水量的关系式。
土壤水分管理。在每天的下午16 : 30~18 : 30进行控制,土壤相对含水量由TSCⅡ型智能化土壤水分快速测试仪实施监测,并辅助称重法控制。
1.2.2 光合参数测定 进行土壤水分胁迫处理5 d后,每隔15 d,选择在晴朗的天气条件下,在每组土壤水分胁迫处理中随机选取3株槟榔幼苗,利用Li-6400光合测定系统分析仪(美国Li-COR公司)测定不同土壤水分胁迫下槟榔幼苗的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Cond)、胞间CO2浓度(Ci)、空气湿度(RH)等参数。测定时采用开放式气路系统,每次测定均在07 : 00~12 : 00时进行,使CO2 浓度控制在(500±1)μmol/mol,光合有效辐射(PAR)(800±5)μmol/(m2·s),叶温30 ℃。测定时选取植株第2片完全展开叶。每株重复3个叶片,每片叶重复测3~6次。
1.3 数据分析
采用Excel 2003进行制图,DPS9.0软件进行数据分析与制表。
2 结果与分析
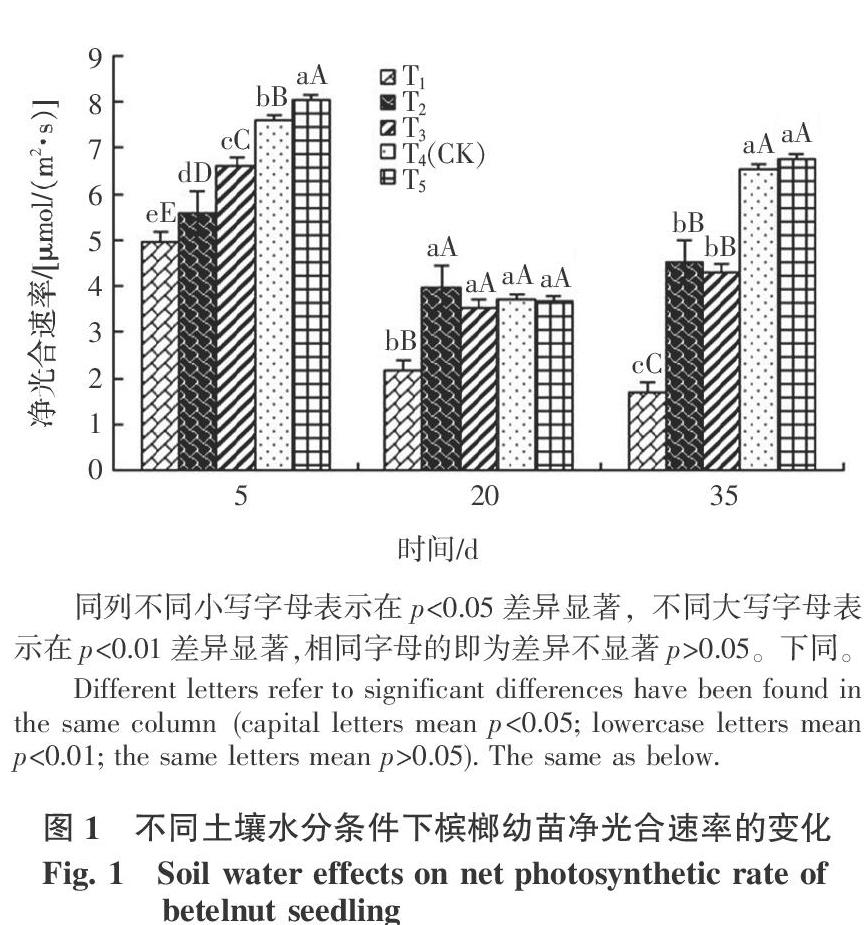
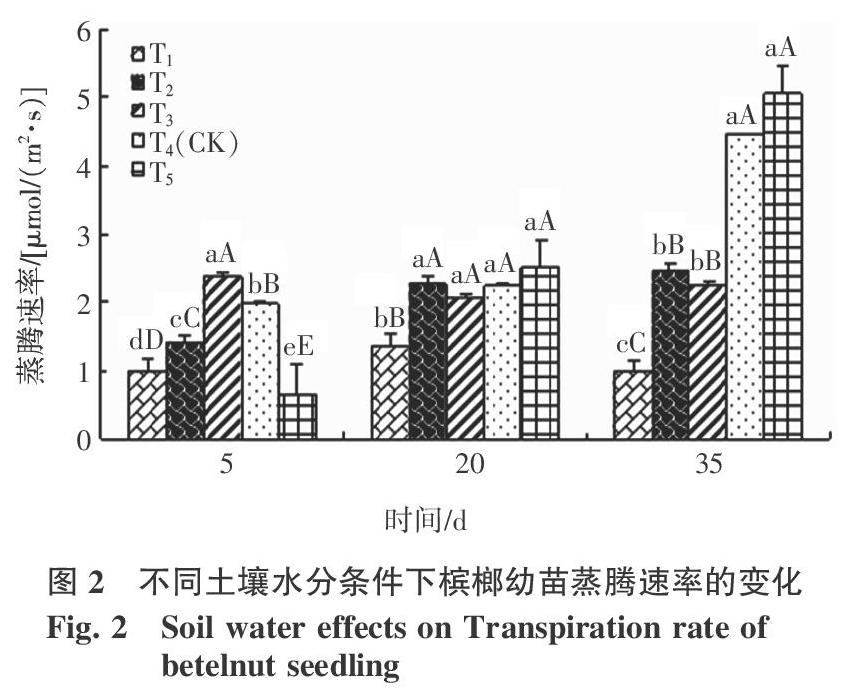
2.1 不同土壤水分条件下槟榔幼苗净光合速率和蒸腾速率的变化
槟榔幼苗的净光合速率对水分的变化比较敏感。因为在研究中,槟榔幼苗的净光合速率因土壤水分不同而表现出极显著性差异。且在整个研究过程里,土壤水分含量越低, 槟榔幼苗的净光合速率越小(图1)。长时间处于土壤相对含水量≥60%时,槟榔幼苗的净光合速率会有所恢复。
槟榔幼苗的蒸腾速率也对土壤水分变化十分敏感,其规律比其净光合速率的规律稍复杂。在研究初期,土壤相对含水量>60%条件下,蒸腾速率随土壤水分增加而降低;土壤相对含水量<60%时,蒸腾速率随土壤水分增加而增加。但土壤水分处理时间越长,槟榔幼苗的蒸腾速率则表现为随土壤水分降低而减少的趋势(图2)。
2.2 影响净光合速率的因子及排序
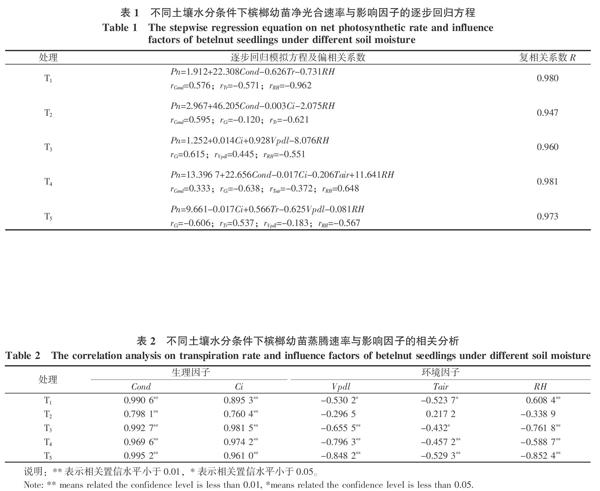
不同水分条件下叶片的Pn与环境因子及生理因子的综合关系可以采用多元回归方程来表示,以影响因子的偏相关系数大小来判断影响Pn因子的排列顺序。各处理下Pn表达式见表1。
由表1可知,不同土壤水分胁迫下影响槟榔幼苗净光合速率的因子并不相同。T1处理下,影响槟榔幼苗Pn的主要因子依次是RH、Cond和Tr;T2处理下,影响槟榔幼苗Pn的主要因子是依次Cond、RH;T3处理下,影响槟榔幼苗Pn的主要因子依次是Ci、RH;T4处理下,影响槟榔幼苗Pn的主要因子依次是Ci、RH;T5处理下,影响槟榔幼苗Pn的主要因子依次是Ci、Tr、RH。从上面对槟榔幼苗影响因子分析来看,土壤相对含水量 2.3 影响蒸腾速率的因子及相关分析 不同的水分条件下Tr变化不同,植物的Tr除了取决于植物的生理特征外,还受到环境因子的综合影响。通过对Tr和Cond、Ci、Vpdl、Tair、RH等5个因子的相关分析结果表明(表2),各个处理下槟榔幼苗的Tr与Cond、Ci均达到极显著性相关。且除T2处理外,槟榔幼苗Tr与Vpdl、Tair、RH也都达到显著性相关。 为了揭示Tr与各个因子的综合影响,利用多元回归方程来表达,如表3所示,不同水分条件下Tr与影响因子之间的复相关系数都比较高,表明Tr与影响因子之间的关系较紧密。按照不同处理下的偏相关系数大小可以看出,T1、T2、T5处理下,Cond是Tr值的主要影响因子;T3处理下,Tr值的主要影响因子是Cond、Vpdl;T4处理下,Tr值的主要影响因子是Cond和Ci。在本研究中,每个处理下对Tr一直都产生影响的因子是Cond。研究结果也表明,T1、T2处理下,Tr主要是受到生理指标影响, T3、T4、T5处理下,Tr值同时受生理因子和环境因子的影响。 2.4 进一步拟合土壤水分与槟榔幼苗净光合效率、蒸腾效率的关系 参照曾群英[16]的方法,根据水分处理后期的多次测定数据建立不同土壤水分条件下槟榔幼苗的净光合效率、蒸腾效率的数学表达。经过观测和拟合数学模型得到净光合速率、蒸腾速率与土壤相对含水量(x)的关系,其变化趋势均可用一元二次多项式来描述: 通过计算得到,土壤相对含水量81.63%是Pn最大值所对应的点,同理计算得到Tr的最大值出现在土壤相对含水量82.88%时。这说明土壤相对含水量81.63%是槟榔幼苗最适应光合作用的理论土壤水分条件,但维持槟榔幼苗蒸腾理论最佳的土壤相对含水量为82.88%。
3 討论与结论
光合作用是决定植物产量的关键过程[17]。土壤水分是影响植物光合作用的重要因素。植物水分不足时,气孔会被迫关闭,阻止CO2进入叶绿体,减少对空气中CO2的吸收,抑制其光合作用[18-19]。在研究中土壤相对含水量<60%时,槟榔幼苗的光合能力显著取决于气孔导度和空气湿度的大小。这说明土壤相对含水量低于60%易造成槟榔幼苗的气孔限制而导致其净光合速率下降[20]。因此,推测槟榔幼苗与大多数植物相似,通过关闭气孔,降低空气中CO2进入体内的数量来防止体内结构被破坏,从而避免机体受到伤害。研究还发现,槟榔幼苗在土壤水分低于一定程度时,更多受制于本身机体对外界变化的适应能力,即土壤相对含水量低于60%,槟榔幼苗的蒸腾速率对环境因子(温度、湿度、压力)变化的依赖性减小,这与左应梅[21]在木薯上的研究相似。且低水分条件下,土壤水分并非槟榔幼苗获取水分的唯一途径。土壤水分越低,空气湿度的变化越能够明显地影响槟榔幼苗的光合能力。本次研究中,土壤水分≤30%时,槟榔幼苗的净光合速率和蒸腾速率都显著低于其他处理。这佐证了槟榔幼苗的PSⅡ反应中心会出现不易逆转的破坏[8]。
蒸腾速率不能准确地反应植株整体(整株或群落)的水分消耗量,但仍是个重要的植物散失水分的指标[22]。研究中,温度、湿度、压力、气孔导度和空气中的CO2浓度都极显著地影响槟榔幼苗的蒸腾速率。土壤相对含水量越高,槟榔幼苗的蒸腾速率与大气湿度呈负相关关系,且大气压力对蒸腾速率的影响会逐渐减小。但不论土壤相对含水量如何,蒸腾速率与槟榔幼苗叶片气孔导度的相关性仍保持在较高的水平。气孔导度对槟榔幼苗蒸腾速率的影响要大于其对槟榔幼苗净光合速率的影响。进一步研究中发现,土壤相对含水量≥60%时,外界因子和生理因子的变化都会影响槟榔幼苗的蒸腾速率[23-24]。且空气相对湿度通过影响叶片与空气的饱和水汽压差来影响蒸腾[25]。因此,通过控制蒸腾速率来控制槟榔幼苗的光合能力会显得相对困难。土壤相对含水量≥60%时,槟榔幼苗叶片的气孔大小变化更能影响其蒸腾速率。气孔变小,使进入叶片中的空气中CO2受阻。在CO2固定受限制的条件下,还原力产量的比率能够胜任卡尔文循环中需要的还原力比率[26-27]。这说明水分处理初期槟榔幼苗会启动自身保护机制。在土壤相对含水量≥90%时,大气湿度增高不利于提高槟榔幼苗的蒸腾速率,同时改变大气压力对促进槟榔幼苗光合能力作用甚微。但这一现象,还需进一步研究槟榔的生长规律给予确定。
本次研究中,通过回归分析进行预测得到,盆栽槟榔幼苗的最大净光合速率出现在土壤相对含水量81.63%时,最大蒸腾速率出现在土壤相对含水量82.88%时。在前期研究中,土壤相对含水量75%±5%较有利于槟榔幼苗的生长。因此,根据本次研究得到的理论值,推测适合槟榔幼苗生长的最高含水量范围应该约为80%±5%,但精确数值仍需深入研究。
参考文献
[1] 何振革. 海南省槟榔产业发展存在问题及对策[J]. 安徽农学通报, 2007, 13(13): 109-110.
[2] 陈 歆. 海南槟榔产业发展概况[J]. 世界热带农业信息, 2008(9): 3-4.
[3] 邓秀成. 海南槟榔产业格局的成因分析及对策[J]. 热带农业科学, 2008, 28(3): 47-50.
[4] 王 平. 槟榔的促胃动力作用及其有效组分的探索[D]. 南京: 南京医科大学, 2012.
[5] 李奉华. 槟榔碱对口腔粘膜上皮细胞MMP-2及成纤维细胞CTGF表达影响的信号通路机制研究[D]. 长沙: 中南大学, 2013.
[6] 陈思婷, 孙程旭, 曹红星, 等. 干旱胁迫对槟榔幼苗生理生化特性的影响[J]. 江西农业学报, 2009, 21(10): 70-72.
[7] 曹红星, 冯美利, 孙程旭, 等. 低温及干旱胁迫对槟榔幼苗生理生化特性的影响[J]. 西南农业学报, 2010, 23(3): 832-835.
[8] 陈 歆, 刘贝贝, 彭黎旭, 等. 土壤水分胁迫对槟榔幼苗叶绿素荧光动力学特性的影响[J]. 热带作物学报, 2012, 33(2): 35-42.
[9]陈 歆, 杨福孙, 周兆德, 等. 土壤水分胁迫对槟榔幼苗光合特性的影响[J]. 热带农业科学, 2010(2): 8-12.
[10] 陈 歆, 杨福孙, 周兆德. 土壤水分胁迫对槟榔幼苗叶片生理的影响[J]. 热带作物学报, 2010, 31(3): 387-392
[11] Ye Z P. Application of light-response model in estimating the photosynthesis of super-hybrid rice combination-ⅡYouming 86[J]. Chinese Journal of Ecology, 2007, 26(8): 1 323-1 326.
[12] Jiang G M, He W M. A quick new method for determining light response curves of photosynthesis under field light conditions[J]. Chinese Bulletin of Botany, 1999, 16(6): 712-718.
[13] Miko U F K, Graham D F. Investigation of the CO2 dependence of quantum yield and respiration in eucalyptus pauciflora[J]. Plant Physiology, 1987, 83(4): 1 032-1 036.
[14] Baly E C C. The kinetics of photosynthesis[J]. Proceedings of the Royal Society of London Series B: Biological Sciences, 1935, 117(804): 218-239.
[15] Thornley J H M. Dynamic model of leaf photosynthesis with acclimation to light and nitrogen[J]. Annals of Botany, 1998, 81(3): 431-430.
[16] 曾群英, 刘素青, 李林峰, 等. 真红树植物的净光合速率与其相关生理生态因子的关系[J]. 西北林学院学报, 2015, 30(3): 28-34
[17] 郝卫平. 干旱复水对玉米水分利用效率及补偿效应影响研究[D]. 北京: 中国农业科学院, 2013.
[18] A llakhverdiev S I, Sakamoto A, Nishiyama Y, et al. Inactivation ofphotosystems I and II in response to osmotic stress in Synechococcus: Contribution of water channels[J]. Plant Physiology, 2000, 122: 1 201-1 208.
[19] Ashraf M, Shahbaz M. Assessment of genotypic variation in salt tolerance of early CIMMYT hexaploid wheat germplasm using photosynthetic capacity and water relations as selection criteria[J]. Photosynthetica, 2003, 41: 273-280.
[20] Winter K, Schramm M J. Analysis of stomatal and nonstomatal components in the environmental control of CO2 exchanges in leaves of Welwitschia mirabiliss[J]. Plant Physiology, 1986, 82: 173-178.
[21] 左應梅, 陈秋波, 邓权权, 等. 土壤水分、 光照和空气湿度对木薯气孔导度的影响[J]. 生态学杂志, 2011, 30(4): 689-693.
[22] 张国盛. 干旱、 半干旱地区乔灌木树种耐旱性及林地水分动态研究进展[J]. 中国沙漠, 2000, 20(4): 363-368.
[23] 夏尚光, 张金池, 梁淑英, 等. 南方岩榆光合作用日变化及其影响因子研究[J]. 亚热带植物科学, 2007, 36(3): 8-11.
[24] 王翼龙, 张硕新, 雷瑞德, 等. 秦岭火地塘林区锐齿栎光合、 蒸腾特性[J]. 西北林学院学报, 2003, 18(4): 9-12.
[25] 格日乐, 乌仁陶德, 张 力, 等. 几种沙漠植物蒸腾作用特性及其环境响应机制的研究[J]. 水土保持研究, 2007, 14(1): 184-186, 189.
[26] Horton P, Ruban A V, Walters R G. Regulation of light harvesting in green plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1996, 47: 655-684.
[27] Ort D R. When there is too much light[J]. Plant Physiology, 2001, 125: 29-32.
