香圆种子脱水耐性研究
2015-10-20庄珍等
庄珍等


摘要:采用自然脱水的方法,研究香圆种子失水对种子萌发的影响及其在失水过程中的生理响应,结果表明,香圆种子初始含水量为44.8%,对脱水敏感,具有轻度顽拗性;随着含水量的降低,种子发芽率逐渐下降,半致死含水量约为18.4%;当含水量低于10%时,种子发芽率接近0;脱水前期,随香圆种子含水率的降低,相对电导率、MDA含量、超氧阴离子自由基浓度、POD、SOD活性相应升高;脱水后期,POD活性仍处于较高水平,而SOD活性在含水量降至20%时达最大值。
关键词:香圆种子;脱水耐性;生理响应;贮藏特性;相对电导率;POD值
中图分类号: Q945.78文献标志码: A文章编号:1002-1302(2015)09-0229-03
根据贮藏特性,树木种子分为正常性种子、中间性种子和顽拗性种子[1-2]。正常性种子在成熟时将经历干燥脱水阶段,初始含水量通常处于15%~20%范围,继续脱水至含水量﹤5%仍不会对种子发芽力造成很大影响;中间性种子忍耐脱水的含水量通常为7%~12%[3];顽拗性种子对脱水反应敏感且在散落时还保持着代谢活性,成熟时含水量相对较高,为30%~60%,当含水量低于12%这一临界值时则会丧失生活力[4]。
香圆(Citrus wilsonii)为芸香科柑橘属植物,果实常用作中药材,近年来常作为园林绿化树种进行培养,以种子繁殖为主。香圆种子秋季成熟,春季播种育苗[5],种子成熟时具有较高的初始含水量,贮藏需要特殊处理才能保持种子的活力。香圆种子是否为顽拗性种子,其脱水耐性高低等研究尚未见文献报道。本试验研究香圆种子自然脱水对种子发芽力和种子生理生化的影响,分析种子的脱水耐性,为种子贮藏和种子使用提供理论依据。
1材料与方法
1.1试验材料
香圆果实于2014年12月上旬采自江苏省常熟市,在南京林业大学种子中心实验室剥取种子。香圆种子千粒质量为(468.3±4.4) g,种子纵径和横径分别为(15.52±1.33)、(9.37±1.21) mm。
1.2初始含水量的测定
选取新鲜香圆种子50粒,洗净种子表面胶质,使用吸水纸吸去水分;自然阴干至种子表皮发白,用1/1 000天平称质量;103 ℃烘箱中烘干处理17 h,取出称质量,计算种子的初始含水量(G)。重复3次。
1.3种子脱水处理
将香圆种子均匀平铺于通风室内,15 ℃左右室温自然干燥;每隔一段时间,随机选取100粒种子进行称质量,重复3次;计算种子的相对含水量,公式为:
含水量=m2-m1×(1-G)m2×100%。
式中,m1为种子在自然脱水之前的质量,m2为种子脱水后的质量。以初始含水量为起点,种子含水量每下降5%时,取样测定种子发芽力,操作方法为:从待测样品中取50粒种子,剥除内外种皮,置于棉床,25 ℃光照培养箱中发芽,以胚根伸长超过种子1/2长度作为萌发标准。重复3次。
1.4生理生化指标的测定
对不同脱水处理的种子分别进行生理生化指标测定。种子相对电导率的测定参照韩建国等的方法[6];丙二醛(MDA)和超氧阴离子自由基含量的测定参照高俊凤的方法[7];过氧化物酶活性(POD)的测定采用愈创木酚法[8];超氧化物歧化酶活性(SOD)的测定采用氮蓝四唑(NBT)法[9]。
1.5数据处理
采用Excel软件收集、处理数据并制作图表,SPSS 19.0软件进行方差及相关性分析。
2结果与分析
2.1种子的持水能力
由图1可见,香圆种子自然风干脱水速度较快;放置4 d,种子含水量从44.8%下降至30%,种子逐渐变硬,种皮开始皱缩;放置10 d时,含水量已降至10%,种子萎缩变小,种皮与种胚紧密相贴不易分离。这说明香圆种子自身持水能力较弱,不宜在自然条件下存放。
2.2种子含水量与发芽率的关系
由图2可见,新鲜香圆种子的发芽率可达100%,随着种子含水量的降低,种子发芽率呈下降趋势;当含水量高于40%时,种子发芽率变化差异不显著(P>0.05);当含水量降
至25%时,发芽率降至80%左右,随后发芽率下降速度加快,达到极显著水平(P<0.01);当含水量降至10%时,种子发芽率已接近0,此时脱水时间达10 d。相关性分析表明,种子含水量与发芽率之间存在极显著正相关关系(r=0.911**),种子半致死含水量约为18.4%,此时,脱水时间约为7 d。香圆种子保持活力的含水量水平远高于正常性种子,以此推测,香圆种子耐脱水性较弱,具有顽拗性种子的特征。
2.3脱水过程中种子相对电导率的变化
种子浸出液的相对电导率可以有效反映种子在脱水过程中细胞膜的完整性,判断其是否受到伤害。由图3可知,在脱水过程中,种子相对电导率整体呈上升趋势;含水量降低至30%的过程中,种子相对电导率显著上升(P<0.05);继续脱水,相对电导率增势减缓,相互间差异不显著(P>0.05)。这说明在脱水前期,香圆种子受到明显的胁迫伤害,电解质外渗量持续增加;增势渐稳的浸出液相对电导率超过70%,此时种子细胞膜系统已受到严重伤害,修复能力下降。
2.4脱水过程中种子丙二醛(MDA)含量变化
MDA是脂质过氧化的最终产物,会引起蛋白质、核酸等生物大分子的交联聚合,具有细胞毒性。由图4可知,在脱水过程中,香圆种子MDA含量缓慢升高;含水量降至10%时,MDA含量较处理前增加了54.7%,差异显著(P<0.05)。种子含水量的降低加剧了膜脂过氧化作用,种子细胞膜系统受损,引起 MDA累积,但是种子自身具备有应对机制,一定程度上可以消除脂质过氧化作用所产生的伤害,在种子含水量降至15%时,MDA含量与前期脱水差异不显著(P>0.05)。
2.5脱水过程中超氧阴离子自由基浓度的变化
超氧阴离子自由基作为活性氧的成员,其浓度变化是测定植物应对逆境胁迫反应的重要指标。由图5可知,脱水前期,香圆种子超氧阴离子自由基浓度缓慢上升,且差异不显著(P>0.05);含水量降至10%时,超氧阴离子自由基浓度迅速增高,与前期脱水相比差异显著(P<0.05)。这说明在脱水前期,香圆种子超氧阴离子自由基的浓度与其自身的抗氧化酶系统基本达到一种动态平衡,但随着脱水程度的加强,这一平衡被打破,种子超氧阴离子自由基的浓度增高,对种子造成较大伤害。
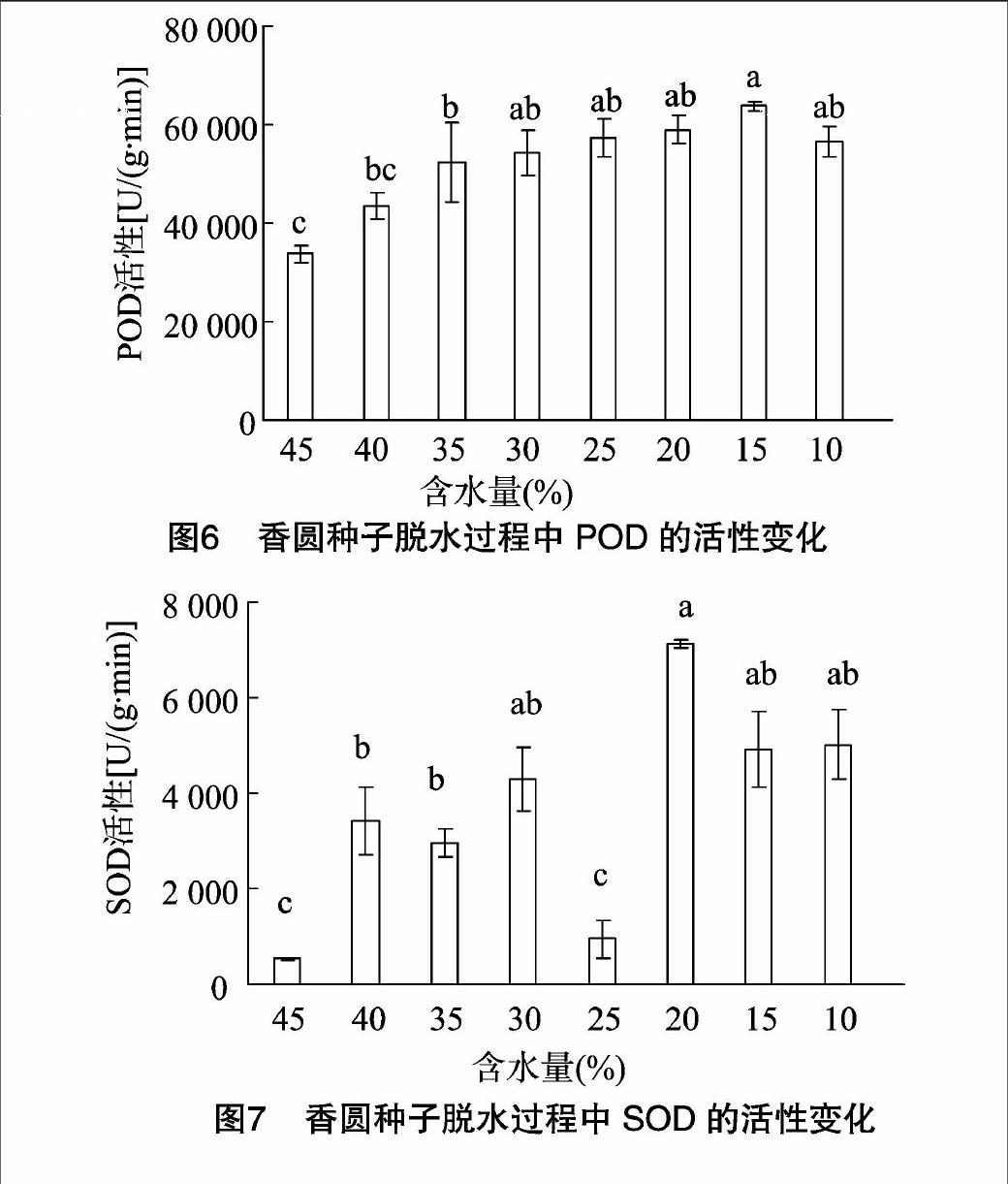
2.6脱水过程中POD、SOD的活性变化
POD和SOD均为植物细胞保护酶类,具有清除细胞内活性氧自由基的作用,通常情况下具有较高的活性,但面对胁迫时则会受到不同程度的影响。由图6、图7可知,随着含水量的降低,香圆种子POD活性逐渐上升,当含水量降至40%,其活性变化差异不显著(P>0.05);脱水前期,种子SOD活性的上升幅度达到显著水平(P<0.05),含水量降至20%时,SOD活性达到最大值,较初始脱水增幅达12倍。种子脱水过程中,POD与SOD活性相比整体水平较高,变化趋势平缓,SOD相对更为敏感,适度脱水SOD活性就明显提高。
3结论与讨论
顽拗性种子具有含水量高、不耐脱水和低温、种子体积较大且种胚所占体积小等特征。香圆种子为多胚种子,无胚乳,胚与子叶比重很小。本试验证明,香圆种子初始含水量达
44.8%,半致死含水量约为18.4%,含水量低于10%则会完全丧失活力,具有顽拗性种子的特征。
脱水对细胞的伤害主要表现为质膜或细胞器膜结构和功能受到破坏,引起电解质大量外渗[10]。在脱水过程中,香圆种子浸出液的相对电导率逐渐升高,后趋于平缓,说明脱水使种子细胞膜遭到破坏,种子细胞膜系统发生明显的脂质过氧化作用,导致膜完整性的丧失、代谢紊乱、DNA损伤及种子活力丧失等[11]。香圆种子的脱水劣变与MDA含量的累积有一定关系,种子发芽率与MDA含量变化呈显著负相关关系(r=-0.512*),这与枇杷(Eriobotrya japonica)、棕榈(Trachycarpus fortune)等一些典型顽拗性种子[12-13]相比程度较轻缓,这说明香圆种子受到脱水胁迫时发生的脂质过氧化作用程度较轻,其顽拗性水平也较低,可以忍耐一定程度的脱水。
自然脱水还对香圆种子活性氧与抗氧化酶系统之间的消长平衡产生影响。随着含水量的降低,香圆种子超氧阴离子自由基的浓度逐渐升高,对种子细胞造成伤害,而种子自身则产生积极应对机制,表现为抗氧化酶活性有所升高。当种子含水量降至15%时,脂质过氧化进一步加强,MDA和活性氧自由基的累积抑制了抗氧化酶系统的活性,导致膜系统的保护功能降低,SOD活性迅速下降,超氧阴离子自由基浓度则开始增高,而与SOD活性的变化不同,POD活性在脱水后期并没有下降趋势。研究表明,POD不仅与植物的形态建成和抗逆性有关,还是植物成熟和衰老的生理指标[14];杨小胡等指出,POD能够起到类似于多酚氧化酶(PPO)的酶促劣变作用[15];板栗(Castanea mollissima)果实成熟后期,POD活性的升高与果实褐变强度有显著的相关性[16]。香圆种子POD活性的变化规律与顽拗性种子七叶树(Aesculus chinensis)在脱水过程中的表现[17]相似。这可能是POD活性的增高不仅起到清除活性氧自由基的作用,还与种子的衰老程度呈正相关,但是否促进种子劣变还有待进一步研究论证。
近年来,顽拗性种子脱水耐性和贮藏特性的研究较多。研究表明,顽拗性种子不耐干藏,宜采用低温湿藏法进行保存。例如,脱水敏感的栓皮栎(Quercus variabilis)种子在贮藏过程中,种子含水量不应低于46.3%,贮藏温度宜保持在零度以上,避免低温引起冻害或冷害[11];枸橼(Citrus medica)种子一般采用沙藏法保存,种沙体积比为1 ∶3,湿沙含水量为5%~10%,也可采用分层湿藏法[18]。
香圆种子应属轻度顽拗性种子,贮藏方法可参照枸橼种子采用湿藏法。不过,不同程度的顽拗性种子对低温和湿度的耐受程度不尽相同,香圆种子的最佳贮藏条件还有待进一步深入研究。
参考文献:
[1]Roberts E H. Predicting the storage life of seed[J]. Seed Science and Technology,1973(1):449-514.
[2]Ellis R H,Hong T D,Roberts E H. An intermediate category of seed storage behaviour Ⅰ. Coffee[J]. Journal of Experimental Botany,1990,41(230):1167-1174.
[3]Hong T D,Ellis R H,Linington S. Compendium of information on seed storage behaviour[M]. The Royal Botanic Gardens,1998.
[4]简令成.植物抗寒机理研究的新进展[J]. 植物学通报,1992,9(3):17-22,16.
[5]孙昌高,方坚,徐秀瑛.芸香科药用植物种子发芽的研究[J]. 基层中药杂志,1999,13(2):24-26.
[6]韩建国,钱俊芝,刘自学.PEG渗调处理改善结缕草种子活力的研究[J]. 中国草地,2000(3):22-28.
[7]高俊凤.植物生理学实验指导[M]. 北京:高等教育出版社,2006.
[8]李忠光,龚明.愈创木酚法测定植物过氧化物酶活性的改进[J]. 植物生理学通讯,2008,44(2):323-324.
[9]沈文飚,徐朗莱,叶茂炳,等. 氮蓝四唑光还原法测定超氧化物歧化酶活性的适宜条件[J]. 南京农业大学学报,1996,19(2):101-102.
[10]宗梅,蔡丽琼,吕素芳,等. 不同脱水方法对板栗胚轴脱水敏感性和生理生化的影响[J]. 园艺学报,2006,33(2):233-238.
[11]温祺,彭祚登,金莹杉.脱水敏感的栓皮栎种子贮藏方法研究[J]. 林业科技开发,2009,23(6):91-94.
[12]陈俊松,陈润政,傅家瑞.枇杷种子的脱水敏感性与膜脂过氧化作用[J]. 植物生理学报,1999,25(4):369-374.
[13]李朋.蒲葵和棕榈种子脱水耐性的研究[D]. 重庆:重庆师范大学,2012.
[14]梁艳荣,胡晓红,张颍力,等. 植物过氧化物酶生理功能研究进展[J]. 内蒙古农业大学学报:自然科学版,2003,24(2):110-113.
[15]杨小胡,石雪晖,王贵禧.板栗贮藏保鲜的研究进展Ⅰ[J]. 湖南林业科技,2004,31(6):73-76.
[16]陶月良,徐象中,叶茂宗,等. 板栗果实褐变的生理因子初探[J]. 浙江农业学报,2001,13(1):42-45.
[17]陈淑芬.七叶树种子脱水敏感性机理研究[D]. 南京:南京林业大学,2006.
[18]周祥锋,陈朝.枸橼贮存和播种[J]. 中国林业,2006(7):35.于
