锂离子电池负极材料M 2P2S6(M=Ni,M n)的合成及电化学性能研究
2015-10-19徐杉刘康刘小红刘恋张晴王石泉冯传启
徐杉,刘康,刘小红,刘恋,张晴,王石泉,冯传启
(湖北大学化学化工学院,湖北 武汉 430062)
0 引言
近年来,具有二维结构和特殊的物理化学性质(如电荷密度波、电磁各向异性和可逆化学反应等)的过渡金属硫属化合物如MX2(MoS2,WS2)、MPS3和M2P2S6(M为过渡金属;X为S,Se),日益受到研究者的重视[1-4].早在20世纪60年代末,Gamble等[5]发现某些过渡金属二硫化物及其夹层化合物(以下简称夹层物)展示了低温超导性,这使人们对具有二维层状结构的硫属类化合物及其夹层物的研究产生了极大兴趣.70年代初,研究者发现一些过渡金属硫代连二磷酸盐化合物(M2P2S6,M=Mn,Fe,Ni,Co等)具有类似于过渡金属二硫化物(MoS2)的层状结构特征和氧化还原夹层反应特性,并表现出了特殊的磁各向异性,这些发现引起学术界的关注.例如,Li与Ni2P2S6形成夹层化合物后的能量密度输出理论值是Li/TiS2电池的两倍[2,4];分子二阶极化率β值大的发色基团DAMS+与Mn2P2S6形成的Mn0.86PS3(DAMS)0.28同时具有铁磁性和二阶非线性光学性质[4,6].
过渡金属硫代连二磷酸盐M2P2X6(M为过渡金属)的二维结构可以看作是由S2-阴离子按ABC密堆积方式排列而成的.M2P2X6还可作为MX(M=ⅣB和ⅤB过渡金属元素,X=硫属元素)的衍生物用分子式M2/3(P2)1/3X2描述,只是其中的三分之一阳离子位置由磷原子对P2占据而已.图1给出M2P2X6的层状结构图[2-3],图1a为立体图,图1b为板层投影图,大空心圆为八面体顶点X原子,小空心圆(加黑边)为八面体中心金属原子M或P2原子对.在板层内部,过渡金属或磷原子对与硫属元素以强的共价键结合,在层间只存在弱的范德华作用力.在一定条件下,某些物质(原子、分子或离子)可以克服层间的作用力而可逆地插入层间空隙,而不破坏其原有的层状结构,从而形成各种夹层化台物[4].
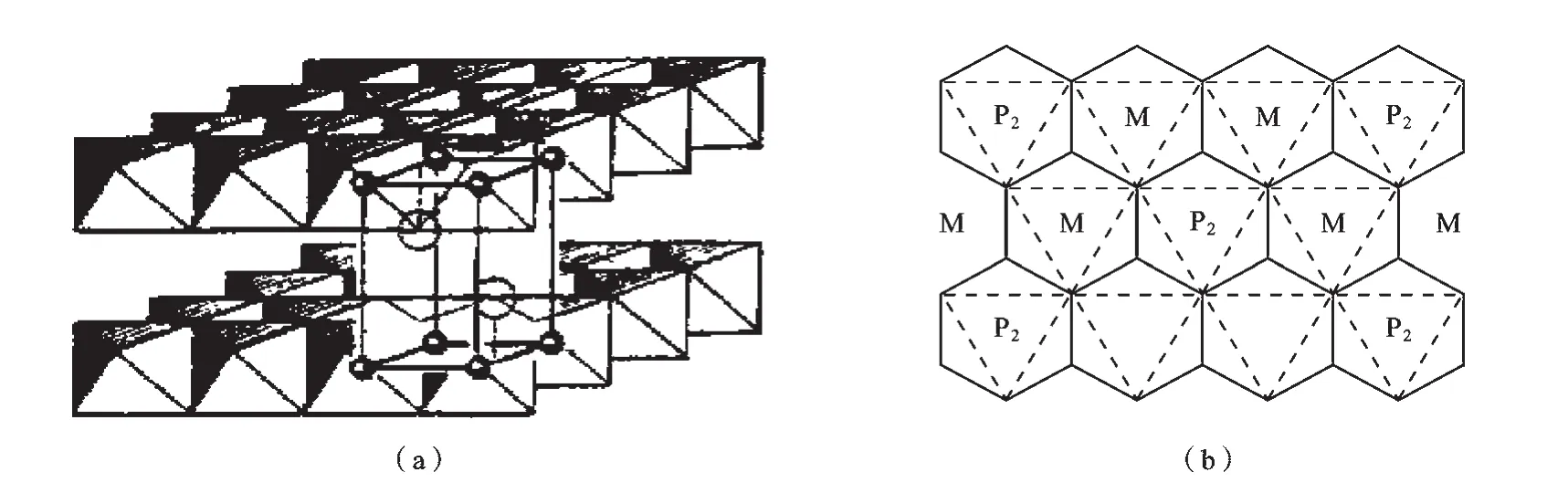
图1 M2P2X6的层状结构
硫代连二磷酸盐的合成方法发展到今天大致可以分为以下3种:(1)高温固相合成法:硫代连二磷酸盐的合成过去都采用高温固相反应.高温固相法合成硫代连二磷酸盐(以Mn2P2S6为例)的反应方程式如下:
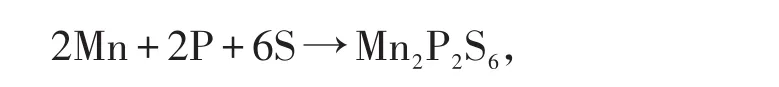
其局限性[7]有:第一,由于固相反应的扩散与成核都需要高能量,所以大多数反应温度都高于500℃;第二,不易得到均相产物;第三,无法批量生产.(2)化学沉积法:该法是在水、甲醇等溶剂中让碱金属硫代亚磷酸盐与过渡金属化合物直接反应.用这种方法大多得到的是无定形产物[8].(3)室温固相合成法:室温固相反应具有不使用溶剂、节省能源、设备和操作工艺简单、选择性好、产率高、环境污染小等优点,作为一种化学合成手段符合绿色化学的原则和要求,在物质和材料的合成中日益受到重视[9-10].室温固相法是应对高温固相法苛刻的反应条件而发展的一种新的合成方法.该方法是通过把碱金属硫代连二磷酸盐与过渡金属盐按比例充分碾磨均匀得到产物.忻新泉等[7,9-10]用室温固相合成的方法在配合物的合成上做了大量工作,黄种乐等[4,11]用室温固相法合成了M2P2S6(M=Mn,Ni)并对其XRD,TG进行了一系列分析,然而并未对其电化学性能作进一步研究.到目前为止,还没有发现硫代连二磷酸盐在有关锂离子电池方面的报道.
本实验采用室温固相法以自制的Na4P2S6·6H2O前驱体和MnCl2·4H2O(NiCl2·6H2O)为原料合成了具有层状结构的M2P2S6合成硫代连二磷酸盐(以Mn2P2S6为例)的反应方程式如下:
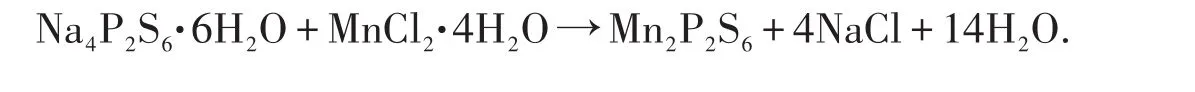
1 实验部分
1.1 Na4P2S6·6H2O的合成称取75 g Na2S·9H2O溶解于含100mL蒸馏水的锥形瓶中放置于电磁搅拌器上,用滴定管缓慢滴加6.60mL的PCl3,随着PCl3的逐渐加入,反应越来越剧烈并且溶液颜色由无色变为乳白色.当PCl3滴加完毕后,将锥形瓶移至冰水浴搅拌20min,再在室温下搅拌1 h使其充分反应.最后将反应液置于冰箱中放置18 h,让其充分结晶,最后用水的乙醇溶液100mL(水和乙醇的体积比为3∶1)重结晶得到Na4P2S6·9H2O.
1.2 Mn2P2S6的合成以Na4P2S6·9H2O和MnCl2·4H2O为原料按1∶2物质的量比将反应物置于研钵中,一经研磨,颜色变为黄绿色充分研磨2 h后,用水充分洗涤以除去产物中的NaCl,经无水乙醇洗涤后在烘箱中120℃干燥5 h.
1.3 Ni2P2S6的合成以Na4P2S6·9H2O和NiCl2·6H2O为原料按1∶2物质的量比将反应物置于研钵中,一经研磨,反应体系的颜色由反应物的白色和草绿色变成深褐色,充分研磨30min后,用水充分洗涤以除去产物中的NaCl,经无水乙醇洗涤后在烘箱中120℃干燥5 h.
1.4 表征和电化学测试制备出的两种样品都进行了X线衍射(XRD),扫描电镜(SEM),能量散射(EDS)元素分析,红外光谱(IR),热重分析(TG)的测试,并作为负极材料组装成锂离子电池进行电化学性质测试.按质量比65∶25∶10的比例称取制备的样品(65mg)、乙炔黑(25mg)、PVDF聚四氟乙烯乳液(10mg)混合均匀,加入异丙醇溶剂,在玛瑙研钵进行研细,调和均匀,得到易压制成膜的膏状混合物,然后在压模机上压成膜,将压好的电极膜在真空干燥箱中控温125℃,干燥24 h,取出后切割成面积约为1 cm2的小膜,按压在不锈钢或镍网上,放入干燥器中备用.在充满氩气的手套箱中装配扣式电池(CR2016),电解液为1mol/L LiPF6/EC+DEC(体积比为1∶1),隔膜为Celgard2400微孔聚丙烯膜,对电极为金属锂片.在Neware电池综合测试系统上进行充放电测试实验,电压范围为0.01~3.00 V,电流密度为100mA/g.
2 结果和讨论
2.1 XRD表征如图2所示,Mn2P2S6的XRD图上所有的衍射峰均与晶格常数a=0.607 7 nm,b=1.052 4 nm,
c=0.676 9 nm,β=107.35°(JCPDSNO.78-0495)相对应.2θ值13.64°,29.74°,52.10°分别与[001],[130],[060]的晶面对应.这表明,当前合成条件下可以获得纯 Mn2P2S6[12].Ni2P2S6的2θ值14.13°,22.39°,23.57°,27.05°,28.83°,34.23°,37.26°,39.34°,50.79°与[001],[111],[002],[112],[130],[022],[112],[132],[060][4]相一致.它表明用室温固相法成功合成了Ni2P2S6.
2.2 SEM及EDS表征图3显示了Mn2P2S6(a)和Ni2P2S6(b)的扫描电镜图(SEM)及其能量散射谱图(EDS)及元素分析表(表1).图3a中可以清楚地看到,大量直径为40~50 nm纳米球堆积成片状结构或球状结构.可以预计到该形貌有利于提高表面反应,支持嵌入Li+.Ni2P2S6与Mn2P2S6的形貌截然不同,它是由不同大小粒子聚成块状结构.图3(c,d)为M2P2S6样品在SEM上的能量散射谱图.从图中可得知,制备的样品的元素成分分别为Mn,P,S,Si,C和Ni,P,S,其中Si和C来自于测试所用的硅片和导电胶.考虑到误差与测量精度不强的存在,各原子数比接近理论原子比,进一步证明产物为纯净物.

图2 Mn2P2S6和Ni2P2S6的XRD图
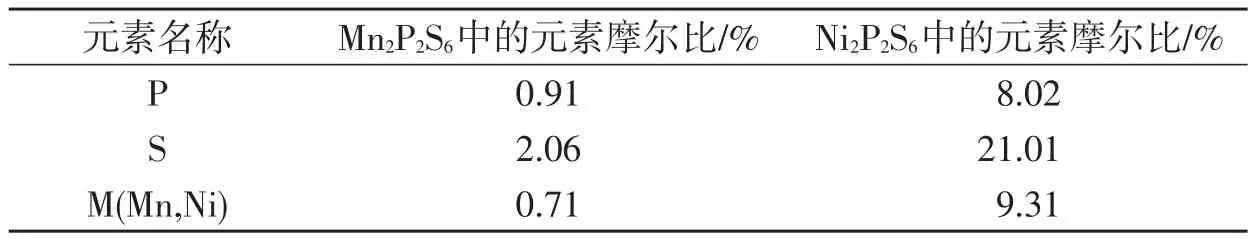
表1 M n2P2S6和Ni2P2S6的EDS元素分析
2.3 IR和TG表征图4a的红外光谱表现出强烈广泛的不对称线且最大值在559 cm-1.事实上,这个峰分为两部分分别为552和566 cm-1.根据报道过的其他硫代连二磷酸盐的文献得知这是“PS3”中(P-S)的伸缩振动峰υd.图谱显示在531 cm-1处有4 个弱峰.考虑到参考文献[13-14]中的结果和Joy Vasudevan[14]和Sourisseau等[14-15]对于其他硫代连二磷酸盐的结论,位于458 cm-1的弱峰应该属于Tz(PS3)振动,那些位于274,406和438 cm-1的峰应归因于υd和δd(PS3)模式.因此所得红外结果与之前报道的M2P2S6红外光谱一致.图4b表明,在空气下,Mn2P2S6在100℃失水,在440~610℃间6个硫原子被氧原子取代.Ni2P2S6的情况与Mn2P2S6类似.Ni2P2S6在288~645℃失重12.9%,表明3个硫原子被氧原子取代,氧取代是一个放热过程,取代第3~6个硫时最为明显.其他3个硫原子在645~730℃被氧原子取代[4].
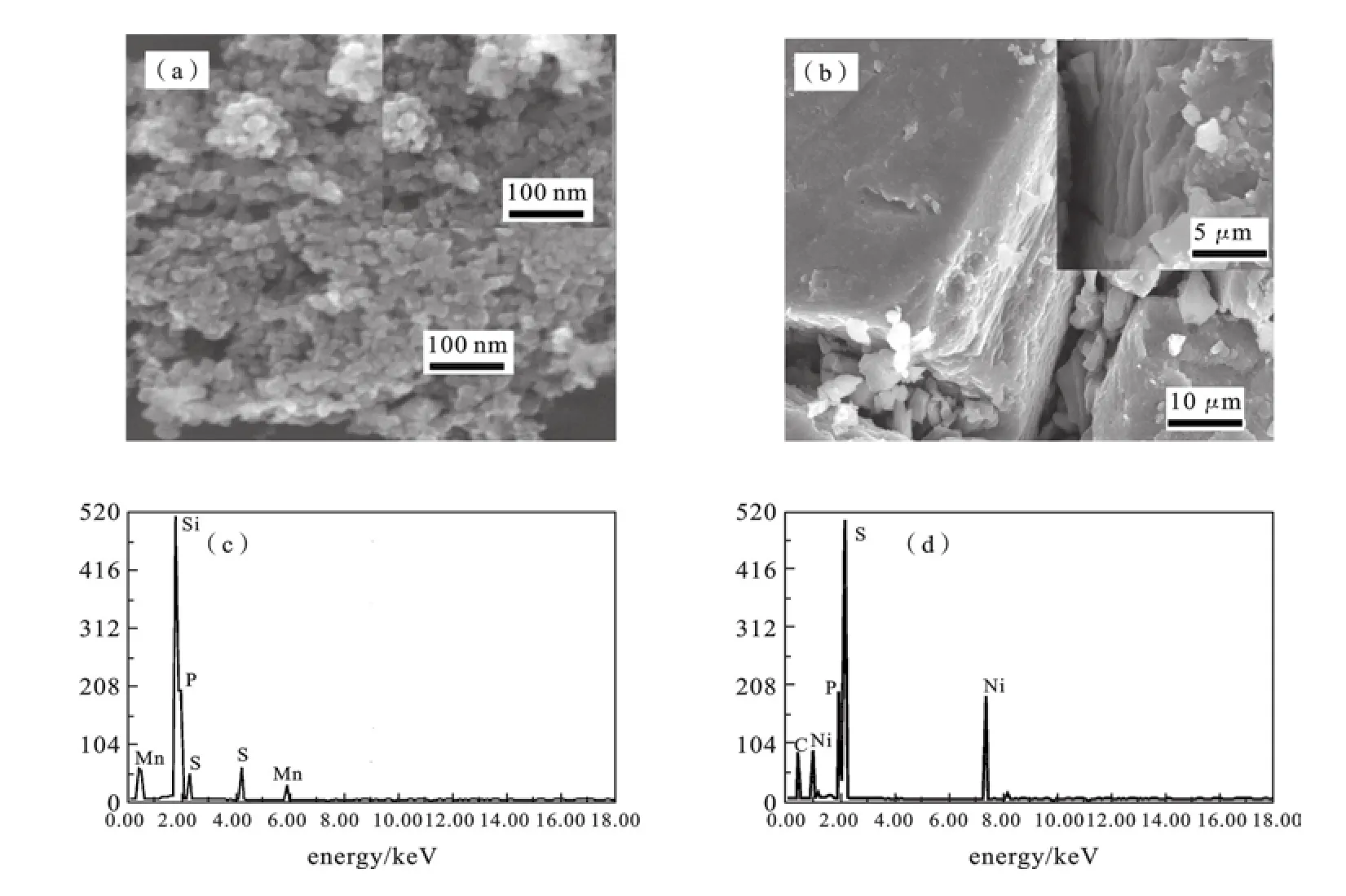
图3 Mn2 P2S6(a)和Ni2P2S6(b)的SEM图和Mn2 P2 S6(c)、Ni2 P2 S6(d)的EDS图
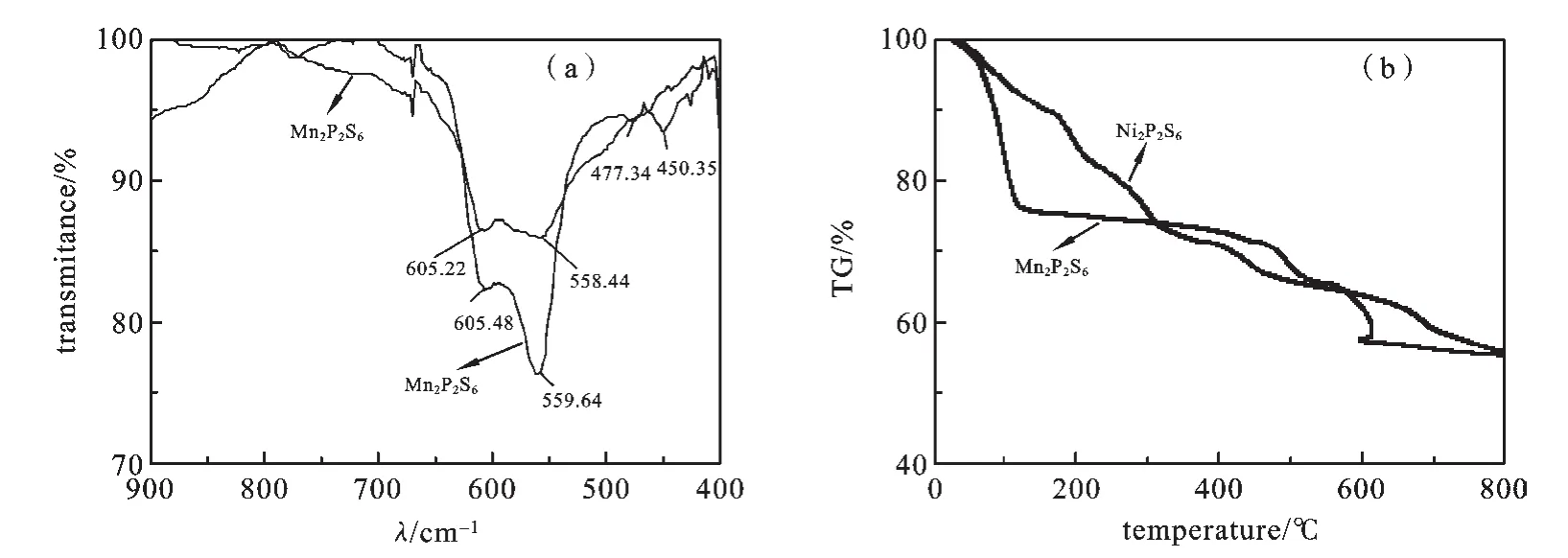
图4 M2P2 S6(M=Mn,Ni)的IR图(a)和M2 P2S6(M=Mn,Ni)的TG图(b)
2.4电化学性能分析图5表现了M2P2S6(M=Mn,Ni)的电化学性质.图5(a)和图5(b)显示,M2P2S6(M=Mn,Ni)的充放电曲线电压范围为0.01~3.00 V,电流密度为100mA/g.两个电极材料的初始比容量M2P2S6(M=Mn,Ni)分别为800和911mAh/g.Mn2P2S6在2圈,20圈,50圈循环后的放电比容量均在120 mAh/g左右,Ni2P2S6在2圈,20圈,50圈循环的放电比容量分别为608、273、95mAh/g.图5c为两种样品的循环性能的对比图.对于Mn2P2S6,第一圈到第二圈,放电比容量值从800mAh/g衰减到117mAh/g,后一直稳定在120mAh/g左右,且在循环后期比容量有所上升.对于Ni2P2S6,第一个10圈比容量急速衰减,50圈后放电比容量迅速衰减到95mAh/g.根据电池内部的离子反应过程,快速衰减的原因可能有以下几种.Mn2P2S6的第一次放电过程的反应和后续放电过程反应分别可能为Eq(1)和Eq(2).在第一次放电过程中,因为有Li7MnP4的产生[16-17],SEI膜的形成和空穴填充,首圈放电比容量得到显著增加.随后的反应中由于电压范围,电解液分解及各种外界因素的影响,电子转移数目x值会有不同,则其可逆比容量下降,根据计算,若x值为0,则Mn2P2S6的理论可逆比容量为257.7mAh/g.由实验结果得知,Mn2P2S6的可逆比容量50圈后稳定在121mAh/g,因此在进行可逆反应时1个Mn2P2S6分子里可以嵌入3个Li+.Ni2P2S6的第一次放电过程的反应和后续放电过程反应分别可能为Eq(1)和Eq(2,3).根据计算,x值为0时Mn2P2S6的理论可逆比容量为251.2mAh/g.然而Ni2P2S6的第二圈放电比容量为608mAh/g,又因为它在1.8 V和1.3V左右有两个放电平台,对应于NiS嵌锂的两个阶段[18-19],说明充放电过程包含两个反应过程,故我们推测Ni2P2S6的电极反应包含Eq(3).然而50圈后其放电比容量迅速衰减,因此需要我们进一步地研究如何提高Ni2P2S6的循环稳定性.

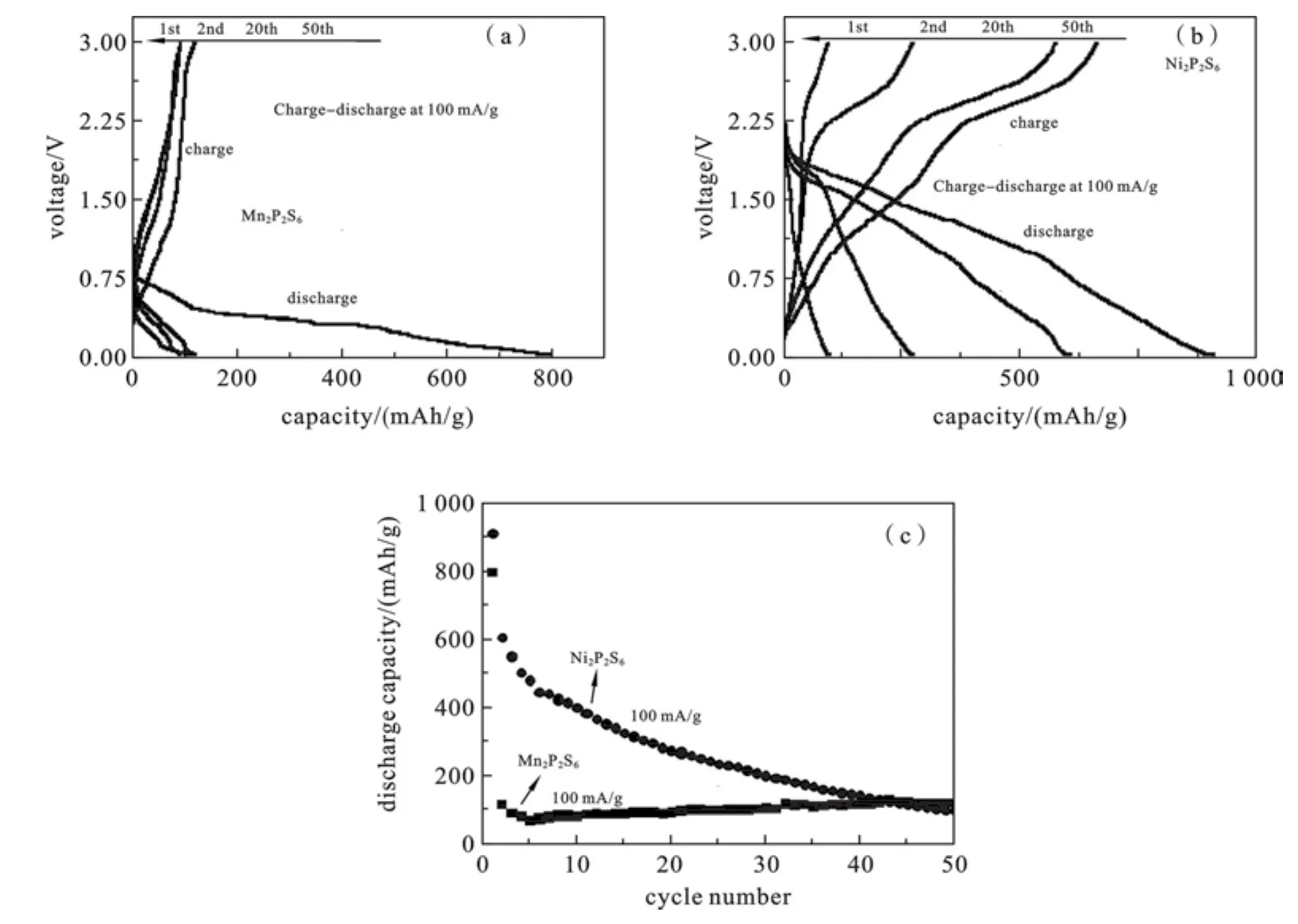
图5 M2P2S6(M=Mn,Ni)的充放电曲线图(a,b)和循环性能图(c)
3 结论
实验采用室温固相法成功合成了过渡金属硫代连二磷酸盐M2P2S6(M=Mn,Ni).Mn2P2S6由粒径为40~50 nm的纳米球堆积而成,Ni2P2S6由不同大小粒子组成块状结构.电化学测试表明,样品有很高的首次放电比容量高达800mAh/g和911mAh/g.然而,循环50圈之后比容量出现了明显的衰减.充电/放电结果还表明M2P2S6(M=Mn,Ni)可以有更高的比容量.因此在提高循环稳定性之后M2P2S6化合物可能是一个潜在的锂离子电池负极材料.
[1]杨楚罗,秦金贵,刘道玉.夹层化合物研究进展[J].化学通报,1996(3):4-9.
[2]Brec R.Review on structural and chemical propertiesof transitionmetal phosphorous trisulfidesMPS3[J].Solid State Lonics,1986,22:3-30.
[3]Leuy F.Crystalography and crystal chemistry of materials with layered structures[M].Dordrecht-Holl and:Reidel Publishing Company,1976:1.
[4]黄种乐,陈坚固,毛少瑜,等.层状结构材料Ni2P2S6的室温固相合成表征[J].高等学校化学学报,1999(4):499-502.
[5]Gamble F R,DiSalvo F J,Klemm R A,et al.Superconductivity in Layered Structure Organometallic Crystals[J].Science,1970,168:568-570.
[6]Lacroix PG,Clement R,Nakatanik,etal.Stilbazolium-MPS3Nanocomposites with Large Second-Order Optical Nonlinearity and Permanent Magnetization[J].Science,1994,5147:658-660.
[7]忻新泉,郑丽敏.室温和低热温度固一固相反应合成化学[J].大学化学,1994,9(6):1-7.
[8]Clement R,Garnier O,Jegoudez J.Coordination chemistry of the lamellar MPS3materials:Metal-ligand cleavage as the source ofan unusual"cation-transfer"intercalation process[J].Inorg Chem,1986,25:1404-1406.
[9]Xin X Q,Zheng LM.Solid state reactions of coordination compounds at low heating temperatures[J].JSolid State Chem,1993,106(2):451-460.
[10]周益明,忻新泉.低热固相合成化学[J].无机化学学报,1999(3):273-292.
[11]黄种乐,宓锦校,姚建林,等.层状结构材料Mn2P2S6的室温固相合成表征[J].高等学校化学学报,1999(2):242-246.
[12]LiCH,Wang X,Peng Q,etal.Synthesis and characterization ofMn2P2S6single-crystal nanorods and nanotubes[J]Inorg Chem,2005,44:6641-6645.
[13]Kliche G.Far infrared spectra of hexachalcogenohypodiphosphates[J].JSolid State Chem,1984,51:118-126.
[14]Michel Gasgnier,Henri Szwarc,Alain Petit.Synthesis of ditin hexathiophosphate Sn2P2S6by low-energy ball-milling and monomodemicrowave[J].Materials Research Bulletin,2003,38:1681-1694.
[15]Sourisseau C,Forgerit JP,Mathey Y.Vibrational study of the[P2S64-]anion,of someMPS3layered compounds(M=Fe,Co,Ni,In2/3),and of their intercalates with[Co(η5-C5H5)+2]cations[J].JSolid State Chem,1983,49 :134-149.
[16]Souza D C S,Pralong V,Jacobson A J,et al.A reversible solid-state crystalline transformation in ametal phosphide induced by redox chemistry[J].Science,2002,296:2012-2015.
[17]Wang Shiquan,Jiang Xueya,DUGuodong,etal,Solvothermal synthesis of Mn2P2O7and itsapplication in lithium-ion battery[J].Materials Letters,2011,65:3265-3268.
[18]Hart SC,Kim K W,Ahn H J,et al.Charge-dischargemechanism of mechanically alloyed NiS used as a cathode in rechargeable lithium batteries[J].JAlloys Compound,2003,361(1/2):247-251.
[19]张晴,郑浩.硫化镍棒的溶剂热合成及其电化学性能研究[J].湖北大学学报:自然科学版,2013,35:340-343.
