表面增强拉曼光谱法快速定量分析食品中福美双、二氰蒽醌和灭蝇胺的残留
2015-10-18李攻科胡玉玲
陈 漾, 李攻科, 胡玉玲
(中山大学化学与化学工程学院,广东广州 510257)
农药可有效防治病虫害,因此在农林生产中被广泛使用。但随着农药的大量以及不合理的使用,也造成了果蔬中农药残留超标的普遍现象,严重影响和威胁人类的健康和生命安全。因此,发展快速、准确分析食品中农药残留的检测技术已成为研究的热点。食品中农药残留分析检测方法常用的主要有气相色谱法(GC)[1 - 3]、高效液相色谱法(HPLC)[4 - 6]、色谱-质谱联用技术[7 - 17]、酶抑制法[18 - 20]、酶联免疫分析法(ELISA)[21 - 23]等。但这些方法普遍存在操作繁琐、样品前处理复杂、分析时间长、有机溶剂或化学药品消耗量大、仪器设备昂贵,不利于现场快速检测等缺点。
表面增强拉曼光谱法(Surface-enhance Raman Spectroscopy,SERS)是一种新型光谱检测技术,它具有检测灵敏度高、样品前处理简单、分析速度快、仪器体积小巧便于携带、检测成本低、可实现实时原位检测等优点,在食品分析检测方面显示出巨大的潜力。SERS技术用于实际的食品分析还处于起步阶段[24 - 26]。本文基于SERS技术,建立了饮用水、碳酸果汁饮料和水果皮中福美双、二氰蒽醌和灭蝇胺的快速定量检测的分析方法。该方法样品前处理简单、分析时间短、准确度和精密度较好,有望应用于食品中农药残留的快速分析检测。
1 实验部分
1.1 仪器与试剂
DeltaNu Inspector拉曼光谱仪(美国,DeltaNu公司);TG16-WS台式高速离心机(湘仪仪器有限公司);SQP电子天平(北京赛多利斯科学仪器有限公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);SB-5200D超声波清洗机(宁波新芝生物科技股份有限公司);GZX-9146 MBE数显鼓风干燥箱(上海博迅实业有限公司医疗设备厂);10 mL一次性使用无菌注射器(带针头)(浙江欧健医用器材有限公司)。
标准溶液的配制:分别称取0.0100 g的福美双、二氰蒽醌和灭蝇胺标准品(98%,百灵威科技有限公司),并分别以无水乙醇、丙酮和甲醇稀释,配制成1.0 g/L的标准储备溶液。系列浓度的农药标准品溶液用储备液分别以超纯水稀释配制,密封,于4 ℃避光保存。Au@SiO2纳米粒子溶液:浓度为2.94×10-4mol/L,Au纳米粒子半径约为55 nm,SiO2外壳为1~2 nm,带针孔(厦门大学)。Au纳米粒子:参考Frens法[27]制备而略有改动,将200 mL超纯水与1.00 mL 质量分数为2%的氯金酸溶液混合均匀后,在140 ℃油浴锅中加热至沸,保持沸腾约5 min后,快速一次性加入1.48 mL质量分数为1%的柠檬酸钠溶液作为还原剂,再连续加热反应40 min,冷却至室温后,密封保存于暗处,制成的金纳米粒子直径约55 nm。KAuCl4·2H2O(含金为48%~50%,阿拉丁试剂公司);柠檬酸三钠(分析纯,沈阳市试剂三厂);王水(自配);浓H2SO4与30%H2O2混合溶液(3∶1,V/V);丙酮、无水甲醇和无水乙醇均为分析纯。实验用水为超纯水。
各类碳酸果汁饮料和水果均购于当地超市。
1.2 样品处理
1.2.1加标饮用水和各类加标碳酸果汁样品的制备将各类碳酸果汁饮料经0.45 μm滤膜过滤后作为底液,用1.0 g/L标准储备液分别配制成系列浓度的加标分析样品。加标饮用水无需前处理,直接用1.0 g/L标准储备液分别配制成系列浓度的加标分析样品。
1.2.2果皮样品的制备果皮洗净晾干并用干净的剪刀剪成约6×6 mm大小,并用移液枪移取一定体积的标准溶液直接喷洒于果皮表面,自然挥干溶剂后,待测。
1.3 实验方法
1.3.1系列浓度农药标准品溶液和加标样品的SERS检测采用浓缩一定倍数的Au@SiO2增强粒子,将待测液与Au@SiO2粒子以一定的体积比置于光滑硅片表面(硅片事先浸泡在体积比为3∶1浓H2SO4与30%H2O2的混合溶液中,使其表面羟基化)混合均匀,调焦后获得谱图。激光光源波长为785 nm,激光时间为1 s;激光次数为3;每次测试扣除暗电流1 s;测试模式为Software;结果为 Average;激光功率为High;分辨率为Low。
1.3.2果皮表面农药的SERS检测将处理后的果皮样品滴加20 μL乙醇完全覆盖于果皮表面,再加入一定体积浓缩一定倍数的 Au@SiO2增强粒子,或Au纳米粒子充分混匀后调焦得到谱图。激光功率为60 mW;激光光源波长为785 nm,激光时间3 s;激光次数3;每次测试扣除暗电流1 s;测试模式为Software;结果为 Average;分辨率为Low。
2 结果与讨论
2.1 实验方法的优化与性能
采用单因素优化法,对增强粒子的浓缩倍数和待测液与增强粒子的体积比进行优化。
2.1.1福美双的分析条件及性能检测福美双的最优条件为Au@SiO2纳米增强粒子浓缩50倍,待测液与Au@SiO2体积比为4∶1。福美双以1 373 cm-1作为定量峰,其特征峰峰面积在0.03~0.20 mg/L范围内呈现良好的线性,曲线方程为:y=200595.6x+16727.9,相关系数r2=0.9982,相对标准偏差(RSD)在1.7%~6.5%(n=5)之间。选择2.0 μg/L(稍高于空白的浓度)福美双标准溶液,根据上述方法分别测定20次,以3倍标准偏差乘以测试浓度再除以峰面积的平均值进行计算,得到检出限为1.4 μg/L。
2.1.2二氰蒽醌的分析条件及性能检测二氰蒽醌的最优条件为Au@SiO2纳米增强粒子浓缩40倍,待测液与Au@SiO2体积比为3∶1。二氰蒽醌以1 476 cm-1为定量峰,其特征峰峰面积在0.2~2.0 mg/L浓度范围内线性关系佳,曲线方程为:y=478246.6x+174823.2,相关系数r2=0.9960,RSD为1.7%~4.9%(n=5),检出限达0.020 mg/L。
2.1.3灭蝇胺的分析条件及性能检测灭蝇胺的最优条件为Au纳米粒子浓缩40倍,待测液与Au纳米粒子体积比为1∶1。灭蝇胺以1 078 cm-1为定量峰,曲线方程为:y=5674.6x+30662,线性范围为0.5~20 mg/L,相关系数r2=0.9801,RSD在1.2%~12.2%之间(n=5),检出限为0.030 mg/L。
2.2 样品测定
2.2.1样品中福美双的检测生活饮用水和碳酸雪梨饮料中均没有检测到福美双,采用加标回收试验对方法进行评价。样品无需前处理,直接取1.0 mL实际样品,用1.0 g/L福美双储备液添加浓度为0.080 mg/L和0.10 mg/L的加标样品进行检测。在加标样品中,福美双的特征峰仍然清晰可辨,没有发生明显的位移,与标准溶液的SERS谱图出峰位置一致,无其他杂峰出现,说明该方法选择性和专一性好(图1曲线a、b、c)。加标回收率在105.0%~107.8%之间,平行样间定量峰峰面积RSD均小于6.2%(表1),表明该方法的准确度和精密度较好,适合于分析检测生活饮用水和碳酸雪梨饮料中福美双的残留量。

表1 生活饮用水和碳酸雪梨汁中福美双的加标回收率及相对标准偏差(n=5)
aAverage of five determinations±standard deviation.
为了拓展SERS的应用,使用10 μL 浓缩40倍的Au@SiO2增强粒子对果皮表面喷洒的目标分子进行分析检测,结果如图1(d、e)和表3所示。柑皮和柠檬皮表面福美双均以1 383 cm-1为定量峰,线性范围分别在5.6~28 ng/cm2和11~33 ng/cm2,相关系数均大于0.98,各浓度的平行样之间的RSD均小于5.0% ,说明该方法精密度较好,有望应用于果皮表面福美双残留量的定量分析。
2.2.2样品中二氰蒽醌的分析检测生活饮用水中均没有检测到二氰蒽醌,方法评价采用加标回收试验。样品无需前处理,各取1.0 mL日常饮用水,用1.0 g/L二氰蒽醌丙酮标准储备液分别配制成浓度为0.50,1.0 mg/L的加标样,结果如图2(b、c)和表2所示。样品中二氰蒽醌的特征定量峰1 476 cm-1峰形明显,没有发生位移,基质干扰小,加标回收率在80.4%~98.8%之间,各浓度5个平行样的定量峰峰面积RSD均小于8.0%,表明该方法的准确度和精密度较好,适合于分析检测日常饮用水中二氰蒽醌的残留量。
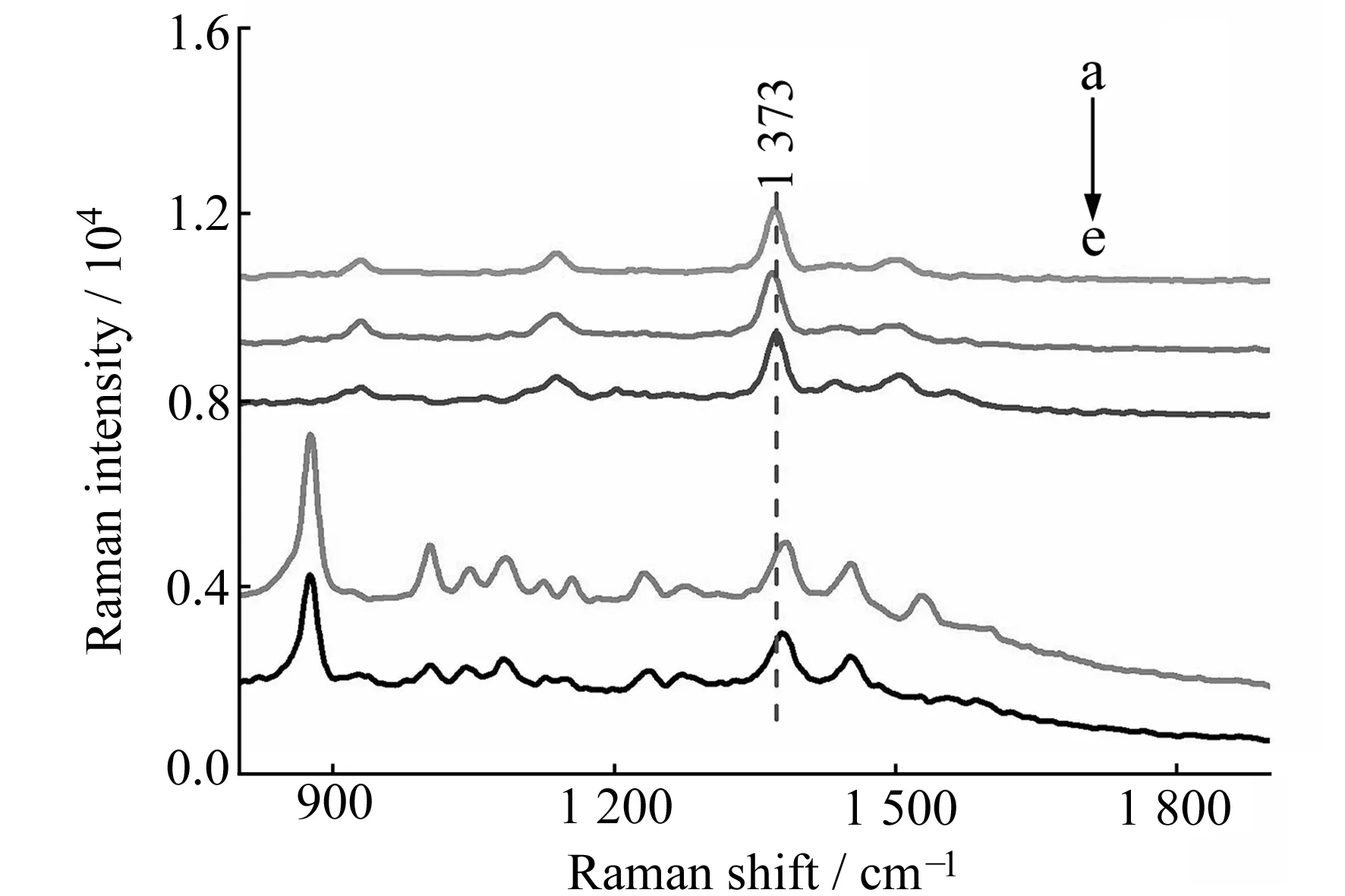
图1 加标饮用水、碳酸雪梨饮料和果皮表面福美双的SERS谱图

图2 加标饮用水、碳酸果饮和果皮表面二氰蒽醌的SERS谱图
在碳酸果汁饮料的检测中,由于基体复杂,基质效应表现为抑制效应,对二氰蒽醌的SERS检测产生很大的干扰和影响,故采用空白基质溶液配制系列标准溶液作定量校正,去除基质效应,标准加入法定量,如图2(d~i)和表3所示。结果表明,在加标的各种果汁基质中,二氰蒽醌在一定浓度范围内与峰面积有良好的线性关系,相关系数均大于0.98,RSD小于9.5%。
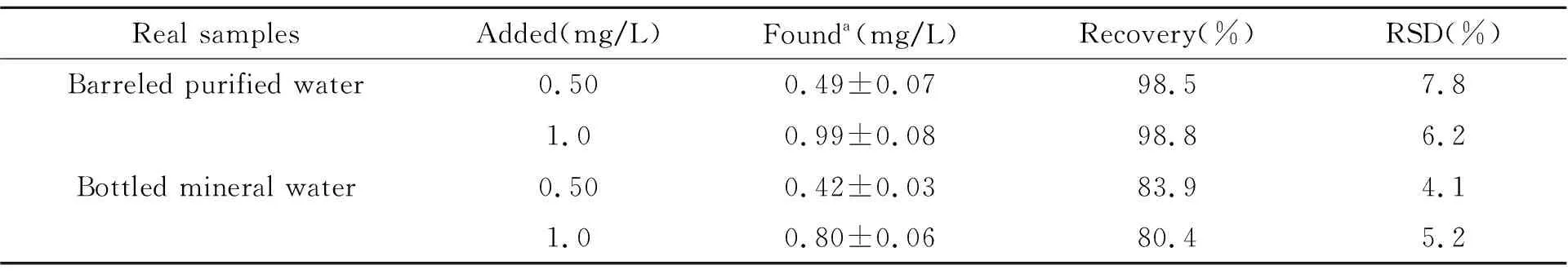
表2 生活饮用水中二氰蒽醌的加标回收率及相对标准偏差(n=5)
aAverage of five determinations±standard deviation.
此外,使用15 μL浓缩30倍的Au@SiO2增强粒子对果皮表面喷洒的目标物进行分析检测,结果如图2(j、k)和表3所示。橙皮和柠檬皮表面二氰蒽醌的定量峰峰面积均在27.8~556 pg/cm2浓度范围呈现良好的线性关系,相关系数分别达0.9917和0.9971,各浓度的平行样之间的RSD均小于9.5% ,说明该方法精密度较好,有望应用于果皮表面二氰蒽醌残留量的定量分析。

图3 各碳酸果饮中和果皮表面灭蝇胺的SERS谱图
2.2.3灭蝇胺的分析检测由于灭蝇胺在实际样品的测定中受基质干扰较大,故使用空白基质溶液将1.0 g/L灭蝇胺标准储备液稀释成标准系列浓度进行SERS检测,标准加入法定量分析,如图3(b~d)和表3所示。碳酸雪梨汁、柠檬汁和橙汁饮料中,灭蝇胺定量峰峰面积与浓度呈现良好线性,相关系数均在0.98以上,RSD小于11.0%。
使用10 μL(柑皮)或15 μL(柠檬皮)浓度40倍的Au纳米增强粒子对喷洒不同浓度灭蝇胺的果皮表面进行SERS检测,柑皮和柠檬皮分别以1 090和1 080 cm-1为定量峰,结果如图3(e、f)和表3所示。柑皮和柠檬皮表面灭蝇胺的定量峰峰面积分别在0.28~5.6 ng/cm2和0.17~2.8 ng/cm2浓度范围内呈线性关系,相关系数分别达0.9772和0.9850,各浓度的平行样之间的RSD均小于11.0%, 该方法有望应用于果皮表面灭蝇胺残留量的定量分析。

表3 加标碳酸果饮中和果皮表面福美双、二氰蒽醌和灭蝇胺的定量分析线性方程及检出限
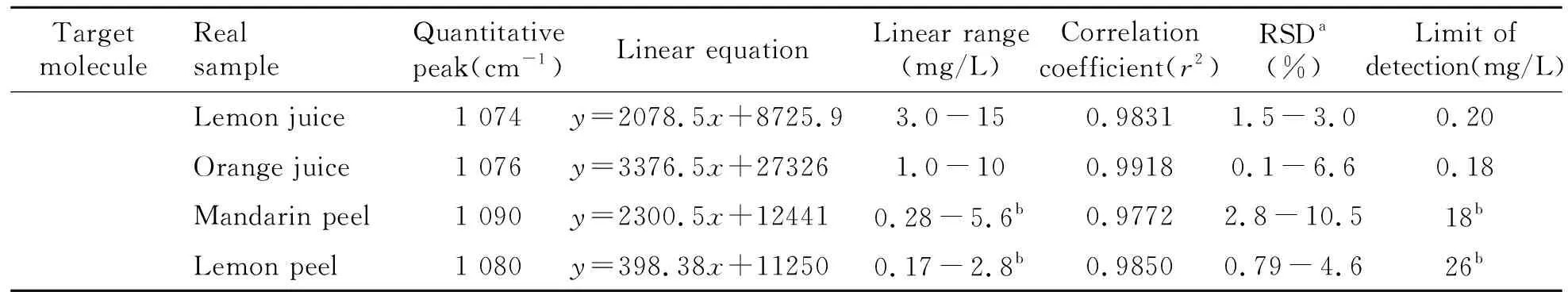
(续表3)
aThe number of the parallel samples is five for carbonated fruit juice and three for fruit peels;bThe unit of measure here is ng/cm2.cThe unit of measure here is pg/cm2.
对比福美双、二氰蒽醌和灭蝇胺在标准溶液和碳酸果汁饮料中的检测结果发现,碳酸果汁饮料中目标物的检出限均高于标准溶液中的检出限,且线性范围变窄,原因可能为碳酸饮品中存在的非目标物质分子在一定程度上占据了SERS活性位点,造成目标分子与纳米增强粒子在物理吸附上发生困难,此外,这些非目标分子很可能会产生一定的拉曼散射信号[28],并与目标分子的谱图发生相互作用,从而影响线性结果及SERS检测灵敏度。此外,相对于标准水溶液系列,饮料与果皮等实际样品中目标分子的定量峰有时会发生一定的偏移(±14 cm-1以内),说明基质中的其他物质成分可能与吸附在纳米增强粒子表面的目标分子发生作用,改变了目标分子与增强粒子的相互作用和吸附位点,导致了相关官能团的吸收谱带发生位移[29],但并不影响对目标分子的识别与鉴定。
3 结论
建立了基于表面增强拉曼光谱技术的生活饮用水、碳酸果汁饮料和果皮表面残留的福美双、二氰蒽醌和灭蝇胺3种农药的快速定量分析方法,检出限分别为1.4 μg/L、0.02 mg/L和0.03 mg/L,低于国家标准(GB 2763-2012)中规定的蔬果中3种农药的最大残留限量(其中,福美双:5 mg/kg;二氰蒽醌:2 mg/kg;灭蝇胺:0.5 mg/kg)。福美双和二氰蒽醌在实际样品中的加标回收率分别在104.5%~107.1%和81.1%~100.0%之间,RSD均小于8.0%。还成功测定了碳酸果汁饮料中和果皮表面的二氰蒽醌和灭蝇胺。显示了SERS技术应用于食品安全中的农药残留的定性和定量分析有良好的应用前景。
