脱脂羊脑蛋白酶解条件优化及酶解产物体外抗氧化活性
2015-10-18杨雪果肖士成段旭昌
常 飞,杨雪果,肖士成,段旭昌,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西杨凌华兴羊产业科技发展有限公司,陕西 杨凌 712100)
脱脂羊脑蛋白酶解条件优化及酶解产物体外抗氧化活性
常 飞1,杨雪果1,肖士成2,段旭昌1,*
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西杨凌华兴羊产业科技发展有限公司,陕西 杨凌 712100)
以脱脂羊脑蛋白为原料,采用响应面(response surface method,RSM)法建立脱脂羊脑蛋白的枯草芽孢杆菌中性蛋白酶水解回归模型,优化酶解工艺条件,在体外研究脱脂羊脑中性蛋白酶酶解产物的抗氧化性能。结果表明:脱脂羊脑蛋白底物质量浓度为3.03 g/100 mL,酶添加量为5 653.20 U/g,温度为39.4 ℃时,脱脂羊脑蛋白水解度最高,达到(14.59±1.26)%。当脱脂羊脑蛋白水解度为(14.39±1.17)%时,酶解产物对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和羟自由基(•OH)清除能力最强;当脱脂羊脑蛋白水解度为(12.48±0.71)%时 ,酶解产物对超氧阴离子自由基(O2-•)清除能力和总还原能力最强;当脱脂羊脑蛋白水解度为(12.48±0.71)%时,酶解产物对DPPH自由基、•OH、O2-•、亚硝酸根阴离子的IC50分别为2.49、3.13、10.37、10.89 mg/mL,酶解产物对Fe2+螯合率的IC50为7.48 mg/mL,证明脱脂羊脑蛋白酶解产物具有一定抗氧化活性。
羊脑蛋白;酶解产物;响应面;抗氧化活性
羊脑,为牛科动物山羊或绵羊的脑髓,富含抗坏血酸、核黄素、烟酸、硫胺素、卵磷脂、脑苷脂、蛋白质、脂肪、钙、磷、铁等营养成分及神经递质、神经生长因子、神经肽、乙酰胆碱及黏多糖等多种特殊功能成分。《本草纲目》记载,羊脑味甘,性温,微毒,归心、肝、肾经,具有补虚健脑,润肤作用,中医用于主治体虚头昏,皮肤皲裂,筋伤骨折等症。羊脑中的脑啡肽能够激活处于抑制沉睡状态的脑细胞,对因脑损伤导致的后遗症有很好的恢复作用;羊脑中的生长抑素(somatosatin)可以抑制生长激素活性;促肾上腺皮质激素(adreno-cortico-tropic-hormone)可以维持肾上腺正常形态和功能。
酶解食源性蛋白制备活性肽是目前关于食品蛋白功能性的研究热点之一,近年来研究者从食源性蛋白制备了 多种能抑制自由基产生和清除自由基的抗氧化功能肽。Memarpoor-Yazdi等[1]利用超滤、反相液相色谱等分离技术从大枣蛋白酶解液中分离出两种抗氧化肽,其分子质量分别为678.3、482.27 kD;张苗等[2]从甘薯蛋白酶解液中分离纯化出了Thr-Tyr-Gln-Thr-Phe、Ser-Gly-Gln-Tyr-Phe-Leu、Tyr-Met-Val-Ser-Ala-Ile-Trp-Gly、Tyr-Tyr-Ile-Val-Ser和Tyr-Tyr-Asp-Pro-Leu抗氧化肽,这些抗氧化肽都表现出了良好的抗氧化活性。抗氧化肽的研究一直是天然抗氧化剂研究中的热点之一。
目前,关于羊脑蛋白的研究尚少,羊脑的利用价值也没有得到深入的开发,市场所售羊脑的价格仅为10 元/kg,远远低于羊肉的价格。本研究通过响应面法优化羊脑蛋白的酶解工艺条件,并研究羊脑蛋白酶解产物的体外抗氧化活性,旨在为羊脑深加工和功能产品开发,提高羊脑加工利用效益提供理论基础。
1 材料与方法
1.1材料与试剂
羊脑由陕西杨凌华兴羊产业科技发展有限公司提供,羊品种为陕北绒山羊。
枯草芽孢杆菌中性蛋白酶、胃蛋白酶 北京索莱宝科技有限公司;胰蛋白酶 美国Amresco公司;木瓜 蛋白酶 西安沃尔森生物技术有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 梯希爱(上海)化成工业发展有限公司;菲洛嗪、阿拉丁试剂、抗坏血酸 成都市科龙化工试剂厂;石油醚、氢氧化钠、盐酸、95%乙醇、磷酸氢二钠、磷酸二氢钾、磷酸二氢钠、硫酸亚铁、水杨酸、过氧化氢、亚硝酸钠、邻苯三酚、茚三酮等均为国产分析纯。
1.2仪器与设备
LGJ-100型冷冻干燥机 北京四环仪器公司;索氏提取器 上海洪纪仪器设备有限公司;UV-2550型紫外分光光度计 日本岛津公司;JYL-CO12九阳料理机九阳股份有限公司;HH-4恒温水浴锅 北京科伟永兴仪器有限公司;HC-3018高速离心机 安徽中科中佳科学仪器有限公司。
1.3方法
1.3.1脱脂羊脑蛋白粉的制备
将取回的新鲜羊脑用自来水清洗去除表面杂质和鲜血,于-60 ℃条件下冷冻24 h,之后于9.5 Pa,-40 ℃条件下冷冻干燥48 h,冻干后的羊脑经九阳料理机粉碎30 s过100 目筛,用滤纸包裹后放入索氏提取器中用石油醚脱脂12 h,脱脂后的羊脑分散于玻璃纸上于通风橱放置24 h充分挥发残留的石油醚。然后再用九阳料理机粉碎30 s过100 目筛,用自封袋包装后于-60 ℃条件下保存备用。
1.3.2脱脂羊脑蛋白酶解工艺流程
脱脂羊脑粉→按比例加蒸馏水混匀→调节pH值→保温酶解→沸水灭酶10 min→5 400 r/min离心10 min→取上清液得到酶解液。
1.3.3脱脂羊脑蛋白水解蛋白酶的选择
称取0.5 g脱脂羊脑蛋白粉于100 mL烧杯中,加入15 mL蒸馏水搅拌均匀,用0.1 mol/L氢氧化钠或盐酸调节至各水解蛋白酶的最适pH值,按照加酶量为4 000 U/g脱脂羊脑蛋白粉的比例分别加入枯草芽孢杆菌中性蛋白酶、胰蛋白酶、胃蛋白酶和木瓜蛋白酶,分别置于各自最适水解温度下水解2 h,各蛋白酶的水解条件见表1。酶解结束后,沸水浴灭酶10 min,5 400 r/min离心10 min后,取上清液测定各酶解液的水解度,根据水解度高低选择水解效果较好的蛋白酶作为最适的脱脂羊脑蛋白水解酶。
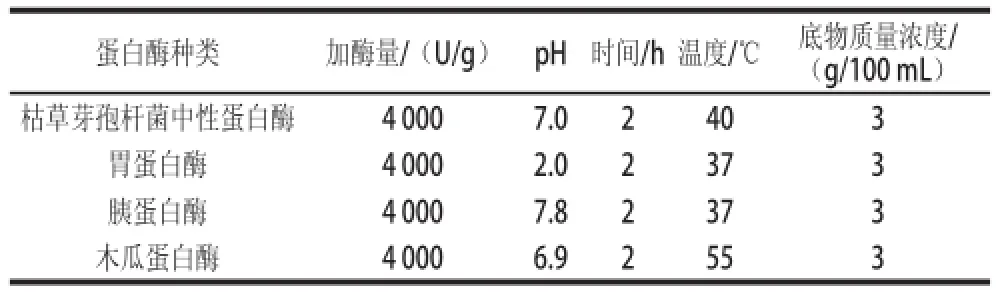
表1 不同蛋白酶水解实验条件Table1 Experimental conditions for different proteases
1.3.4枯草芽孢杆菌中性蛋白酶水解脱脂羊脑蛋白的单因素试验
1.3.4.1底物质量浓度对枯草芽孢杆菌中性蛋白酶水解羊脑蛋 白水解度的影响
以优选的枯草芽孢杆菌中性蛋白酶为水解酶,在水解时间为2 h,加酶量为4 000 U/g,酶解温度为40 ℃,pH 7.0的条件下,选取脱脂羊脑蛋白底物质量浓度分别为1、2、3、4、5 g/100 mL,研究底物质量浓度对中性蛋白酶水解羊脑蛋白水解度的影响,以水解度最大者做为最适酶解脱脂羊脑蛋白的底物质量浓度。
1.3.4.2酶解温度对枯草芽孢杆菌中性蛋白酶水解羊脑蛋白水解度的影响
以优选的枯草芽孢杆菌中性蛋白酶为水解酶,在底物质量浓度3 g/100 mL,加酶量4 000 U/g,pH 7.0条件下,分别选取酶解温度为30、35、40、45、50 ℃,水解2 h,研究酶解温度对枯草芽孢杆菌中性蛋白酶水解羊脑蛋白水解度的影响,以水解度最大者优选出最适酶解温度。
1. 3.4.3 酶添加量对枯草芽孢杆菌中性蛋白酶水解羊脑蛋白水解度的影响
以优选的枯草芽孢杆菌中性蛋白酶为水解酶,在底物质量浓度为3 g/100 mL,酶解温度为40 ℃,pH 7.0条件下,选取酶添加量分别为2 000、3 000、4 000、5 000、6 000 U/g,水解2 h,研究酶添加量对枯草芽孢杆菌中性蛋白酶水解羊脑蛋白水解度的影响,以水解度最大者优选出最适酶用量。
由于枯草芽孢杆菌中性蛋白酶酶解pH值已经由试剂公司给出,故未将pH值作为工艺优化的因素进行试验。
1.3.5响应面法优化枯草芽孢杆菌中性蛋白酶水解脱脂羊脑蛋白条件
在单因素试验基础上,运用Box-Behnken中心组合试验设计原理。 以 酶解温度、底物质量浓度、酶添加量为自变量,蛋白质水解度为响应值,进行三因素三水平的响应面试验设计,试验设计和分析采用Desigh-Expert 7.0 Trial软件。
1.3.6脱脂羊脑蛋白水解度与酶解产物抗氧化活性关系研究
在优化的条件下,取0.5 g脱脂羊脑粉,加蒸馏水混匀,调节pH 7.0,加适量枯草芽孢杆菌中性蛋白酶,分别酶解1、2、3、4、5、6、7 h,利用酶解时间控制羊脑蛋白水解度,之后离心,取上清液,对所得的酶解液进行水解度测定和抗氧化能力测定实验,以不酶解羊脑蛋白上清液做对照实验,研究羊脑不同水解度与抗氧化活性之间的关系,选择出抗氧化性最强的酶水解度。
1.3.7脱脂羊脑蛋白水解度(degree of hydrolysis,DH)的测定
采用茚三酮法测定酶解液的水解度[3-4]。
1.3.8脱脂羊脑蛋白酶解产物抗氧化活性的测定
1.3.8.1脱脂羊脑蛋白酶解产物对DPPH自 由基清除率的测定[5]
用95%乙醇将DPPH配制成0.1 mmol/L的溶液,取2 mL DPPH乙醇溶液置于不同试管中,分别加入2 mL脱脂羊脑蛋白酶解液和不同浓度的VC溶液试样,振荡混匀,于室温下暗反应30 min,在517 nm波长处测定吸光度,分别以蒸馏水代替试样和DPPH乙醇溶液做空白实验,DPPH自由基清除率按公式(1)计算,比较脱脂羊脑蛋白酶解液与VC对DPPH自由基清除效果。
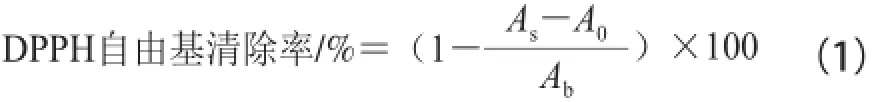
式中:As为试样与DPPH乙醇溶液反应吸光度;A0为9 5%乙醇代替DPPH乙醇溶液的对照吸光度;Ab为蒸馏水替代试样的空白吸光度。
1.3.8.2脱脂羊脑蛋白酶解产物总还原能力的测定[6]
分别取1 mL脱脂羊脑蛋白水解液或不同浓度VC溶液于试管中,分别加入2.5 mL、0.2 mol/L pH 6.6磷酸盐缓冲液和2.5 mL 1 g/100 mL的铁氰化钾溶液,充分混匀,于50 ℃水浴中反应20 min,冷却至室温,再分别加入2.5 mL 10 g/100 mL的三氯乙酸溶液,振荡后,3 000 r/min离心10 min,取上清液2.5 mL,依次分别加入2.5 mL蒸馏水和0.5 mL 0.1 g/100 mL三氯化铁溶液,充分振荡,室温静置10 min,在700 nm波长处测其吸光度,用吸光度大小表示检测试样的总还原力大小。比较脱脂羊脑蛋白水解液与VC的总还原能力。
1.3.8.3脱脂羊脑蛋白酶解产物对·OH清除率测定[7]
先在不同试管中加入1 mL 0.15 mol/L的硫酸亚铁溶液和1 mL 2 mmol/L水杨酸钠溶液,然后分别加入1 mL脱脂羊脑蛋白酶解液或不同浓度VC溶液试样,再分别 加入1 mL 6 mmol/L过氧化氢溶液启动反应,于37 ℃反应1 h后,在510 nm波长处测定吸光度。分别以蒸馏水替代试样和过氧化氢溶液做空白对照,·OH清除率按公式(2)计算,比较脱脂羊脑蛋白水解液与VC对·OH清除效果。
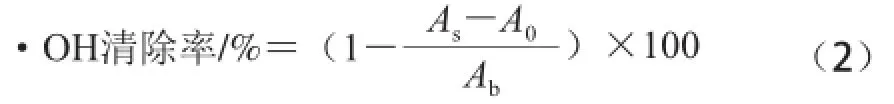
式中:As为试样的吸光度;A0为蒸馏水替代过氧化氢的对 照吸光度;Ab为蒸馏水替代试样的空白吸光度。

式中:As为试样吸光度;A0为蒸馏水替代邻苯三酚溶液的对照吸光度;Ab为蒸馏水替代试样的空白吸光度。1.3.8.5 脱脂羊脑蛋白酶解产物对亚硝酸根阴离子清除能力测定[9-10]
取1 mL酶解液或不同浓度VC溶液于不同试管中,分别加入l mL 5 μg/mL亚硝酸钠溶液,于37 ℃条件下反应30 min,再分别加入l mL 质量分数为0.4%对氨基苯磺酸,摇匀静置5 min;再分别加入0.5 mL质量分数为0.2%盐酸萘乙二胺显色剂,摇匀,静置反应15 min,于540 nm波长处测定吸光度。分别以蒸馏水替代试样和亚硝酸钠溶液做空白实验,亚硝酸根阴离子清除率按公式(4)计算,比较脱脂羊脑蛋白水解液与VC对亚硝酸根阴离子清除效果。
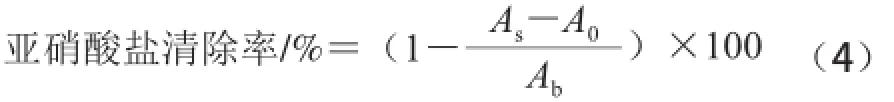
式中:As为试样吸光度;A0为蒸馏水替代亚硝酸钠溶液对照吸光度;Ab为蒸馏水替代试样空白吸光度。
1.3.8.6脱脂羊脑蛋白酶解产物对亚铁离子螯合能力测定[11]
取3 mL脱脂羊脑蛋白酶解液或不同浓度乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)溶液试样于不同试管中,分别加入0.1 mL 0.2 mmol/L氯化亚铁溶液,混合均匀,反应3 min,分别加入0.2 mL 5 mmol/L的菲洛嗪溶液启动反应,剧烈振荡于室温放置10 min,在562 nm波长处测定吸光度。分别以蒸馏水替代试样和氯化亚铁溶液做空白实验,亚铁离子螯合率按公式(5)计算,比较脱脂羊脑蛋白 水解液与EDTA-2Na对亚铁离子的螯合效果。
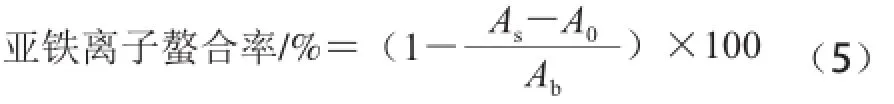
式中:As为试样吸光度;A0为蒸馏水替代氯化亚铁溶液的对照吸光度;Ab为蒸馏水替代试样空白吸光度。
以上抗氧化能力测定实验中,除了亚铁离子螯合能力测定用EDTA-2Na做阳性对照外,其余抗氧化实验以VC做阳性对照,用以考察酶解液的抗氧化活性强弱。
2 结果与分析
2.1脱脂羊脑蛋白水解酶选择
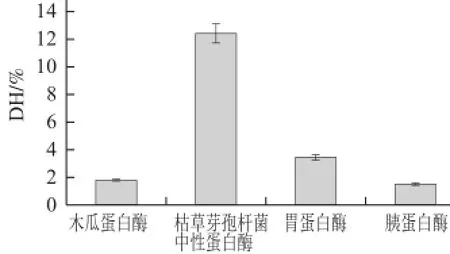
图1 蛋白 酶种类对脱脂羊脑蛋白水解度的影响Fig.1 Effect of enz yme type on the deg ree of hydrolysis (DH) of goat brain protein
由图1可知,枯草芽孢杆菌中性蛋白酶对脱脂羊脑蛋白的水解效果最好,水解度为(12.39±0.72)%,其次是胃蛋白酶、木瓜蛋白酶,胰蛋白酶水解效果最差。说明枯草芽孢杆菌中性蛋白酶对脱脂羊脑蛋白水解较为彻底,能得到大量羊脑蛋白水解的小分子肽。Chalamaiah等[12]对鱼卵蛋白水解制备抗氧化肽的研究结果表明,大分子质量蛋白经水解后所得的小分子质量多肽具有更强的抗氧化性,所以选择枯草芽孢杆菌中性蛋白酶作为脱脂羊脑蛋白水解的蛋白酶。
2.2枯草芽孢杆菌中性蛋白酶水解脱脂羊脑蛋白的单因素试验
由图2可知,脱脂羊脑蛋白水解度呈先升高后降低的趋势,当脱脂羊脑蛋白质量浓度为3 g/100 mL时,水解度达到最大。出现这一现象可能是因为在水解酶浓度一定条件下,当脱脂羊脑蛋白质量浓度小于3 g/100 mL时,随着其质量浓度的增加,蛋白酶与脱脂羊脑蛋白的接触几率增加,水解蛋白较为彻底,因而导致水解度升高;当底物质量浓度大于3 g/100 mL时,酶浓度成为影响酶解效果的主要因素,随着脱脂羊脑蛋白质量浓度继续增加时,酶浓度逐渐不足而导致蛋白水解不彻底。因此在其他水解条件一定时,脱脂羊脑蛋白质量浓度为3 g/100 mL时,水解效果最好,因此底物质量浓度选为2~4 g/100 mL。
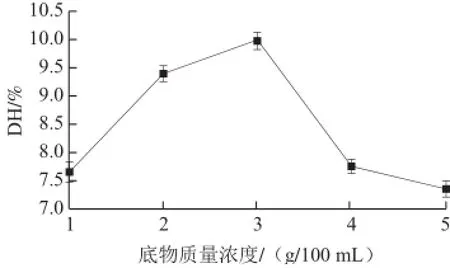
图2 底物质量浓度对脱脂羊脑蛋白水解度的影响Fig.2 Effect of substrate concentration on the degree of hydrolysis (DH)of goat brain protein
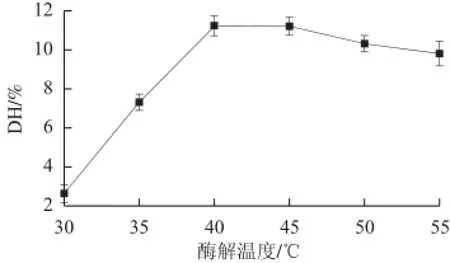
图3 酶解温度对脱脂羊脑蛋白水解度的影响Fig.3 Effect of hydrolysis temperature on the degree of hydrolysis (DH)of goat brain protein
由图3可知,在一定温度范围内,随着酶解温度的升高,脱脂羊脑蛋白水解度呈现先升高后降低的趋势,当酶解温度为40 ℃时,水解度达到最大。枯草芽孢杆菌中性蛋白酶的最适酶解温度是40 ℃,当温度偏离最适工作温度越远,酶解效果越差。因此最优水解温度选为35~45 ℃。
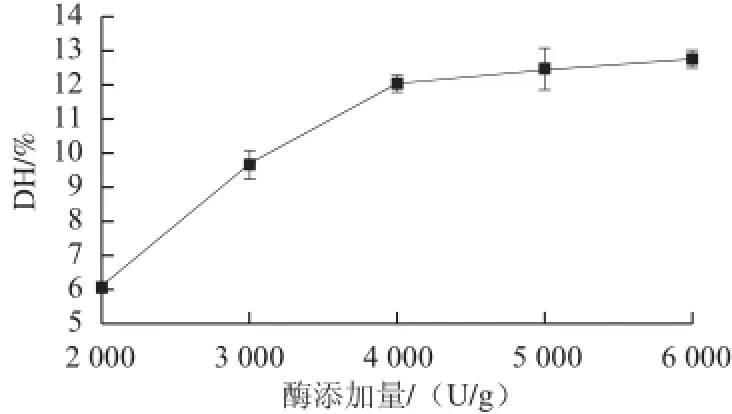
图4 酶添加量对脱脂羊脑蛋白水解度的影响Fig.4 Effect of enzyme dosage on the degree of hydrolysis (DH) of goat brain protein
由图4可知,随着酶添加量的增加,脱脂羊脑蛋白水解度也不断升高,当酶添加量达到5 000 U/g时,水解度升高不再明显,因此酶添加量选为4 000~6 000 U/g。
2.3响应面法优化脱脂羊脑蛋白枯草芽孢杆菌中性蛋白酶水解条件
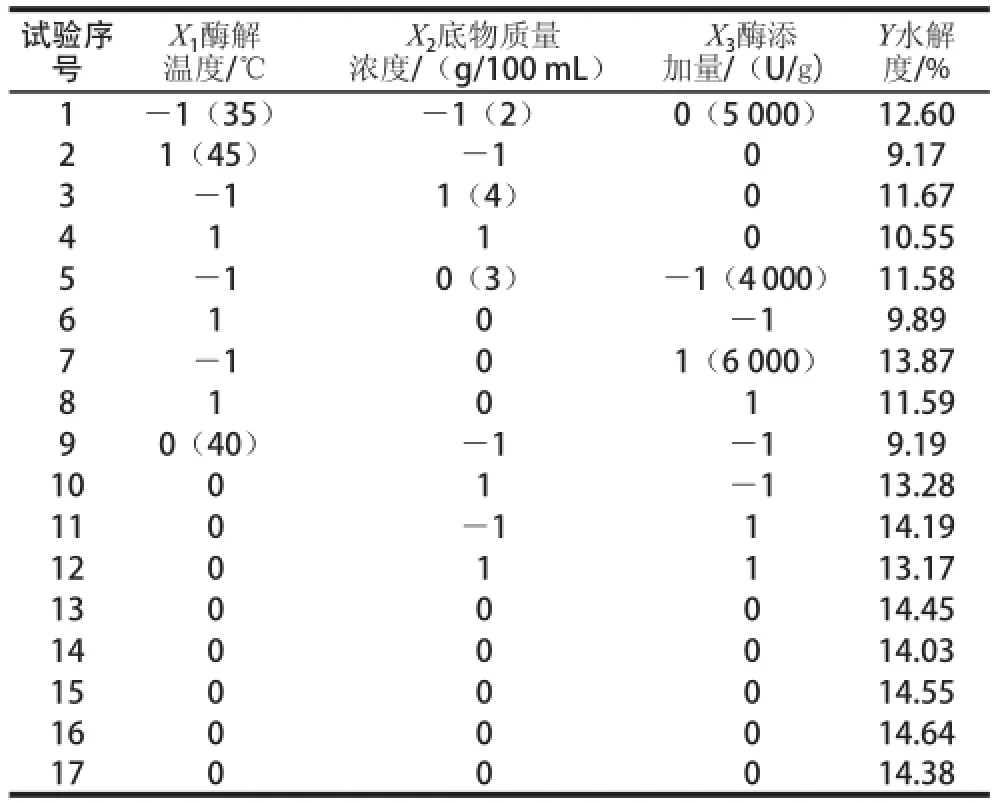
表2 Box-Behnken试验设计方案与结果Table2 Box-Behnken design and results
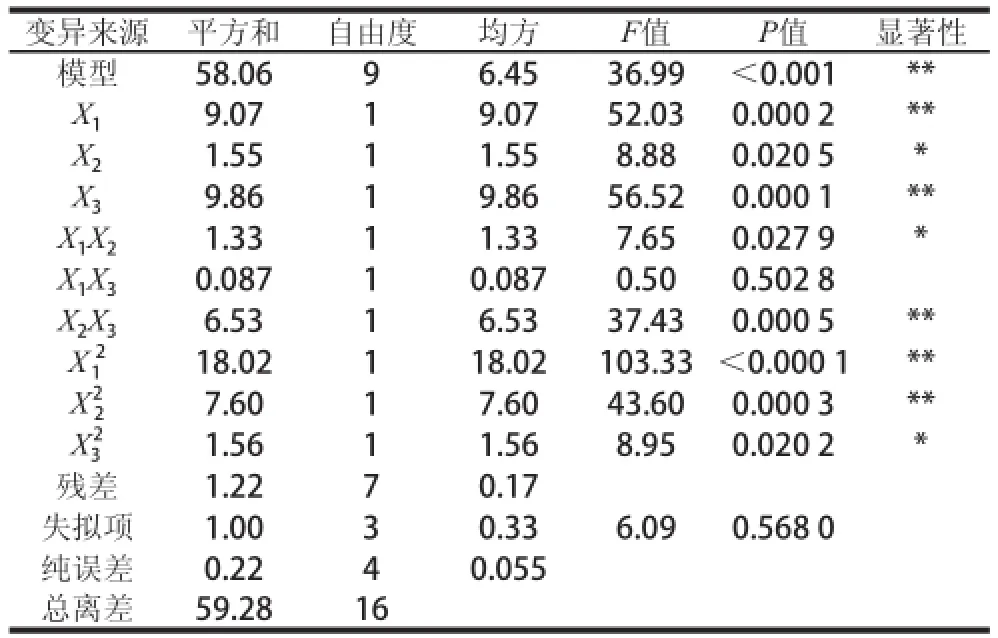
表3 响应面二次模型方差分析Table3 Analysis of variance for the fitted quadratic regression model
响应面法优化脱脂羊脑蛋白中性蛋白酶水解试验结果见表3,通过Design-Expert 7.0软件对表3数据进行统计分析,结果见表4。回归方程R2=0.979 4,说明该模型方程有很好的精密度,回归效果较好,可信度高。回归方程模型达到极显著水平(P< 0.01),失拟项不显著(P>0.05),说明该模型有较好的拟合效果。回归系数显著性检验表明,因素X1、对蛋白水解度的影响达到极显著水平;因素X2、X1X2、对蛋白水解度的影响达到显著水平。由主效应P值可知,在试验范围内各因素对脱脂羊脑蛋白酶解水解度影响程度大小依次为酶添加量X3>酶解温度X1>底物质量浓度X2。以酶解温度(X1)、底物质量浓度(X2)、酶添加量(X3)为自变量 ,脱脂羊 脑蛋白水解度Y为响应值, 经回归拟合后,得到回归方程:
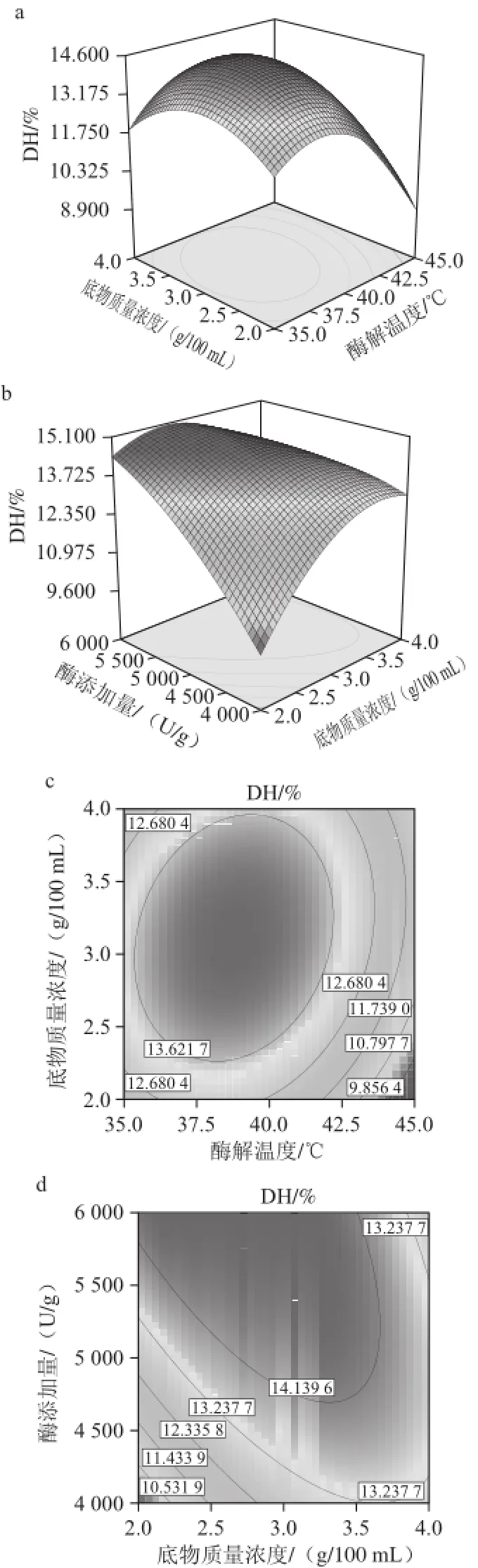
图5 酶解温度、底物质量浓度和酶添加量交互作用影响水解度的响应曲面图和等高线图Fig.5 Response surface and contour plots indicating the effects of three hydrolysis parameters on degree of hydroly sis (DH)
由图5可知,当酶添加量为4 000 U/g时,水解度随着温度的升高呈现先增大后减小的趋势,当底物质量浓度 处于低水平时,水 解度随着温度升高变化较大,而当底物质量浓度处于高水平时,水解度随着温度升高变化较小; 水解度随底物质量浓度的增大呈现先增大后减小的趋势,当酶解温度处于低水 平时,水解度随着底物质量浓度升高变化较小, 而当酶解温度处于高水平时,水解度随着底物质量浓度升高变化较大。当酶解温度为40 ℃、酶添加量处于低水平时,水解度随着底物质量浓度升高而增大,当酶添加量处于高水平时,水解度随着底物质量浓度升高先增大后减小。
通过Design-Expert 7.0软件分析确定出脱脂羊脑蛋白的枯草芽孢杆菌中性蛋白酶最佳酶水解工艺条件为:酶解温度39.4 ℃,底物质量浓度3.03 g/100 mL,酶添加量5 653.20 U/g,此时得到的水解度预测值为14.79%。根据所得的分析数据进行3 组验证实验,得到最佳水解度实际值为(14.59±1.26)%,与模型预测结果偏差不大,证明该回归模型具有良好的预测意义。
2.4脱脂羊脑蛋白水解度与酶解产物抗氧化活性关系
蛋白质经蛋白酶水解后可形成具有一定功能特性的小分子肽段,但并不是水解度越高,多肽的功能性越强,当水解过度时,多肽的功能性会降低或消失[13]。因此,本实验在酶水解优化试验基础上,通过水解时间来控制羊脑蛋白水解度,研究羊脑蛋白水解度与酶解产物的抗氧化能力之间的关系。
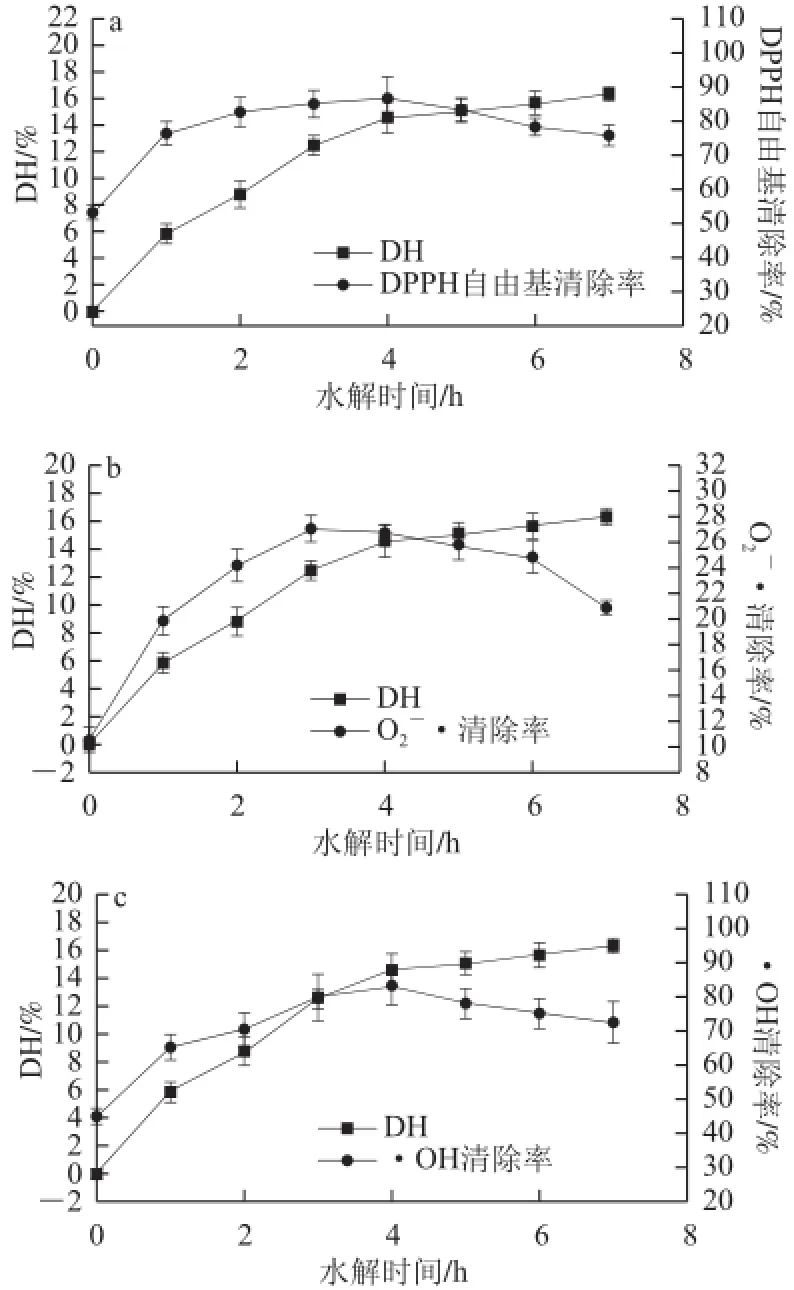
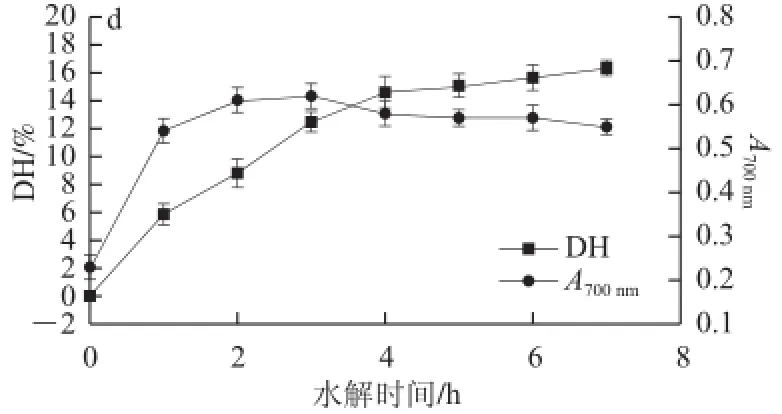
图6 酶解产物水解度与抗氧化活性的关系Fig.6 Relationship between DH and antioxidant activities of hydrolysates
由图6可知,枯草芽孢杆菌中性蛋白酶对脱脂羊脑蛋白的水解度随水解时间延长不断升高。由图6a可知,随着脱脂羊脑蛋白水解度的增大,酶解产物对DPPH自由基清除率先增加,当脱脂羊脑蛋白用中性蛋白酶水解4 h,水解度达到(14.39±1.17)%时,酶解产物对DPPH自由基清除率达到最 大值,而后酶解产物的DPPH自由基清除率随水解度升高而降低。由图6b可知,脱脂羊脑蛋白酶解产物对O2-•清除率随蛋白水解度增加先增加后降低,当脱脂羊脑蛋白水解3 h,水解度为(12.48±0.71)%时,对O2-•清除率达到最大值。由图6c可知,脱脂羊脑蛋白酶解产物对•OH清除率随蛋白水解度增加先增加后降低,当脱脂羊脑蛋白水解4 h,水解度为(14.39±1.17)%时,对•OH清除率达到最大值。由图6d可知,脱脂羊脑蛋白酶解产物的总还原力随蛋白水解度增加先增加后降低,当脱脂羊脑蛋白水解3 h,水解度为(12.48±0.71)%时,酶解产物的总还原力达到最大值。
由于酶解3 h与酶解4 h所得酶解液的抗氧化能力差别不大,在考虑到节约时间的情况下,酶解时间确定为3 h。由图6可知,酶解4 h以上,酶解液的抗氧化能力逐渐减弱,原因是原 有的功能性肽段在继续水解过程中因过度水解为分子质量更小的片段而失去了原有的活性,这与Klompong等[14]得到的过度水解会减弱多肽的抗氧化活性和其他功能特性的结论是一致的。
另外,当脱脂羊脑蛋白未经水解时,其产物的抗氧化活性明显低于酶解之后酶解液的抗氧化性,原因是酶解过程中,蛋白酶将一些大分子的羊脑蛋白水解为具有抗氧化活性的小分子多肽。由此可知,经过酶解后的脱脂羊脑蛋白酶解液比未经酶解的脱脂羊脑蛋白具有更强的抗氧化性。
2.5脱脂羊脑蛋白酶解产物的抗氧化活性
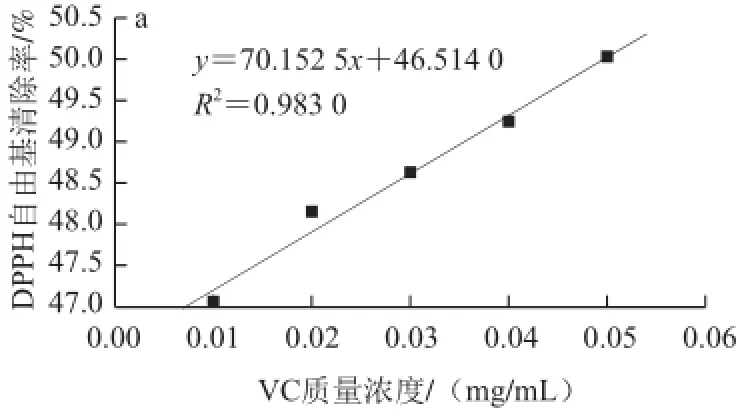
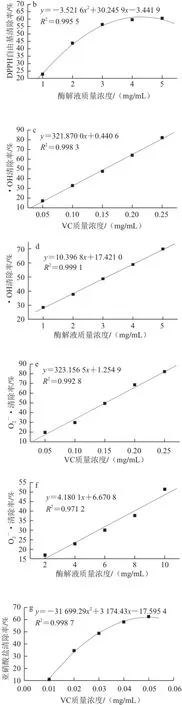
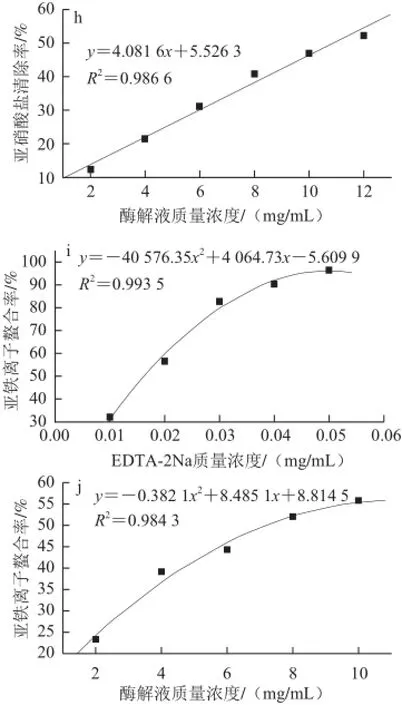
图7 不同质量浓度酶解产物与对照的抗氧化活性Fig.7 Comparisons of antioxidant activities between hydrolysates and contr ol at different concentrations
不同质量浓度酶解产物及其对照的抗氧化能力如图7所示。由图7a、7b可知,脱脂羊脑蛋白酶解产物表现出了一定的DPPH自由基清除能力,当酶解产物质量浓度小于3 mg/mL时,清除率与酶解产物质量浓度呈线性关系,酶解产物质量浓度大于3 mg/mL时,随着其质量浓度 的增大,清除率的变化率降低。通过方程计算可得,VC和酶解产物 对DPP H自由基的IC50分别为0.049 mg/mL和2.49 mg/mL,酶解产物IC50值为VC的50.82 倍,说明脱脂羊脑蛋白酶解产物对DPPH自由基的清除能力远远低于VC,但高于Klomklao等[15]制得的鲶鱼蛋白酶解产物(酶解产物质量浓度为10 mg/mL时,清除率 小于20%)、Naqash等[16]制得的金线鱼蛋白 酶解产物(酶解产物质量浓度为3 mg/mL时,清除率为48%)和Venuste等[17]制得的南瓜蛋白酶解产物(当酶解产物质量浓度为3 mg/mL时,清除率小于50%),由此说明,相 对于其他抗氧化肽而言,脱脂羊脑蛋白酶解产物有较强的DPPH自由基清除能力。
由图7c、7d可知,脱脂羊脑蛋白酶解产物对•OH的清除率随着其质量浓度的升高而增强,并且呈现出良好的线性关系,由图中的回归方程计算可知,VC和酶解产物对•OH的IC50分 别为0.15 mg/mL和3.13 mg/mL。羊脑 蛋白酶解产物对•OH的清除能力低于VC,但高于Zhuang Hong等[5]制得的玉米蛋白酶解产物(酶解产物质量浓度为5 mg/mL时,清除率为50.76%)和杨露等[18]制备的马面鱼骨胶原多肽(多肽质量浓度为10 mg/mL时,清除率小于50%),由此说明,相对于其他酶解产物而言,脱脂羊脑蛋白酶解产物具有较强的清除•OH的能力。
由图7g、7h可知,脱脂羊脑蛋白酶解产物具有清除亚硝酸盐的能力,对亚硝酸盐的清除率随着其质量浓度的升高而增强,并且呈现出较好的线性关系,由回归方程计算可 知,VC和酶解产物对亚硝酸盐的IC50分别为0.03 mg/mL 和10.89 mg/mL。虽 然脱脂羊脑蛋白酶解产物具有一定清除亚硝酸盐的能力,但远远低于VC。
由图7i、7j可知,脱脂羊脑蛋白酶解产物有一定螯合亚铁离子的能力,对亚铁离子的螯合率随其质量浓度的升高而增强,由回归方程计算可知,EDTA-2Na和酶解产物对亚铁离子的IC50分别为16.35 ☒g/mL和7.48 mg/mL。脱脂羊脑蛋白酶解物对亚铁离子的清除能力不仅远远低于EDTA-2Na,且与Naqash等[16]制得的金线鱼蛋白酶解产物(酶解产物质量浓度为3 mg/mL时,清除率大于60%)、Chalamaiah等[12]制得的南亚野陵卵蛋白酶解产物(酶解产物质量浓度为2.5 mg/mL时,清除率为56.80%)、Memarpoor-Yazdi等[1]制得的枣蛋白酶解产物(酶解产物质量浓度为1 mg/mL时,清除率为21.60%)相比,脱脂羊脑蛋白酶解产物的亚铁离子螯合能力也较弱。
3 结 论
脱脂羊脑蛋白最适水解酶为枯草芽孢杆菌中性蛋白酶。在底物质量浓度为3.03 g/100 mL,酶添加量为5 653. 20 U/g底物,水解温度为39.4 ℃,pH 7.0时,脱脂羊脑蛋白的水解度最高,可达(14.59±1.26)%。
当脱脂羊脑蛋白水解度为(14.39±1.17)%时,酶解产物对DPPH自由基和•OH清除能力最强;当脱脂羊脑蛋白水解度为(12.48±0.71)%时 ,酶解产物对清除能力最强且总还原能力最强;当脱脂羊脑蛋白水解度为(12.48±0.71)%时,酶解产物对DPPH自由基、•OH、、亚硝酸根阴离子的半数抑制率IC50分别为2.49、3.13、10.37、10.89 mg/mL,对Fe2+螯合率的IC50为7.48 mg/mL。
脱脂羊脑蛋白酶解产物的抗氧化能力远低于VC或EDTA-2Na,与其他酶解制备抗氧化肽相比,脱脂羊脑蛋白酶解产物具有较强清除DPPH自由基、•OH和O2-•能力,但螯合亚铁离子能力上低于其他酶解制备的抗氧化肽。
[1] MEMARPOOR-YAZDI M, MAHAKIA H, ZARE-ZARDINIB H. Antioxidant activity of protein hydrolysates and purified peptides from Zizyphus jujuba fruits[J]. Journal of Functional Foods, 2013, 5(1): 62-70.
[2] 张苗. 甘薯蛋白酶解肽的抗氧化及结肠癌活性研究[D]. 北京: 中国农业科学院, 2012.
[3] 包怡红, 于阳阳, 赵若诗. 酶解山核桃蛋白制备降血压肽的工艺[J].食品科学, 2013, 34(1): 220-224.
[4] 蒋婧. 蛋白质水解度测定及其标准曲线绘制研究[J]. 广东轻工职业技术学院学报, 2012, 11(1): 4-6.
[5] ZHUANG Hong, TANG Ning, YUAN Yuan. Purification and identification of antioxidant peptides from corn gluten meal[J]. Journal of Functional Foods, 2013, 5(4): 1810-1821.
[6] 张泽生, 贺伟, 刘甜甜, 等. 白藜芦醇的体外抗氧化活性[J]. 食品科学, 2012, 33(11): 266-268.
[7] 侯学敏, 李林霞, 张直峰, 等. 响应面法优化薄荷叶总黄酮提取工艺及抗氧化活性[J]. 食品科学, 2013, 34(6): 124-128.
[8] 朴美子, 王懋存, 王晓东. 中华真地鳖酶解短肽的抗氧化作用[J]. 食品科学, 2013, 34(5): 242-245.
[9] 郭刚军, 彭春秀, 何享, 等. 云南晒青毛茶提取物抗氧化活性研究[J].中国食品学报, 2013, 13(8): 42-48.
[10] 付晓燕, 李海龙, 杨超, 等. 发芽燕麦不同溶剂提取液抗氧化活性的比较[J]. 食品与发酵工业, 2011, 37(4): 68-72.
[11] WANG Mingchun, ZHU Peilei, JIANG Changxing, et al. Preliminary characterization, antioxidant activity in vitro and hepatoprotective effect on acute alcohol-induced liver injury in mice of polysaccharides from the peduncles of Hovenia dulcis[J]. Food and Chemical Toxicology, 2012, 50(9): 2964-2970.
[12] CHALAMAIAH M, JYOTHIRMAYI T, BHASKARACHARY K, et al. Chemical composition, molecular mass distribution and antioxidant capacity of rohu roe (egg) protein hydrolysates prepared by gastrointestinal proteases[J]. Food Research International, 2013, 52(1): 221-229.
[13] INTARASIRISAWAT R, BENJAKUL S, VISESSANGUAN W, et al. Antioxidative and functional properties of protein hydrolysate from defatted skipjack roe[J]. Food Chemistry, 2012, 135(4): 3039-3048.
[14] KLOMPONG V, BENJAKUL S, KANTACHOTE D, et al. Antioxidative activity and functional properties of protein hydrolysate of yellow stripe trevally as influenced by the degree of hydrolysis and enzyme type[J]. Food Chemistry, 2007, 102(4): 1317-1327.
[15] KLOMKLAO S, BENJAKUL S, KISHIMURA H. Functional properties and antioxidative activity of protein hydrolysates from toothed ponyfish muscle treated with viscera extract from hybrid catfish[J]. International Journal of Food Science & Technology, 2013,48(7): 1483-1489.
[16] NAQASH S Y, NAZEER R A. Antioxidant and functional properties of protein hydrolysates from pink perch (Nemipterus japonicus) muscle[J]. Journal of Food Science and Technology, 2013, 50(5): 972-978.
[17] VENUSTE M, ZHANG X, SHOEMAKER C F, et al. Influence of enzymatic hydrolysis and enzyme type on the nutritional and antioxidant properties of pumpkin meal hydrolysates[J]. Food & Function, 2013, 4(5): 811-820.
[18] 杨露, 丁利君, 蓝德安. 马面鱼骨胶原多肽的理化特性及其抗氧化活性[J]. 食品科学, 2013, 34(7): 234-239.
[19] 傅亮, 何倩, 陈勇, 等. 绿豆多肽的制备工艺及抗氧化作用[J]. 食品与机械, 2010, 26(6): 79-82.
Optimization of Enzymatic Hydrolysis of Goat Brain Protein and Antioxidant Activity of the Resultant Hydrolysates
CHANG Fei1, YANG Xueguo1, XIAO Shicheng2, DUAN Xuchang1,*
(1. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China;2. Shaanxi Huaxing Goat Industry Science and Technology Development Co. Ltd., Yangling 712100, China)
The enzymatic hydrolysis parameters of defatted goat brain protein with Bacillus subtilis neutral protease were optimized by response surface methodology. The optimized parameters were determined as fol lows: substrate concentration,3.03 g/100 mL; enzyme/substrate ratio, 5 653. 20 U/g; and hydrolysis temperature, 39.4 ℃. The maximum degree of protein hydrolysis was (14.59±1.26) % with the optimized parameters. The antioxidant activity of the resultant hydrolysates was investigated in vitro. The antioxidant activity presented its maximum value when the hydrolysis degree was (12.48±0.71)%. The IC50of the protein hydrolysates for scavenging 1,1-diphenyl-2-picrylhydrazyl (DPPH), hydroxyl, superoxide anion, and nitrite radicals were 2.49, 3.13, 10.37 and 10.89 mg/mL, respectively, and the IC50for chelating Fe2+ions was 7.48 mg/mL. These results suggest that the protein hydrolysates possess excellent antioxidant activity.
goat brain protein; enzymatic hydrolysate; response surface methodology; antioxidant activity
TS209
A
1002-6630(2015)03-0114-08
10.7506/spkx1002-6630-201503022
2014-04-23
“十二五”国家科技支撑计划项目(2011BAD28B05-3)
常飞( 1987—),男,硕士研究生,主要从事食品加工新技术研究。E-mail:changfeibest@126.com
段旭昌(1965—),男,副教授,博士,主要从事天然产物及食品加工新技术研究。E-mail:duanxc1965@tom.com
