LED光源对芽期苦荞黄酮合成的影响
2015-10-18雒晓鹏卜星星赵海霞李成磊王安虎
雒晓鹏,卜星星,赵海霞,李成磊,陈 惠,王安虎,吴 琦,*
(1.四川农业大学生命科学学院,四川 雅安 625014;2.西昌学院农业科学学院,四川 西昌 615000)
LED光源对芽期苦荞黄酮合成的影响
雒晓鹏1,卜星星1,赵海霞1,李成磊1,陈 惠1,王安虎2,吴 琦1,*
(1.四川农业大学生命科学学院,四川 雅安 625014;2.西昌学院农业科学学院,四川 西昌 615000)
以暗黑萌发6 d的苦荞芽为材料,分别采用LED红光(630 nm)、LED白光(540 nm)、LED蓝光(460 nm)、LED紫外光(385 nm)和普通荧光(混合波长),以光周期为16 h/8 h(昼/夜)27 ℃处理芽期苦荞3 d。采用半定量反转录-聚合酶链式反应(semi-quantitative reverse transcription and polymerase chain reaction ,RT-PCR)分析苦荞子叶和胚轴中FtPAL、Ft4CL、FtCHS、FtFLS、FtF3H和FtANS 6 个黄酮合成途径酶基因的表达量,采用AlCl3法测定不同光源处理前后的总黄酮含量,并进行相关性分析。结果表明:光源影响总黄酮在子叶中的含量大小顺序为:黑暗<荧光<白光<红光<蓝光<紫外光,光源影响总黄酮在胚轴中的含量大小顺序为:黑暗<荧光<红光<白光<蓝光<紫外光;子叶中总黄酮含量与FtPAL、FtCHS、FtF3H和FtANS的表达显著相关(相关系数>0.75),其中与FtPAL相关性最高(相关系数为0.921);胚轴中总黄酮含量仅与Ft4CL表达显著相关(相关系数为0.975)。因此,光质能够调节芽期苦荞黄酮的积累,可选用UV-B、LED蓝光和红光这3 种组合光通过优化光控条件增加黄酮含量。
LED光源;苦荞;芽期;黄酮;基因表达
苦荞(Fagopyrum tataricum)属蓼科荞麦属双子叶,是一年生草本植物,在我国主要分布在西南山区、云贵高原等地。作为一种药食两用的草本植物,与其他谷类作物相比,苦荞有着更为均衡的营养成分,且富含以芦丁为代表的黄酮类物质,具有降血脂、降血糖和抗氧化等多种保健作用[1-2]。作为一种新型蔬菜,苦荞芽菜黄酮含量较之籽粒高出数倍,芦丁更易吸收,胰蛋白酶活性消失,游离氨基酸、矿物质和粗纤维含量均衡,且易于咀嚼,风味独特[3-6],深受素食主义者的追捧。
LED(light-emitting diodes),即发光二极管,是一种可以有效地把电能转变成电磁辐射的装置[7]。随着光电技术的发展和成本的降低,LED光源逐渐成为作物栽培的首要光源。有报道认为蓝光直接或间接影响植物胚轴的伸长、酶的调节和合成、气孔的张开、叶绿体的成熟和光形态建成[8-9]。21世纪将是生态农业的世纪,光学在其中起着至关重要的作用。
目前,已有研究表明可以通过调节不同光质的光来影响植物芽菜的品质,改变其代谢产物累积量[10]。因此,采用不同单色LED光质提高苦荞黄酮累积有望成为有效的方法。本实验以富含黄酮类化合物的苦荞作为材料,采用不同单色LED光质处理芽期苦荞,进而分析其黄酮合成相关基因表达量与黄酮累积的关系,为提高苦荞芽菜品质的培育提供理论依据。
1 材料与方法
1.1材料与试剂
供试苦荞品种“西荞2号”购于西昌学院。
RNA提取试剂植物RNAout试剂盒 天泽基因公司;RevertAidTMFirst Strand cDNA Synthesis Kit 美国Fermentas公司;其他试剂均为国产分析纯。
1.2仪器与设备
LED单色光源购自广西南宁见隆科技园,LED灯管每盏由144 颗超亮灯珠组成,功率为10 W,红光(R 630 nm)、蓝光(B 460 nm)、紫外光(UV-B 385 nm),白光(W 540 nm)源,普通日光灯管,色温均近似为6 500 K。
1.3方法
1.3.1苦荞种子的催芽及光质的选择
苦荞种子的萌发参照Kim等[11]的方法,略有改动:将苦荞种子置于35 ℃自来水中浸种16 h,催芽后在黑暗温室内用长37 cm,宽28 cm共12 个穴盘进行育苗,育苗基质取自四川农业大学生命科学学院苦荞栽培基地,温度控制为27 ℃,每隔4~5 h喷洒一次自来水。取黑暗萌发第6天的苦荞芽菜为材料,分为5 组,每组两盘,分别置于LED红光(630 nm)、LED白光(540 nm)、LED蓝光(460 nm)、LED紫外光(385 nm)和普通荧光(混合波长)6 种LED光源下进行光照处理,实验处理光周期为16 h/8 h(昼/夜)。5 个处理组分别采用相应的灯管2 盏,置于植物顶端(25±3)cm,光强为(50±5) μmol/(m2·s)。
1.3.2苦荞子叶和胚轴cDNA第一链的制备
按照天泽基因公司“植物RNAout试剂盒”说明书,分别提取各个处理组苦荞子叶和胚轴总RNA。利用RevertAidTMFirst Strand cDNA Synthesis Kit试剂盒以Oligo-dT18和Random Hexamer Primer为引物,进行cDNA的反转录,将合成的cDNA第一链保存于-20 ℃冰箱中备用。
1.3.3苦荞子叶和胚轴黄酮合成关键酶基因的半定量反转录-聚合酶链式反应(semi-quantitative reverse transcription and polymerase chain reaction,RT-PCR)
以不同光质处理3 d后的苦荞幼苗为材料,以持家基因组蛋白编码基因FtH3为内参,利用RT-PCR技术检测FtPAL(苯丙氨酸解氨酶)、Ft4CL(4-香豆酞-CoA连接酶)、FtCHS(查尔酮合酶)、FtFLS(黄酮醇合酶)、FtF3H(黄烷酮-3-羟化酶)和FtANS(花青素合成酶)等6 个黄酮合成关键酶基因在不同光质下表达量,引物序列见表1。通过Quantity One(version 4.6.2)软件分析扩增产物,并进行高斯建模(Gauss-Model)计算光密度值,各基因表达量用相对光密度值ROD(optical density of gene/optical density of H3)表示。

表1 RT-PCR的引物序列Table1 Primer sequenceess
1.3.4苦荞子叶和胚轴总黄酮的提取与测定
采用李成磊[12]和Liu Benguo[13]等的方法并略作改动。使用AlCl3法建立芦丁标准曲线,利用紫外-可见分光光度法在420 nm波长处测定苦荞子叶和胚轴总黄酮的吸光度,根据AlCl3法建立标准曲线,回归方程为y=15.738x,相关系数R2=0.999,通过标准曲线计算总黄酮含量。
1.4数据分析
采用IBM SPSS Statistics 20统计软件对黄酮合成相关基因表达量与总黄酮量进行相关性分析。
2 结果与分析
2.1不同光质对苦荞幼苗生长的影响
苦荞幼苗在不同光质条件下处理3 d后均能正常生长。黑暗条件下,苦荞子叶未完全张开,胚轴呈苍白色;LED红光条件下,出现3 片苦荞子叶并且呈现深绿色,胚轴为晶莹的白色;LED紫外光条件下,出现2 片浅绿色子叶,胚轴整体为深粉红色;LED白光照射下,出现3 片浅绿色子叶,胚轴中下部位呈现浅粉红色;普通荧光灯处理下,只出现2 片子叶并且子叶较小未完全张开,胚轴整体呈现白色;在LED蓝光照射条件下,苦荞幼苗整体高度小于红光及白光组,子叶完全张开,出现3 片,为深绿色,胚轴整体呈现浅粉红色。可见,LED蓝光和紫外光能够有效影响苦荞芽菜的生长及感观品质。
2.2苦荞黄酮合成相关基因的表达量分析


图1 不同光质条件下芽期苦荞FFttPPAALL(AA)、FFtt44CCLL(BB)、FFttCCHHSS(CC)、FFttFFLLSS(DD)、FFttFF33HH(EE)、FFttAANNSS(F)基因相对表达量Fig.1 FtPAL (A), Ft4CL (B), FtCHS (C), FtFLS (D), FtF3H (E) and FtANS (F)expression in tatary buckwheat sprouts under different LED lights
由图1可知,与黑暗组相比,红光处理的子叶中Ft4CL表达量极显著上升为61.6%(P<0.01),胚轴中FtFLS表达量极显著上升为7.0%(P<0.01),而FtPAL极显著下降为4.0%(P<0.01);白光处理后子叶中Ft4CL表达量上升最显著,为185.0%(P<0.05),胚轴中FtPAL下降最为显著,为9.3%(P<0.05);紫外光处理下子叶中Ft4CL表达量上升最显著,为220.3%(P<0.01),胚轴中FtCHS上升最为显著,为100.2%(P<0.05);荧光处理胚轴中FtPAL下降最为显著,为6.7%(P<0.05);LED蓝光处理后子叶中Ft4CL表达量上升最为显著,为220.8%(P<0.01)。结果表明,芽期苦荞不同组织对不同波长光源的敏感性不同,各基因在子叶和胚轴中表达量具有差异性与组织特异性。
2.3苦荞芽子叶和胚轴中总黄酮含量

图2 不同光质下苦荞子叶和胚轴中总黄酮含量Fig.2 Total flavonoid contents of cotyledons and hypocotyls under different LED lights
由图 2可知,芽期苦荞中子叶的总黄酮含量均高于胚轴。黑暗对照组子叶中总黄酮含量为6.143%,胚轴中含量为0.993%。经不同光质处理3 d后,LED红光处理组,芽期苦胚轴中总黄酮含量显著提高(P<0.05),为黑暗对照组的1.82 倍;紫外光处理组,芽期苦荞子叶和胚轴中总黄酮含量,分别为黑暗对照组的2.08 倍(P<0.01)和5.86 倍(P<0.01);LED白光处理组,芽期苦荞胚轴中总黄酮含量极显著提高,为对照组的2.12 倍(P<0.01);LED蓝光处理,芽期苦荞子叶和胚轴中总黄酮含量均极显著提高(P<0.01),为黑暗对照组的1.42 倍和2.73 倍。上述结果表明,光质能够调节苦荞芽菜黄酮的积累。
2.4苦荞黄酮合成相关基因与黄酮积累的相关性
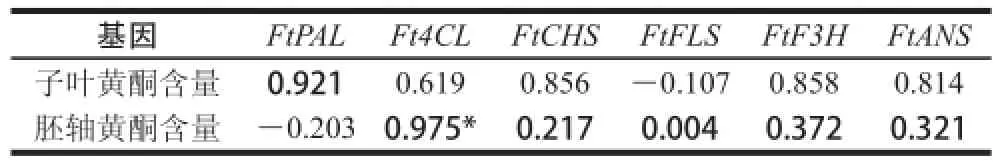
表2 苦荞子叶和胚轴中总黄酮与黄酮合成相关基因表达量的相关性Table2 Correlation coefficients between gene expression levels involved in flavonoid biosynthesis and total flavanoid contents in cotyledons and hypocotyl of tartary buckwheat
使用IBM SPSS Statistics 20统计软件分析不同光质处理3 d后芽期苦荞子叶和胚轴中FtPAL、Ft4CL、FtCHS、FtFLS、FtF3H和FtANS基因的相对表达量与总黄酮含量的相关性,结果见表2。以相关系数绝对值大于0.75为阈值时[14],在苦荞子叶中,总黄酮含量变化与FtPAL表达量(相关系数为0.921)、FtCHS表达量(相关系数为0.856)、FtF3H(相关系数为0.858)和FtANS表达量(相关系数为0.814)呈正相关。苦荞胚轴中,总黄酮含量与Ft4CL表达量(相关系数为0.975)呈正相关。结果表明,苦荞黄酮合成相关酶基因表达量与总黄酮具有一定的相关性。但子叶和胚轴中存在相关性的基因并不相同。因此,该过程中苦荞黄酮在子叶和胚轴中的生物合成可能存在着不同的调控机制[15-17]。
3 讨 论
本研究通过对萌发6 d后的苦荞采用5 种不同的光质处理3 d,发现苦荞幼苗在不同光质条件下均能正常生长,但是外观形态却表现出了较大差异。苦荞芽黄酮含量在紫外光照射条件下最高,推测紫外光照射后,黄酮含量增加使得苦荞能够有效减少紫外辐射在植物表皮层的穿透率,减轻紫外对植物器官与组织的伤害。其次为LED蓝光、红光和白光,这与陈大清[18]和鲁燕舞[19]等的研究结果相似。在芽期苦荞胚轴中,总黄酮含量与Ft4CL表达量虽然呈正相关,但与FtFLS基因表达量相关性小,提示苦荞中存在同源FLS基因,在本实验条件下该基因可能不是胚轴中合成黄酮的主效基因。由于子叶和胚轴中存在相关性的基因有区别,表明在这两个器官可能存在着不同的调控黄酮合成的机制。
国内外近年来的研究结果表明,将苦荞萌发为芽菜能有效提高苦荞中各种营养成分,尤其是黄酮的含量,增加苦荞产品的市场竞争力并创造大量的经济效益。Kim等[3]研究发现,苦荞籽粒萌发6~10 d后,幼苗中总黄酮含量远高于籽粒。Tsurunaga等[10]研究发现不同光质对苦荞芽菜的生长与黄酮类化合物如花青素和芦丁的合成具有很大的影响。本研究表明,通过采用紫外光、LED蓝光和LED红光照射的苦荞芽菜具有更鲜艳的外观和更高的黄酮含量,今后可通过进一步优化这3 种混合光来培育高品质的苦荞芽菜。
[1] WILLIAMS C A, GRAYER R J. Anthocyanins and other flavonoids[J]. Natural Product Reports, 2004, 21(4): 539-573.
[2] KITABAYASHI H, UJIHARA A, HIROSE T, et al. On the genotypic differences for rutin content in tatary buckwheat, Fagopyrum tataricum Gaertn[J]. Breeding Science, 1995, 45(2): 189-194.
[3] KIM S J, ZAIDUL I S M, SUZUKI T, et al. Comparisonof phenolic compositions between common and tartary buckwheat (Fagopyrum)sprouts[J]. Food Chemistry, 2008, 110(4): 814-820.
[4] 陈鹏, 李玉红, 刘春梅, 等. 荞麦芽菜营养成分分析评价[J]. 园艺学报, 2003, 30(6): 739-741.
[5] KIM S J, KAWAHARADA C, SUZUKI T, et al. Effect of natural light periods on rutin, free amino acid and vitamin C contents in the sprouts of common (Fagopyrum esculentum Moench) and tartary (F. tataricum Gaertn.) bu ckwheats[J]. Food Science and Technology Research,2006, 12(3): 199-205.
[6] 陈鹏, 侯智法. 苦荞种子萌发过程芦丁降解酶的代谢规律[J]. 西北农业学报, 2010(7): 48-52.
[7] SCHUBERT E F, GESSMANN T, KIM J K. Light emitting diodes[M]. Columbia: John Wiley & Sons Inc., 2005: 112-145.
[8] SENGER H. The effect of blue light on plants and microorganisms[J]. Photochemistry and Photobiology, 1982, 35(6): 911-920.
[9] LEE S W, SEO J M, LEE M K, et al. Influence of different LED lamps on the production of phenolic co mpounds in common and Tartary buckwheat sprouts[J]. Industrial Crops and Products, 2014, 54: 320-326.
[10] TSURUNAGA Y, TAKAHASHI T, KATSUBE T, et al. Effects of UV-B irradiation on the levels of anthocyanin, rutin and radical scavenging activity of buckwheat sprouts[J]. Food Chemistry, 2013,141(1): 552-556.
[11] KIM S J, MAEDA T, SARKER M, et al. Identification of anthocyanins in the sprouts of buckwheat[J]. Journal of Agricultural and Food Chemistry, 2007, 55(15): 6314-6318.
[12] 李成磊. 苦荞黄酮合成相关酶基因的克隆, 芽期逆境胁迫中的应答及重组FtPAL和FtFLS的酶 学活性研究[D]. 雅安: 四川农业大学,2012: 52-53.
[13] LIU Benguo, ZHU Yongyi. Extraction of fl avonoids from fl avonoidrich parts in tartary buckwheat and identification of the main fl avonoids[J]. Journal of Food Engineer ing, 2007, 78(2): 584-587.
[14] 赵海霞, 吴小峰, 白悦辰, 等. 苦荞芽期黄酮合成关键酶和MYB转录因子基因的表达分析[J]. 农业生物技术学报, 2012, 20(2): 121-128.
[15] CHAPPELL J, HAHLBROCK K. Transcription of plant defence genes in response to UV light or fungal elicitor[J]. Nature, 1984, 311: 76-78.
[16] 唐杏姣, 韩科厅, 戴思兰. 菊花CmDFR与CmANS基因启动子序列克隆与瞬时表达分析[J]. 生物技术通报, 2012(5): 81-88.
[17] HUANG Junli, GU Min, LAI Zhibing, et al. Functional analysis of the Arabidopsis PAL gene family in plant growth development, and response to environmental stress[J]. Plant Physiology, 2010, 153(4):1526-1538.
[18] 陈大清. 不同光质和激动素对拟南芥(Arabidopsis thaliana L.)幼苗光形态建成影响的研究[D]. 广州: 华南师范大学, 2002: 22-45.
[19] 鲁燕舞, 张晓燕, 崔瑾. 光质对萝卜芽苗菜总酚类物质含量及抗氧化能力的影响[J]. 园艺学报, 2014, 41(3): 545-552.
Effects of LED Lights on the Levels of Flavonoid during Germination of Tartary Buckwheat
LUO Xiaopeng1, BU Xingxing1, ZHAO Haixia1, LI Chenglei1, CHEN Hui1, WANG Anhu2, WU Qi1,*
(1. College of Life Sciences, Sichuan Agricultural University, Ya’an 625014, China;2. School of Agricultural Sciences, Xichang College, Xichang 615000, China)
After tartary buckwheat seeds germinated in darkness for 6 days, their sprouts we re cultivated under lightemitting diode (LED) red light, LED white light, LED blue light, LED UV-B light and fl uorescent light, respectively. They were grown under a 16 h (daytime):8 h (night) photoperiod at 27 ℃ for 3 days. The transcriptional levels of six genes involved in the fl avonoid biosynthesis pathway, FtPAL, Ft4CL, FtCHS, FtFLS, FtF3H, and FtANS, were investigated by semi-q uantitative RT-PCR. The content of total flavonoids was measured by AlCl3method. The correlation coefficients between total fl avonoids content and the expression levels of fl avonoid biosynthesis-related genes in both cotyledons and hypocotyls were analyzed. Total fl avonoids content in tartary buckwheat cotyledons with different light treatments followed the decreasing order: UV-B > blue > red > white > fl orescence > dark; as for hypocotyls, the decreasing order was UV-B >blue > white > red > fl orescence > dark. Total fl avonoids content was signifi cantly correlated with the expression levels of FtPAL, FtCHS, FtF3H and FtANS in cotyledons (correlation coeffi cients > 0.75). While FtPAL expression showed the highest correlation with total fl avonoids content in cotyledons with correlation coeffi cient of 0.921, only Ft4CL expression level was detected to have a signifi cant correlation with total fl avonoids content in hypocotyls with correlation coeffi cient of 0.975. In conclusion, fl avonoid accumulation during germination of tartary buckwheat could be increased through light regulation, and UV-B, blue and red light could be mixed for induction of more fl avonoids.
LED light; tartary buckwheat; germination; fl avonoids; gene expression
S517
A
1002-6630(2015)03-0086-04
10.7506/spkx1002-6630-201503016
2014-09-10
雒晓鹏(1991—),男,硕士研究生,研究方向为植物分子生物学。E-mail:luoxiaopenglxp@163.com
吴琦(1973—),男,教授,博士,研究方向为植物分子生物学。E-mail:wuqiwq@163.com
