光强对两种硅藻光合作用、碳酸酐酶和RubisCO活性的影响
2015-10-14曾晓鹏夏建荣
曾晓鹏 夏建荣
光强对两种硅藻光合作用、碳酸酐酶和RubisCO活性的影响
曾晓鹏 夏建荣
(广州大学环境科学与工程学院, 广州 510006)
为研究海洋浮游硅藻光合固碳能力与光强的关系, 以三角褐指藻和威氏海链藻为实验材料, 测定了不同光强培养下三角褐指藻和威氏海链藻生长、光合特性、碳酸酐酶和核酮糖-1, 5-二磷酸羧化/氧化酶活性(RubisCO)的变化, 结果显示高光强促进两种硅藻的生长, 但对威氏海链藻的影响更明显。高光强导致两种硅藻叶绿素、含量、光系统Ⅱ的最大光化学效率和实际光化学效率明显下降, 非光化学淬灭系数明显升高, 但对光化学淬灭系数并没有明显影响。在高光下威氏海链藻和三角褐指藻胞内外碳酸酐酶活性明显升高。在高光强下培养的威氏海链藻RubisCO活性明显高于低光下培养, 但三角褐指藻正好相反, 不管高光还是低光培养威氏海链藻RubisCO活性始终高于三角褐指藻。以上结果表明不同硅藻对光强变化的响应存在差异, 它们可以通过调节光合生理特征、光合固碳关键酶和CO2供应以适应光强的变化。
光强; 三角褐指藻; 威氏海链藻; 光合作用; 碳酸酐酶; 核酮糖-1, 5-二磷酸羧化酶/氧化酶
海洋浮游硅藻是海洋浮游植物的重要类群, 其每年固定的CO2超过1×1012kg, 相当于海洋初级生产力的40%[1]。海洋硅藻利用核酮糖-1, 5-二磷酸羧化酶/氧化酶(Ribulose-1,5-bisphosphate carboxylase- oxygenase, RubisCO)固定CO2, 其RubisCO的1/2(CO2)约为28—40 µmol/L[2, 3], 是目前海洋环境中CO2浓度的3—4倍[4]。尽管RubisCO对CO2的亲和力比较低, 但海洋浮游硅藻仍具有较高的光合效率, 这主要得益于细胞内部存在的CO2浓缩机制(CO2Concentrating Mechanism,CCM), 包括生物物理型和生物化学型两种机制[5], 前者主要通过HCO3–的主动转运和碳酸酐酶(Carbonic anhydrase, CA)的作用使得CO2在细胞内得以浓缩, 后者主要通过类似高等植物的C4代谢途径来实现。正是由于CCM的调控作用导致固碳位点RubisCO周围的CO2浓度增加, 从而增强光合固碳效率。硅藻CCM的运行需要能量, 特别是无机碳的转运是一个主动运输的过程, 这个过程需要ATP的参与[6]。而光是植物重要的能量来源, 已有的研究表明光能通过增加三角褐指藻PtCA1基因的转录, 促进其表达, 从而提高CCM效率[7]。在莱茵衣藻()和聚球藻(sp. PPC6803)的研究中也证实CCM活性的变化并不完全依赖于外界的无机碳浓度, 也跟光强有关[6]。
海洋浮游硅藻中的三角褐指藻()和威氏海链藻()存在类似高等植物的C4途径, 但三角褐指藻中的C4代谢途径在CO2的固定过程中并不起作用, 仅是有助于细胞内pH的稳定和耗散多余的光能[8, 9]。两者对光的响应与适应可能存在较大的差异。本文利用威氏海链藻和三角褐指藻作为实验材料, 研究了光合生理、碳酸酐酶和RubisCO活性对光强的响应, 针对C4代谢途径在硅藻中的不同作用比较其光合作用、碳酸酐酶和RubisCO活性对光响应的异同, 探讨碳酸酐酶和RubisCO在光合作用中的作用, 揭示其对环境中光变化的适应能力。
1 材料与方法
三角褐指藻(Bohlin)和威氏海链藻((Grun.) Fryxell et Hasle)分别取自中国科学院海洋研究所和厦门大学近海海洋环境科学国家重点实验室。藻种扩大培养采用f/2加富的自然海水, 光强为200 µmol photons/(m2·s), 温度(20±1)℃, 光暗周期12h︰12h, 通过滤空气, 培养至对数期用于正式实验, 分别设置高光强[200 µmol photons/(m2·s)]和低光强[50 µmol photons/(m2·s)], 其他控制条件同上。培养开始时三角褐指藻细胞起始密度约为1.25×106/mL, 威氏海链藻细胞起始密度约为5.00×104/mL。
1.1 生长曲线测定
在培养过程中, 每天定时取藻液通过血球细胞计数板在显微镜下进行计数。
根据Guillard 的单细胞藻种群生长公式[10], 计算得到藻细胞生长率(/d)。
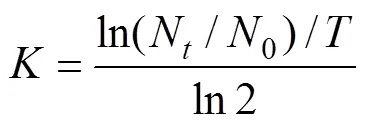
式中,0为藻细胞初始密度,N为藻种群生长达到对数末期的藻细胞密度,表示培养至对数末期时的天数。
1.2 叶绿素含量测定
用90%丙酮, 在4℃下置于黑暗中抽提12h, 然后离心取上清液, 用分光光度计分别在630 nm和664 nm处测其吸光度, 并通过以下公式计算叶绿素含量(mg/L)[11]。
Chl.=11.47×664–0.40×630
Chl.=24.36×630–3.73×664
1.3 叶绿素荧光参数的测定
叶绿素荧光参数的测定参考余锦兰等的方法[12], 用便携式调制叶绿素荧光仪(PAM-2100, Walz, Germany)进行测定。
1.4 CA活性测定
采用Wilbur-Anderson电量法测定胞内、外碳酸酐酶活性[13, 14]。碳酸酐酶活性的计算公式为:= 10×(0/–1), 其中0为反应体系中未加藻细胞时pH下降所需的时间,为反应体系中加藻细胞时pH下降(pH8.3到7.3)所需的时间。胞外和总碳酸酐酶活性分别通过测定整个细胞和细胞经超声破碎后的碳酸酐酶活性获得。碳酸酐酶活性单位(以单位细胞计)为EU/cell。胞内碳酸酐酶活性=总碳酸酐酶
活性−胞外碳酸酐酶活性。
1.5 RubisCO活性测定
RubisCO活性测定参考李合生等的方法[15]。

1.6 光合作用光响应曲线(P-I曲线)
离心收集对数期的藻细胞重新悬于新鲜的f/2加富的海水中, 用恒温水浴槽控制温度在20℃, 通过调节光源与反应槽之间的距离来调节光照强度。光合放氧速率用生物氧测定仪(5300A, YSI, US)测定, 用以下公式对P-I曲线进行非线性拟合[16]:
mtanmdkm
其中为光照强度,为光照强度时所对应的光合速率,m为光饱和最大光合速率,是光合作用在光限制部分的初始斜率, 表示光合效率,d为暗呼吸速率,k光合作用光饱和点。
1.7 数据处理
以上实验设置3个重复, 实验数据以平均值±标准偏差表示, 数据利用软件Origin8.5.1进行检验分析, 以<0.05作为显著差异水平。
2 结果
2.1 光强对三角褐指藻和威氏海链藻生长的影响
三角褐指藻不管在高光还是低光均能较快地进入对数生长期, 稳定期藻细胞密度较为接近。在整个生长过程中威氏海链藻在高光强下能更快进入对数生长期(图1)。与低光强培养相比, 在高光强下培养的三角褐指藻和威氏海链藻细胞生长速率分别提高了2.2%和24.7% (图2)。
2.2 光强对三角褐指藻和威氏海链藻叶绿素含量的影响
从图3可以看出, 在高光强下培养的三角褐指藻叶绿素含量比低光强下培养的分别降低了60.4%和53.4% (<0.05)。在高光强下培养的威氏海链藻叶绿素含量比低光下培养的分别降低了18.4%和28.0%。不管在高光还是在低光下培养, 威氏海链藻叶绿素含量均明显高于三角褐指藻(<0.05)。
2.3 光强对三角褐指藻和威氏海链藻叶绿素荧光参数的影响
如图4所示, 与高光强培养相比, 低光强下三角褐指藻和威氏海链藻F/F、Yield明显升高(<0.05), qN明显下降(<0.05), 但qP无明显变化(>0.05)。在高光强下三角褐指藻和威氏海链藻的F/F值分别下降了27.3%和29.8, 三角褐指藻和威氏海链藻低光强的Yield值分别是高光强下的1.4倍和1.7倍, 在高光强下三角褐指藻和威氏海链藻qN比低光强下分别上升了45.7%和44.8%。
2.4 光强对三角褐指藻和威氏海链藻碳酸酐酶活性的影响
如图5所示, 高光强对三角褐指藻和威氏海链藻的胞内、外CA活性均有明显的影响(<0.05)。三角褐指藻胞内、外CA活性, 在高光强下比低光强下分别上升32.1%和24.4%。威氏海链藻在高光强下的胞内、外CA活性分别是低光强下的2.4倍和1.9倍。威氏海链藻在高、低光强下胞、内外CA活性的变化比三角褐指藻更加明显。
2.5 光强对三角褐指藻和威氏海链藻RubisCO活性的影响
如图6所示, 在高光强下威氏海链藻的RubisCO活性比低光下升高51.7% (<0.05), 但三角褐指藻表现了相反的趋势, 高光强下的RubisCO活性与低光强相比下降了32.7% (<0.05)。在高、低光强培养下威氏海链藻的RubisCO活性比三角褐指藻的分别高5.8倍和2倍(<0.05)。
2.6 光强对三角褐指藻和威氏海链藻光合作用光响应曲线(P-I曲线)的影响
从图7和表1中可以看出, 在高光强培养下三角褐指藻m、d、k均明显升高(<0.05), 在高光强下培养藻的m、d、k分别是低光强下的1.7、2.5和1.4倍, 但无显著变化(>0.05)。威氏海链藻在高、低光强下m、k、均无显著差异(>0.05), 但高光强下暗呼吸速率明显高于低光强(<0.05)。在高、低光强培养下三角褐指藻m、d、值均高于威氏海链藻(<0.05),k明显减小(<0.05)。

表1 在不同光强培养下三角褐指藻和威氏海链藻P-I曲线参数
注: 光饱和光合速率(P):μmol O2/(mg Chl.·h); 光合效率():μmol O2/(mg Chl.·h)/μmol/(m2·s); 暗呼吸速率(d):μmol O2/(mg Chl.·h); 光饱和点(k): μmol/(m2·s); *表示与低光强相比存在显著差异(<0.05)
Note: *represents significant difference (<0.05) between the low light and high light
3 讨论
3.1 光强对三角褐指藻和威氏海链藻生长和光合作用的影响
光是植物生长的重要影响因子, 光照的强弱对藻细胞的生长有着明显的影响。杜晓凤等的研究表明高光有利于提高微绿球藻()细胞的密度[17]。在适宜的光强范围内, 中肋骨条藻()的生长随着光强的升高而明显增加[18]。本研究结果显示, 高光强能明显促进三角褐指藻和威氏海链藻的生长, 但对威氏海链藻的影响更明显, 表明两者对光的耐受能力具有一定差异, 威氏海链藻生长对光更敏感, 这与不同光强培养下三角褐指藻与威氏海链藻的光合作用光饱和点大小有关, 在本研究中三角褐指藻所采用的光强均高于饱和光强, 而威氏海链藻采用的低光强明显低于饱和光强(表1)。在低光强下叶绿素含量明显增加是一种常见的植物对光的响应, 这与大型海藻在不同光强下培养的结果相似[19]。植物在适应不同光强变化过程中为了获得较高的光合作用效率, 需要在低光强下加大光能的捕获, 在高光强下提高光合速率[20], 这与高光强下两种硅藻具有较高的光饱和光合速率(m)也是一致的。在高、低光强下威氏海链藻的叶绿素含量变化远小于三角褐指藻, 表明威氏海链藻叶绿素对光的敏感性较弱。
当光强增加时, 铜锈微囊藻(Kütz)和绿色微囊藻(Lemm)的v/m降低[21]。本研究结果显示, 高光下威氏海链藻和三角褐指藻的v/m变化也与之相似的, 结合本研究设置的高光强范围, 并未达到光抑制的光强(P-I曲线), 可见高光强下藻细胞的最大光化学转化效率(v/m)和实际光化学转化效率(Yield)的下降并不是光抑制引起的, 可能是由于高光强导致叶绿素含量减少和光系统II反应中心数量减少所致。qP是反映PSⅡ进行光化学反应的能力[22], 在高光下威氏海链藻和三角褐指藻qP值并没有明显变化表明高低光强下用于光化学反应的能量并没有明显差别。但在高光下三角褐指藻和威氏海链藻的qN值均升高, 表明高光能够促进藻细胞PSⅡ的天线色素将过量的光能以热能的形式耗散, 对细胞起到保护作用。在高、低光下威氏海链藻的qN值均高于三角褐指藻, 证实了生物化学型的CCM机制更有利于热能的耗散[9]。而在高光强培养下三角褐指藻与威氏海链藻光饱和光合速率(m)增强导致呼吸作用的底物增加, 同时在高光强下呼吸作用有关的酶活性增强可能是导致高光下呼吸速率明显增加的原因。
3.2 光强对三角褐指藻和威氏海链藻CA与RubisCO活性的影响
CA是CCM机制的重要组成部分, 在CO2和HCO3–相互转化的可逆反应中起催化作用, 可以调控细胞内CO2浓度, 防止CO2向外泄漏, 对调控细胞CCM机制具有重要作用。有研究表明, 光强增加导致CA活性增强[23, 24]; 高光强对铜锈微囊藻胞外CA活性也有明显的诱导作用[25], 本研究的结果与其相似。在高光强下胞外CA活性的增加有利于细胞内CO2积累; 同时胞内CA活性的增加, 有利于调控细胞内CO2浓度的变化以适应RubisCO更高效地固碳, 促进光合速率的提高。在高等植物中, 光合作用对光的响应与RubisCO对光的响应是密切相关的[26]。光能创造有利条件在叶绿体基质中激活RubisCO并驱动ATP的合成[27], 所以RubisCO活性与光强的变化密切相关。Machler和Nosberger的研究发现随光强的增加小麦叶片中RubisCO活性也随之增加[28]。但本研究结果显示三角褐指藻与威氏海链藻RubisCO活性变化对光强的响应存在相反的趋势。当生长光强低于饱和光强时, 核酮糖-1, 5-二磷酸(RuBP)的再生能力会受到限制[29]。在本研究中所使用的光强均高于三角褐指藻的饱和光强, 可见不管在高光还是低光下三角褐指藻的RuBP再生能力并没受到影响。相反对于威氏海链藻来说, 实验中设置的低光强明显低于其光饱和点, 而高光强则高于光饱和点, 在低光强下其RuBP的再生能力会受到限制。同时威氏海链藻生物物理型CCM和生物化学型CCM同时起作用, 而三角褐指藻仅是生物物理型CCM起作用[5]。不同CCM机制导致细胞内RubisCO固碳位点周围CO2浓度的差异和RuBP再生能力的限制可能是两者在不同光强下RubisCO活性存在差异的原因。总之在高、低光强下三角褐指藻和威氏海链藻CA和RubisCO活性的变化也显示了它们对光的适应与响应的差异。
[1] Granum E, Raven J A, Leegood R C. How do marine diatoms fix 10 billion tonnes of inorganic carbon per year [J]?, 2005, 83: 898—908
[2] Badger M R, Andrews T J, Whitney S M,. The diversity and co-evolution of Rubisco, plastids, pyrenoids and chloroplast-based CCMs in the algae [J]., 1998, 76: 1052—1071
[3] Whitney S P, Baldet P, Hudson G S,. Form I Rubiscos from non-green algae are expressed abundantly but not assembled in tobacco chloroplasts [J]., 2001, 26: 535—547
[4] Riebesell U, Wolfgladrow D A, Smetacek V. Carbon dioxide limitation of marine-phytoplankton growth rates [J]., 1993, 361: 249—251
[5] Reinfelder J R. Carbon concentrating mechanisms in eukaryotic marine phytoplankton [J]., 2011, 3: 291—315
[6] Giordano M, Beardall J, Raven J A. CO2concentrating mechanisms in algae: mechanisms, environmental modulation, and evolution [J]., 2005, 56: 99—131
综上所述,随着目前经济社会的变化,房地产企业投资的风险逐渐引起了投资者的注意,对投资风险的防范同时变成了重中之重,本文总结了房地产项目投资各阶段可能存在的风险因素,并提出具体防范措施方案,最大限度地预防、降低、回避、转移房地产项目投资风险。
[7] Harada H, Nakatsuma D, Ishida M,. Regulation of the expression of intracellular β-carbonic anhydrase in response to CO2and light in the marine diatom[J]., 2005, 139: 1041—1050
[8] Reinfelder J R, kraepiel A M L, Morel F M M. Unicellular C4photosynthesis in a marine diatom [J]., 2000, 407: 996—999
[9] Maya H D, Nitsan G, Daniela E,. The role C4metabolism in the marine diatom[J]., 2013, 197: 177—185
[10] Guillard R R L. Culture Methods and Growth Measurements [M]. STEIN J R. Handbook of Phycological Methods. London: Cambridge University Press. 1973, 289—312
[11] Jeffrey S W, Humphrey G F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton [J]., 1975, 167: 191—194
[12] Yu J L, Xia J R, Zou Y D. Response of carbonic anhydrase activity and photosynthesis to high salinity stress inf. minutissima [J]., 2011, 35(4): 515—523 [余锦兰, 夏建荣, 邹永东. 小新月菱形藻碳酸酐酶活性和光合作用对高盐度胁迫的响应. 水产学报, 2011, 35(4): 515—523]
[13] Willbur K M, Anderson N G. Electronic and colorimetric determination of carbonic anhydrase [J]., 1948, 176: 147—154
[14] Li X M, Xia J R. Effects of nitrogen or phosphorus limitation on photosynthetic inorganic carbon utilization and carbonic anhydrase activity in[J]., 2013, 37(3): 405—412 [李小梅, 夏建荣. 氮磷营养限制影响三角褐指藻光合无机碳利用和碳酸酐酶活性. 水生生物学报, 2013, 37(3): 405—412]
[15] Li H S, Sun Q, Zhao S J,.Principlesand Techniques of PlantPhysiology BiochemicalExperiment[M]. Higher Education Press. 2000, 138—141 [李合生, 孙群, 赵世杰, 等. 植物生理生化实验原理和技术. 高等教育出版社. 2000, 138—141]
[16] Henley W J. Measurement and interpretation of photosynthetic light-response curves in algae in the context of photoinhibition and diel changes [J]., 1993, 29: 729—739
[17] Du X F, Zou N, Sun D H,. Effect of light intensity on growth rate and accumulation of organics ofDroop [J]., 2011, 1: 18—21 [杜晓凤, 邹宁, 孙东红, 等. 光照强度对微绿球藻生长及有机质积累的影响. 生物过程, 2011, 1: 18—21]
[18] Yu P, Zhang Q Q, Wang X L,. Effects of temperature and irradiance on growth of two strains of marine diatoms [J]., 2006, 25(1): 38—40 [于萍, 张前前, 王修林, 等. 温度和光照对两株赤潮硅藻生长的影响. 海洋环境科学, 2006, 25(1): 38—40]
[19] Zou D H, Gao K S. Photosynthetic acclimation to different light levels in the brown marine macroalga,(Sargassaceae, Phaeophyta) [J]., 2010, 22: 395—404
[20] Kate M, Joanne L M, Rachel M L,. Chloroplast acclimation in leaves ofin response to high light [J]., 1999, 121: 89—95
[21] Song L R, Lei L M, He Z R,. Growth and toxin analysis in two toxic cyanobacteriaandisolated from Dianchi Lake [J]., 1999, 23(5): 402—408 [宋立荣, 雷腊梅, 何振荣, 等. 滇池水华蓝藻铜绣微囊藻和绿色微囊藻的生长生理特性和毒素分析.水生生物学报, 1999, 23(5): 402—408]
[22] Han B P, Han Z G, Fu X. Algal Photosynthesis: Mechanisms and Models [M]. Beijing: Science Press. 2003, 72 [韩博平, 韩志国, 付翔. 藻类光合作用机理与模型. 北京: 科学出版社. 2003, 72]
[23] Dionisio M L, Fukuzawa H, Miyachi S. Light-induced carbonic anhydrase expression in[J]., 1990, 94: 1103—1110
[24] Falkowski P G, Katz M E, Knoll A H,. The evolution of modern eukaryotic phytoplankton [J]., 2004, 305: 354—360
[25] Wang S S, Liu Y D, Zou Y D,. Modulation and adaptation of carbonic anhydrase activity inunder different environmental factors [J]., 2006, 26(8): 2443—2448 [王山杉, 刘永定, 邹永东, 等. 微囊藻碳酸酐酶活性在不同环境因素下的调节与适应. 生态学报, 2006, 26(8): 2443—2448]
[26] Willian J C, Willian L O. A novel role for light in the activation of ribulose bisphosphate carboxylase/oxygenase [J]., 1990, 92: 110—115
[27] Streusand V J, Portis A R Jr. Rubisco activase mediates ATP-dependent activation of ribulose bisphosphate carboxylase [J]., 1987, 85: 152—154
[28] Machler F, Nosberger J. Regulation of ribulose bisphosphate carboxylase activity in intact wheat leaves by light, CO2, and temperature [J]., 1980, 31: 1485—1491
[29] Rowan F S, Jeffrey R S. Rugulation of ribulose-1, 5-bisphosphate carboxylase/oxygenase activity in response to reduced light intensity in C4plants [J]., 1993, 102: 21—28
EFFECTS OF LIGHT INTENSITIES ON PHOTOSYNTHESIS, CARBONIC ANHYDRASE AND RUBISCO ACTIVITY IN TWO DIATOMS
Zeng Xiao-peng and Xia Jian-Rong
(School of Environmental Science and Engineering, Guangzhou University, Guangzhou 510006, China)
Marine planktonic diatoms play an important role in marine primary productivity and the carbon fixation is closely related to light intensity. In the present study, we investigated the growth rate, photosynthetic characteristics, carbonic anhydrase activity, and ribulose 1, 5-bisphosphate carboxylase/oxidase (RubisCO) activity ofandunder different light intensities (high or low light). The results showed that high light intensity promote the growth of the two diatoms, which was more obvious in. High light intensity attenuated the levels of chlorophyll,content,v/mand Yield but increased qN. High light intensity has no effect on qP. High light also enhanced the intracellular and extracellular carbonic anhydrase activities in both diatoms. Interestingly, in, low light increased ribulose-1,5-bisphosphate carboxylase/oxygenase activitycompared to high light; however, the opposite result was observed in. Rubisco activity inishigher than that inin.both low and high light. These results suggest that the two diatoms are differently responded to the light intensity and that they can accordingly adjust their photosynthetic characteristics, carbonic anhydrase and RubisCO activity to accommodate the varied light intensity.
Light intensity;;; Photosynthesis; Carbonic anhydrase; RubisCO
10.7541/2015.48
Q142
A
1000-3207(2015)02-00368-07
2014-03-26;
2014-06-11
国家自然科学基金(No:41376156); 广东省自然科学基金(S2012010009853); 广东省高层次人才项目; 广东省高等院校科技创新项目(2012KJCX0086)资助
曾晓鹏(1985—), 男, 广东揭阳人; 在读硕士研究生; 主要从事藻类生理生态学研究。E-mail: lzxp123@126.com
夏建荣(1968—), 男, 博士, 教授; 主要从事藻类生理生态学研究。E-mail: jrxia@gzhu.edu.cn
