改良小鼠肾移植模型的建立
2015-10-14黄健兵丁芳宝
黄健兵, 丁芳宝, 刘 浩, 梅 举
(上海交通大学医学院附属新华医院心胸外科, 上海 200092)
改良小鼠肾移植模型的建立
黄健兵, 丁芳宝, 刘浩, 梅举
(上海交通大学医学院附属新华医院心胸外科, 上海200092)
目的改进小鼠腹腔肾脏移植的手术方法,提高手术成功率。方法选用25对C57BL/6小鼠行同种同品系肾脏移植手术,8只C57BL/6小鼠切除肾脏作对照。简化供体肾获取方法,从供体肾背侧开始分离,并减少肾动静脉游离范围,肾动脉开口以血管片方式获取。改进动静脉吻合技术,将供体肾动、静脉分别与受体腹主动脉、下腔静脉行端侧吻合。尿道重建将供体肾输尿管末端引入膀胱内,固定输尿管壁于膀胱外膜。分两期切除受体自身肾脏。结果手术成功率为92%,总手术时间为47.6±8.7 min,热缺血时间3~5 s,冷缺血时间31.1±6.3 min。结论小鼠腹腔异位肾脏移植手术方法的改进能提高手术成功率,易于学习掌握,值得推广应用。
小鼠; 肾; 移植; 动物模型
自1973年Skoskiewicz等[1]首次开展小鼠肾脏移植手术以来,全球有多家较大的移植中心进行了此手术,最初主要用于不同基因小鼠肾脏移植后免疫排斥的研究,但由于该手术难度较大,早期手术成功率不高(仅33%~50%)[2],且使用小鼠皮肤及心脏移植已可很好地进行免疫排斥研究,小鼠肾移植在1980年代后未能广泛开展。但随着转基因技术的发展,转基因动物器官移植模型将成为从分子水平研究移植免疫的新手段。而相对于大鼠及其它大动物而言,小鼠有其不可替代的优点: 人们对小鼠基因组特征的认识比大鼠及其它任何大动物都清楚,转基因小鼠种系较纯, 已有大量的纯种小鼠及单抗可用,而有些蛋白成分如酶或趋化因子只能通过特定细菌或细胞分泌产生,产量非常少,无法批量用于大动物甚至大鼠。另外,小鼠肾脏移植与其他器官移植相比,其移植物在主要组织相容性抗原有一定差异的情况下, 仍可能长期存活, 更适于研究排斥反应长期发展过程中的免疫调控机制。因此小鼠肾移植模型再次成为研究的热点。 作者在借鉴国内外报道的手术技术的基础上,通过不断的摸索及大量的练习,改进了小鼠肾移植模型,使其更加简便易行,成功率较高。
1 材料与方法
1.1动物及分组
清洁级雌性C57BL/6 (H2b) 小鼠58 只, 体质量16~22 g, 购自上海交通大学医学院实验动物科学部[SYXK(沪) 2013-0050], 并饲养(饲喂全价营养颗粒饲料)在上海交通大学医学院附属新华医院动物实验室[SYXK(沪)2013-0106], 6~8 周龄时手术。50只小鼠随机分25对作肾脏移植,8只小鼠作对照。
1.2手术器械及试剂
手术显微镜(上海医用光学仪器厂); 血管夹(Accurate Surgical & Scientific Instruments 公司) ;显微持针器(Eriem Surgical 公司); 显微剪刀和镊子(Fine Science Tools 公司); 11/0 带针缝线和6/0 医用丝线(上海金环医用缝线厂) ; 戊巴比妥钠(Sigma公司,P3761)、异氟烷(河北九派制药股份有限公司,H19980141)和肝素钠(上海医药集团公司)。手术操作均在10~25倍显微镜下完成。
1.3手术方法
1.3.1供体手术采用腹腔注射质量分数0. 65% 戊巴比妥钠(0.01 mL/g) 麻醉。剃除腹部被毛,小鼠取仰卧位,术野消毒。取腹正中切口,自制拉钩
1.3.2受体手术与供体手术相同方法麻醉小鼠后剃毛,取仰卧位固定,尾端朝向术者。术野消毒,腹部正中切口自制拉钩牵引固定; 将小肠向左上方推移至腹腔外,并以湿润的小纱布覆盖保护;游离显露出约5 mm长的一段腹主动脉和下腔静脉,以血管夹将动静脉一并钳夹固定(图2)。纵行剪开腹主动脉和下腔静脉。首先行动脉端侧吻合,供肾置于左侧,动、静脉吻合顺序见图3; 吻合完成后,开放血管夹,可见肾脏血供恢复,呈红色。输尿管重建方法: 用显微血管镊从膀胱前下方无血管区刺入,自后上方无血管区刺出,夹住供体输尿管末端,将输尿管拉入膀胱并从下方拉出约3 mm,用显微血管夹夹住供体输尿管末端,在供体输尿管穿入膀胱的地方利用供体输尿管的脂肪等结缔组织与膀胱壁间断缝合3针固定,剪去被夹输尿管末端,使其新末端自然收缩入膀胱内, 最后荷包缝合该处膀胱开口。轻提输尿管,确认固定良好,膀胱充盈后输尿管口周围无渗漏。
游离受体左肾肾蒂组织,套8-0丝线结扎,于结扎线远心端切除受体左肾,保留少量肾组织可防止结扎线滑脱。肠管复位,全层连续缝合关闭腹部切口。移植后3 d以异氟烷 吸入麻醉后,经右肋下切口显露右肾,套8-0丝线结扎肾蒂后切除右肾。全层连续缝合关闭肋下切口。
1.3.3对照组手术与供体手术相同方法麻醉小鼠后剃毛,取仰卧位固定,术野消毒,腹部正中切口自制拉钩牵引固定,游离左肾肾蒂,套8-0丝线结扎,于结扎线远心端切除左肾。全层连续缝合关闭腹部切口。3 d后以异氟烷 吸入麻醉,经右肋下切口切除右肾。
1.4术后处理
术后将小鼠置于37 ℃暖箱内复温, 自由活动后放回笼内, 正常进食水。每日观察小鼠活动情况。
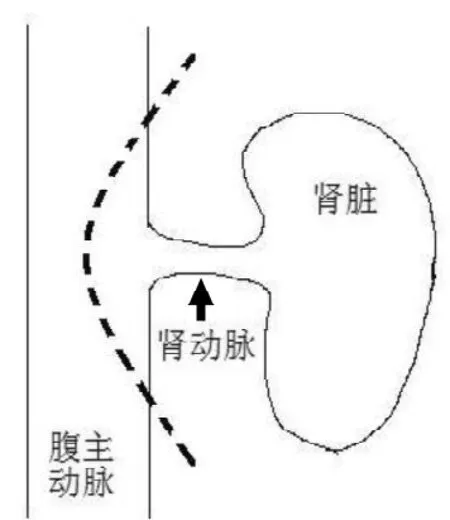
图1 取肾动脉开口血管片示意图
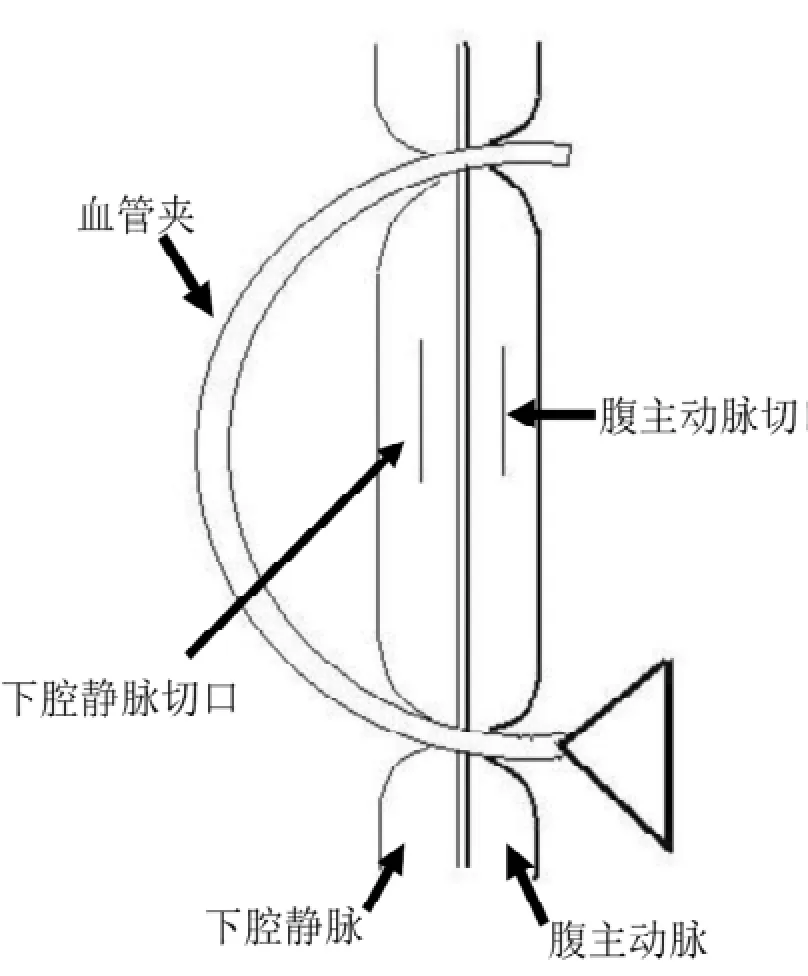
图2 血管夹示意图
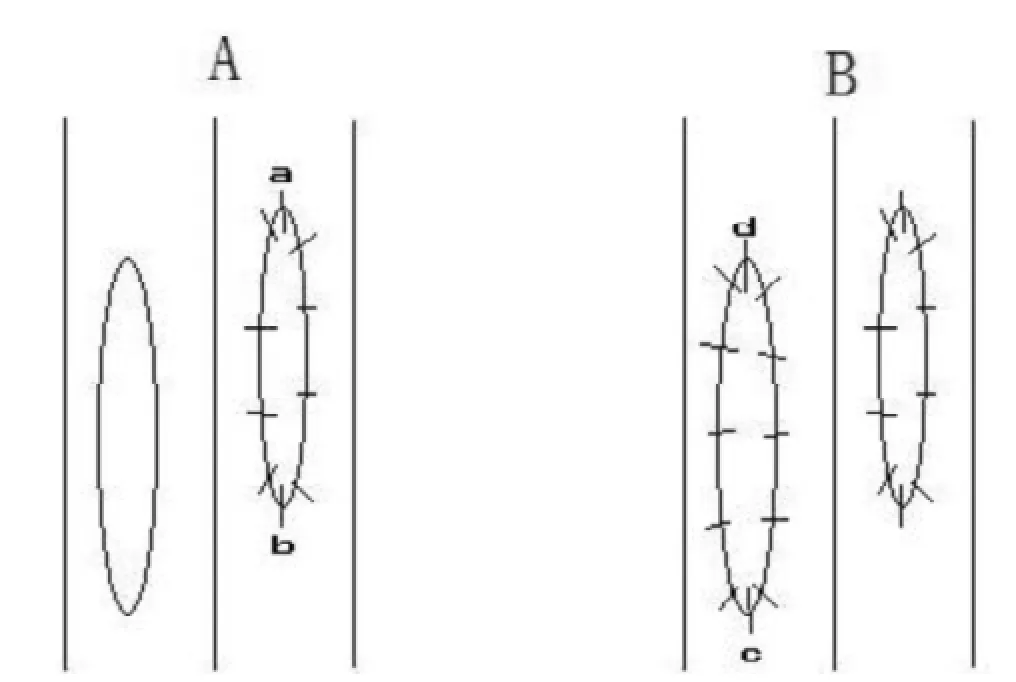
A: 动脉吻合顺序,肾脏放于左侧,先将供体动脉口血管片上端与受体动脉切口上端a点间断缝一针,再将供体血管片下端与切口下端b点缝合一针,以b点处缝线沿右侧向上连续缝合,至上端后将供体肾翻转至右侧,继续连续缝合左侧缘至下端b点处与线头打结,完成动脉吻合。B: 静脉吻合顺序,供体静脉口下端与受体静脉切口下端c点间断缝合一针固定,上端d点缝合一针后以此针为连续缝合线,先于右侧缘进针后于血管内向下连续缝合右侧缘,至下端后穿至血管外,再沿左侧缘向上连续缝合,至d点与线头打结完成静脉吻合
2 结果
供体手术时间为8.8±2.5 min , 热缺血时间约3~5 s, 冷缺血时间31.1±6.3 min, 动、静脉吻合时间24.7±5.6 min, 输尿管吻合时间4.5±1.0 min,总手术时间为47.6±8.7 min。对照组所有小鼠均在二期肾切除后3 d内死亡。考虑到移植肾在术后一周内有慢性血栓形成的可能,移植组均以二期肾切除后观察10 d为限, 能正常存活且活动良好视为手术成功,移植组的手术成功率为92%(表1)。共死亡2例, 其1例在术后即刻出现肾动脉吻合口血栓, 1例术后1周内死亡,探查提示肾动脉血栓。
3 讨论
随着转基因技术的发展,小鼠的肾脏移植模型日趋受到重视,但因其技术要求较高,尚未广泛开展。目前开展小鼠肾移植的中心远较其他移植手术少,成功率多在50%~90%[1,3-8], 总手术时间可控制在70~80 min[4], 本实验改进手术方法后, 成功率达到了92%, 总手术时间减少至47.6±8.7 min,体现了一定的优势。

表 1 肾移植组及对照组小鼠存活时间
本手术技术在参考前人经验[9]的基础上作了新的改进,并通过大量练习后获得了良好的效果。在供体手术时,先游离切断输尿管,轻提输尿管,可非常方便的分离肾后组织至肾动脉、腹主动脉,背侧分支血管显露良好,易电凝处理;肾静脉表面处理范围小,除肾上腺下静脉外,需要处理的分支血管少; 仅阻断一侧腹主动脉,且使用微血管夹代替线结扎阻断,操作方便,分离组织少,可明显节约时间,同时也可保证能阻断肾动脉血供,保证灌注良好。供体动脉开口使用血管片的方式留取,与文献报道[8,9]的留取一段腹主动脉的方法相比,腹主动脉游离范围小,处理方便,获取简单,且可保证足够大的吻合口。
受体手术时,进行了以下几个方面的改进: 使用血管夹阻断腹腔动、静脉,不需要分离结扎受体动静脉的分支, 既节省时间,又不影响术后侧支血管的血供。动脉受体切口不小于供体动脉血管片长径,供体动脉开口血管片总长径为肾动脉开口径三倍左右; 受体静脉切口长径略大于供体静脉开口直径,吻合口均使用一端定点缝针后, 从另一端起连续缝合的方法, 控制好针距,动脉两侧各3~4针,静脉两侧各4~5针,并在结尾处打结,既不增加血栓的发生率,又可极大的减少出血的可能。吻合血管的关键要看清血管内膜,进针边距合适,如未缝到内膜将导致术后血栓形成,而边距过大将引起吻合口狭窄; 缝线、打结时注意不要拉太紧,否则易导致吻合口狭窄。
小鼠肾移植时输尿管的移植,因输尿管太细而无法进行端端吻合,如果取供体时留部分输尿管开口膀胱瓣[10,11]则操作复杂,增加供体获取时间,且易引起吻合后膀胱瓣的缺血坏死。本实验将输尿管直接拉入膀胱,仅在入口处缝合固定输尿管而使其末端游离于膀胱内,操作简便,效果良好。
总之,小鼠腹部肾脏移植模型的建立需要熟练的显微外科技巧和合适的手术方法,作者对手术方法关键之处的改进能提高手术成功率,增加模型的稳定性,易于学习掌握,值得推广应用。
[1]Skoskiewicz M, chase C, Winn HJ, et a1. Kidney transplants between mice of graded immunogenetic diversity[J]. Transplant Proc, 1973, 5(1):721-725.
[2]Russell PS, Chase CM, Colvin RB, et al. Kidney transplants in mice.An analysis of the immune status of mice bearing long-term H2 incompatible transplants[J]. J Exp Med, 1978, 147(5):1449-1468.
[3]Kalina SL, Mottram PL. A microsurgical technique for renal transplantation in mice[J]. Aust N Z J Surg, 1993, 63(3):213-216.
[4]Han WR, Murray-Segal LJ, Mottram PL. Modified technique for kidney transplantation in mice[J]. Microsurgery, 1999, 19 (6):272-274.
[5]Zhang Z, Schlachta C, Duff J, et al. Improved techniques for kidney transplantation in mice[J]. Microsurgery, 1995, 16(2):103-109.
[6]Martins PN. Learning curve, surgical results and operative complications for kidney transplantation in mice[J]. Microsurgery, 2006, 26(8):590-593.
[7]Tse GH, Hughes J, Marson LP. Systematic review of mouse kidney transplantation[J]. Transpl Int, 2013, 26(12):1149-1160.
[8]易清平, 刘小孙, 王华曦, 等. 一种小鼠肾移植模型的建立[J]. 中华实验外科杂志, 2008, 25(11):1517-1519.
[9]傅宇阳, 何晓顺, 陈剑琳, 等. 小鼠肾移植模型的建立[J]. 中华显微外科杂志, 2003, 26(3):213-214.
[10] 赵大强, 汪璐芸, 华学锋, 等. 小鼠肾移植模型中膀胱-膀胱吻合尿路重建术的改进[J]. 器官移植, 2013, 4(6):362-366.
[11] 麦海星, 曲楠, 赵立, 等. 大鼠原位肾脏移植模型的建立[J].中国组织工程研究与临床康复, 2011, 15(18):3347-3350.
Improvement on Kidney Transplantation Model in Mice
HUANGJian-bing, DING Fang-bao, LIU Hao, MEI Ju
(Department of Cardiothoracic Surgery, Xinhua Hospital, Shanghai Jiao
Tong University School of Medicine, Shanghai 200092, China)
ObjectiveTo improve the technique of kidney transplantation model in mice and to increase the success rate of operation. MethodsTotally 25 pairs of C57BL/6 mice were used for kidney transplantations, and 8 C57BL/6 mice were used for control after nephrectomy. To simplify the donor kidney acquisition method, begin to separate the donor kidney from the dorsal side, reduce the separation range of the renal arteriovenous. Obtain the artery at a vascular patch. Improve the arteriovenous anastomosis technique. The donor renal artery and vein is sutured to the recipient abdominal aorta and inferior vena cava respectively by end to side anastomosis. The urethral ends of the donor were put into the recipient bladder to reconstruct the ureter, and fix the ureteral wall to the outer membrane of the bladder. The natural kidneys of the recipients were excised by two phases. ResultsThe success rate of operation was 92%, the total operation time was 47.6±8.7 min, warm ischemia time was 3~5 s, cold ischemia time was 31.1±6.3 min. ConclusionThe improvement technique of kidney transplantation model in mice can improve the success rate of operation. It is easy to learn and is worth to be widely applied.
Mice; Kidney; Transplantation; Model
Q95-33
A
1674-5817(2015)05-0374-04
10.3969/j.issn.1674-5817.2015.05.006牵引显露腹腔脏器,将肠道组织置于术野左侧显露小鼠左肾。用显微血管镊小心游离左侧输尿管及部分输尿管周围脂肪, 上至左肾下极, 下至其入膀胱处,并于膀胱入口处切断输尿管,避免损伤输尿管。剪开肾周脂肪囊,轻提输尿管,沿肾背面由下往上游离左肾背侧,直至腹主动脉,沿肾动脉水平上下游离腹主动脉各约0.5 cm,电凝切断可见分支血管。放回肾脏,游离左肾静脉开口附近腹腔静脉,范围往上下各约0.5 cm,并游离部分开口处肾静脉。电凝、剪断左肾上腺下静脉。游离完毕,用显微血管夹在肾静脉水平上约0.5 cm夹闭近心端腹主动脉,在肾动脉水平下端约0.8 cm 处用30 G 针头斜行向心穿刺腹主动脉, 缓慢灌注4 ℃肝素生理盐水(10 U/mL) 1 mL, 可见肾脏呈苍白色。沿肾静脉汇入下腔静脉处剪开肾静脉前壁、后壁,钝性推开肾静脉及其周围组织,显露下方肾动脉开口,显微血管剪刀于肾动脉开口下方起弧行向上剪下肾动脉开口周围部分腹主动脉血管壁(图1)。将肾放入4 ℃肝素生理盐水(10 U/mL)中备用。
2015-03-17
上海市科委基金(13XD1403200)
黄健兵(1979-), 男, 医学博士, 主治医师。E-mail: jb4480@163.com
