阿霉素致斑马鱼心血管毒性模型的建立
2015-10-14张城达张丽丽张立将陈云祥
张城达, 张丽丽, 张立将, 陈云祥
(浙江省医学科学院, 杭州 310012)
阿霉素致斑马鱼心血管毒性模型的建立
张城达, 张丽丽, 张立将, 陈云祥
(浙江省医学科学院, 杭州310012)
目的采用阿霉素(doxorubicin, DOX)作为阳性药物建立斑马鱼的心血管毒性模型。方法确定DOX的10%致死浓度(LC10)与最大非致死浓度(MNLC), 设置4个不同浓度的DOX溶液组(浓度: MNLC/10、MNLC/3、MNLC和LC10)、空白对照组(养鱼水处理组)和溶剂对照组(0.9%NaCl注射液)处理一定阶段的野生型AB系斑马鱼幼鱼至实验终点受精后72 h(72 hpf)。在72 hpf处收集药物处理的斑马鱼,Western blotting分析心肌肌钙蛋白T(cTnT)和肌红蛋白(Mb)的表达,在立体解剖显微镜下观察心血管系统的形态学改变,荧光定量RT-PCR检测斑马鱼组织中miRNA146a的表达。结果在浓度≤MNLC/10时, DOX不诱发斑马鱼心血管毒性; 当浓度≥MNLC/3时,可诱发斑马鱼心血管毒性,表现为血流变慢、血流缺失、静脉窦处瘀血和静脉窦处水肿,且具有剂量相关性。荧光定量RT-PCR结果显示,DOX的三个剂量MNLC/3、MNLC、LC10均显著提高miRNA146a的表达(与空白对照组比较,P<0.01),且存在一定的剂量关系。Western blotting结果显示, DOX模型组的cTnT和Mb蛋白表达与空白对照组比较均未见明显变化(P>0.05)。结论DOX对斑马鱼的心血管毒性作用明显, 可以作为药物评价的心血管毒性模型。
阿霉素(DOX); 心血管毒性; 斑马鱼; 模型
斑马鱼原产于印度东部、尼泊尔等地,是一种热带观赏鱼,因其体侧具有5条延伸至尾部的水平蓝色条纹而得名[1]。斑马鱼作为一种新型脊椎模式动物的研究, 国际上最早于1930年代首次发表,第一次详细描述了斑马鱼受精卵的变化过程[2]。而我国自20世纪末开始对其展开了大量研究,取得了快速发展。斑马鱼个体小,繁殖迅速,实验周期短, 成本低廉,既适合高通量的毒性筛选又可从整体发育水平上进行观察,兼具体外实验与体内实验的优点,且其基因组与人类基因组的相似度高达87%[3,4],因此已广泛应用于毒理学、安全药理学等研究。阿霉素(doxorubicin, DOX)是一种广谱蒽环类抗肿瘤药, 主要用于白血病、实体瘤及多种癌症的治疗, 但由于其严重的剂量依赖性的心脏毒性,使其临床应用受到了限制[5]。本研究以DOX为阳性药物建立斑马鱼心脏毒性的模型,旨在为新药心血管毒性的高通量筛选提供基础数据及实验依据。
1 材料与方法
1.1实验动物
斑马鱼胚胎由杭州环特生物科技有限公司自行生产。斑马鱼的繁殖以自然成对交配的方式进行。每次交配准备4~5对成年斑马鱼,平均每对能产200~300个胚胎。在受精后6 h(6 hpf)和24 hpf对胚胎进行清理(移除已死亡胚胎),并根据胚胎的发育阶段挑选合适的胚胎。在28 ℃条件下用养鱼用水孵育胚胎(养鱼用水水质:每1L反渗透水中加入200 mg速溶海盐, 电导率为480~510 μS/cm; pH为6.9~7.2; 硬度为53.7~71.6 mg/L CaCO3)。因为胚胎可以从自身的卵黄囊中获取营养物质,所以在受精后9 d内(9 dpf)不需要喂食。实验完成后,用三卡因甲磺酸对各个发育阶段的斑马鱼进行过度暴露处理,从而将斑马鱼麻醉处死。
1.2药物、仪器与试剂
DOX, Pfizer公司生产, 规格: 10 mg/瓶。解剖显微镜(SZX7, Olympus, Japan); 与显微镜相连的相机(TK-C1481EC, JVC, Japan)六孔板(Nest Biotech, Shanghai, China); 心肌肌钙蛋白T(cTnT)和肌红蛋白(Mb)单克隆抗体(GeneTex, USA); HRP标记的羊抗鼠IgG (H+L)(Multisciences, China); 甲基纤维素(Aladdin, Shanghai, China); miR-146a以及U6逆转引物由ABI公司提供。
1.3方法
1.3.1确定DOX的致死浓度LC10和最大非致死浓度MNLC用DOX溶液处理一定阶段的野生型AB系斑马鱼幼鱼至实验终点(72 hpf)。DOX五个初始浓度设置为100 μmol/L、50 μmol/L、25 μmol/L、15 μmol/L和5 μmol/L, 同时设置空白对照组(养鱼水注射组)和溶剂对照组(0.9%NaCl注射液); 每个浓度处理30尾斑马鱼; 药物处理至实验终点, 统计各剂量组斑马鱼死亡数量, 绘制最佳浓度效应曲线, 并使用Origin统计学软件计算MNLC和LC10值; 若在所设置的浓度范围内, 有浓度出现全部死亡, 且MNLC和LC10值无法求得, 则缩小浓度范围, 重复上述实验步骤。1.3.2DOX的心血管毒性评价DOX溶液(浓度:MNLC/10、MNLC/3、MNLC和LC10)处理一定阶段的野生型AB系斑马鱼幼鱼至实验终点, 同时设置空白对照组(养鱼水处理组)和溶剂对照组(0.9%NaCl注射液); 每个浓度处理30尾斑马鱼。待测药物处理至实验终点时,在立体解剖显微镜下观察有无心包水肿、血流速度变化、血栓及出血等,计算各表型发生率。
1.3.3RT-PCR检测斑马鱼组织中miRNA146a的表达DOX溶液浓度均设置为MNLC/10、MNLC/3、MNLC和LC10, 并分别设置空白对照组(养鱼水处理组)和溶剂对照组(0.9%NaCl注射液)处理组; DOX每个浓度均处理50尾斑马鱼, 每个浓度两个重复; 处理至实验终点, 每个浓度收集100尾斑马鱼(-80 ℃贮存), 提取mRNA反转成cDNA样本后, 进行荧光定量RT-PCR检测。
在72 hpf处收集药物处理的斑马鱼胚胎,各剂量组30枚,放置于1.5 mL无RNA酶离心管中。用焦碳酸二乙酯(DEPC)水冲洗2次,然后加入1.0mLTrizol(加入Trizol的斑马鱼如不立即提取RNA,可置于-80℃保存)。
将装有Trizol和胚胎的1.5 mL离心管置于冰上,用经DEPC水浸泡的并高压灭菌的研磨棒进行研磨,使其裂解直至没有较大组织块为止, 然后按照说明书使用Trizol方法提取总RNA, 提取的总RNA加入去酶水(RNase Free ddH20)20 μL, 吹打均匀, 溶解RNA, 1 h后用分光光度计测RNA浓度, 并将其置于-80℃保存。
利用miRNA反转录试剂合成cDNA, 按照说明书步骤操作, 每一个反转录反应包括100 ng总RNA, 50 mmol/L引物, 1×RT缓冲液, 0.25 mmol/L dNTP, 0.25 U/μL RNA酶抑制剂和3.33 U/μL反转录酶, 总体系15 μL。
RT-PCR引物如下:
MiR-146a:正义,5'-CGGCGGTGAGAACTGAATTCCA-3'; 反义, 5'-GTG CAGGGTCCGAGGT-3';U6 snRNA: 正义, 5'-TCGCTACGGTGGCACATA-3';反义, 5'-TATGGAGCGCTTCACGG-3'
每一个PCR反应结束时进行熔解曲线分析,以保证只有一种cDNA的扩增,利用△△Ct 计算各组斑马鱼组织中miRNA146a的相对含量。
1.3.4Western blotting分析心脏蛋白类生物标志物cTnT和Mb在72 hpf处收集药物处理的斑马鱼, 各剂量组30枚, 按蛋白抽提试剂盒抽提总蛋白, 蛋白浓度测定按BCA蛋白浓度测定试剂盒相关说明操作。将各蛋白样品上样, 经10%SDS-PAGEA, 转膜, 放入新配制5%脱脂奶粉TBST中37℃封闭2 h, 加入一抗(1∶1 000) 4 ℃过夜, 加入HRP标记的羊抗鼠IgG (H+L)(1∶2 000) 37℃作用1h, 电化学发光试剂(ECL)显色。
1.4统计处理
采用SPSS20.0软件进行数据处理,实验数据以均数±标准差(>± s)表示,用单因素方差分析(ANVOA)进行统计学处理,组间比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1DOX的LC10和MNLC
DOX“浓度-致死”原始数据如表1和表2所示, 基于“浓度-致死”原始数据, 利用Origin模拟求得, DOX的MNLC和LC10分别为6.75 μmol/L 和7.2 μmol/L, 浓度-致死曲线如图1所示。
2.2DOX的心血管毒性
心血管毒性结果显示与溶剂对照组(0.9%NaCl)比较, MNLC/10处理组斑马鱼未见异常, 没有观察到心血管毒性; MNLC/3处理组斑马鱼出现心血管毒性,表现为血流变慢(发生率26.7%)、血流缺失(发生率6.7%)、静脉窦处瘀血(发生率40.0%)和静脉窦处水肿(发生率16.7%,如图2所示); MNLC和LC10处理组斑马鱼出现较严重的心血管毒性, 表现为血流完全缺失(发生率均为100%)、静脉窦处瘀血(发生率均为100%)和静脉窦处水肿(发生率分别为26.7%和73.3%)。这些结果提示DOX在浓度≤MNLC/10时,不诱发斑马鱼心血管毒性; 当浓度≥MNLC/3时, 可诱发斑马鱼心血管毒性。

表 1 DOX浓度与致斑马鱼死亡情况 (n=30)
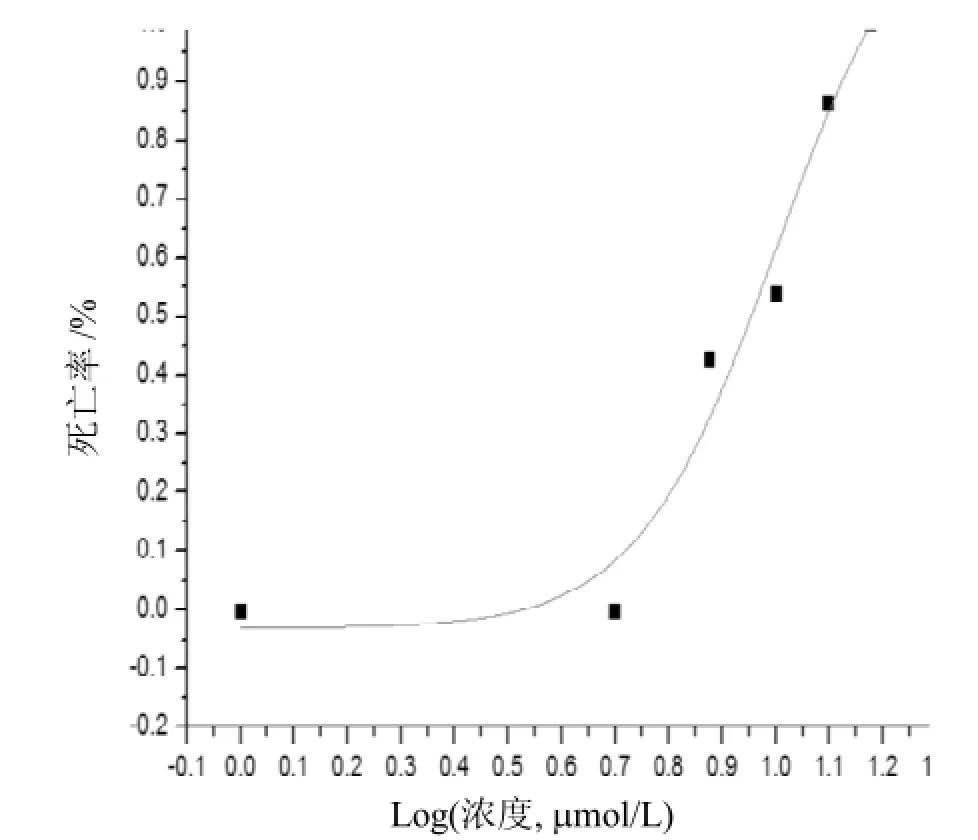
图1 DOX“浓度-致死”曲线
2.3DOX对斑马鱼组织中miRNA146a表达的影响
荧光定量RT-PCR结果显示, DOX的三个剂量MNLC/3、MNLC、LC10均显著提高miRNA146a的表达(与对照组比较P<0.01), 且存在一定剂量关系(图3)。
2.4DOX对斑马鱼心脏蛋白类生物标志物的影响
Western blotting结果显示, Dox模型组的cTnT 和Mb蛋白表达与空白对照组比较均未见明显变化(P>0.05)(图4)。
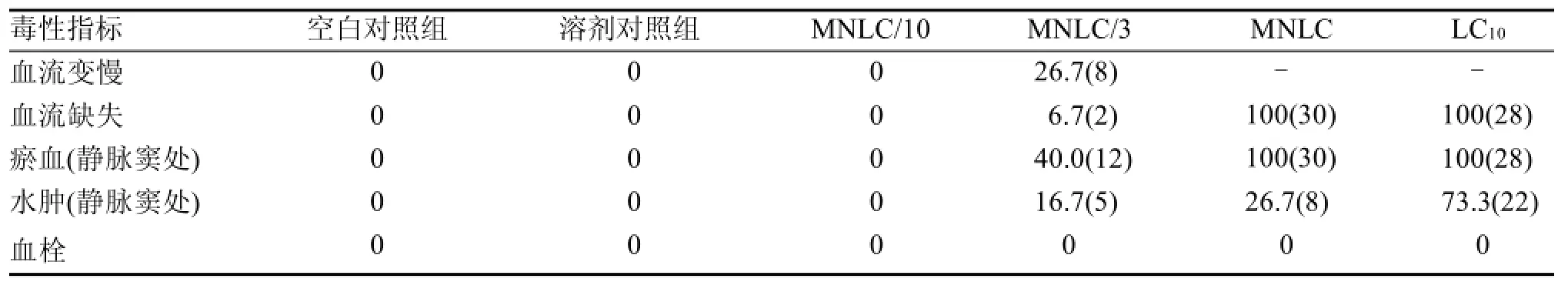
表 2 斑马鱼心血管毒性各项指标发生率 %
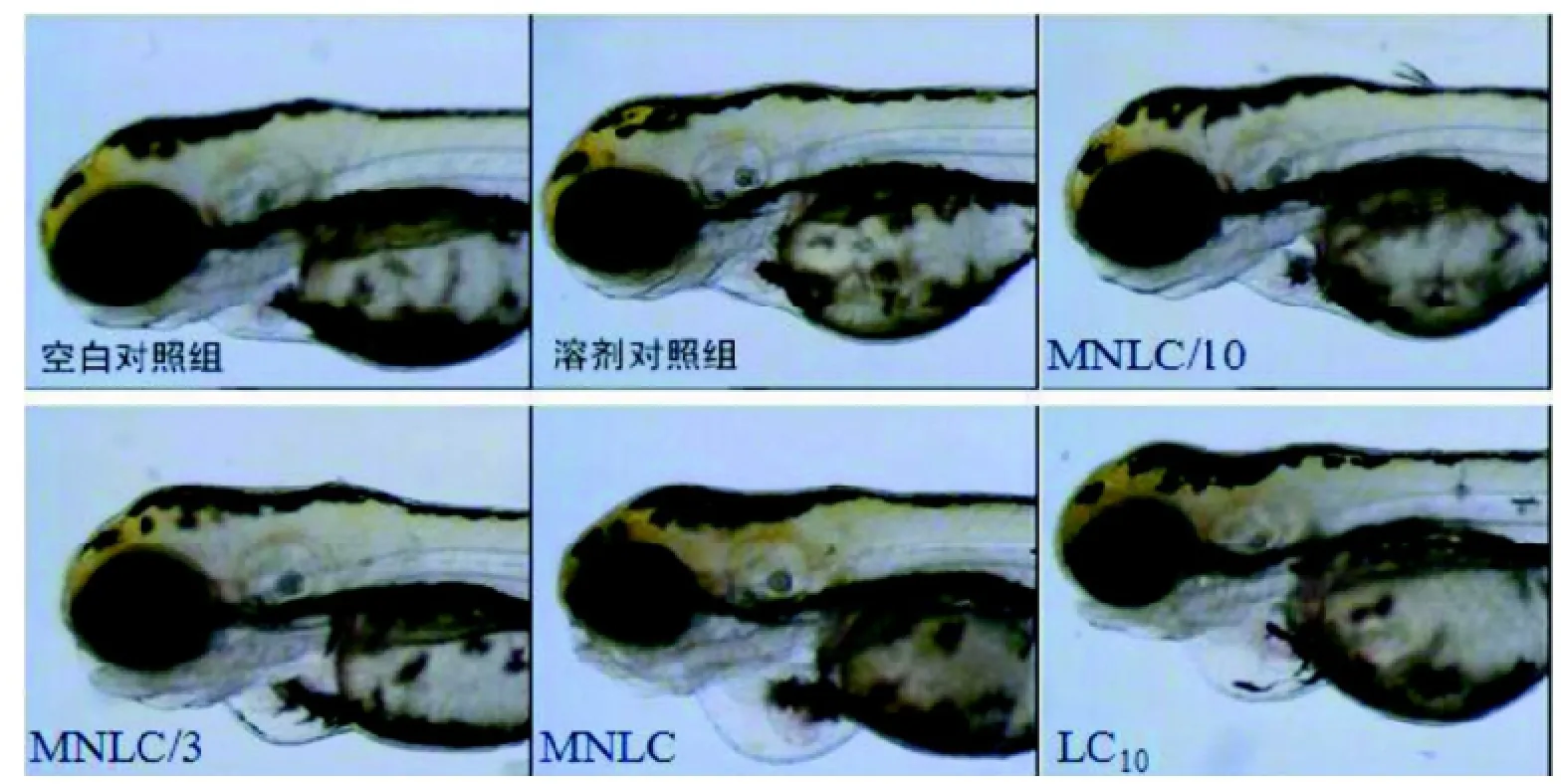
图2 斑马鱼心血管毒性表型
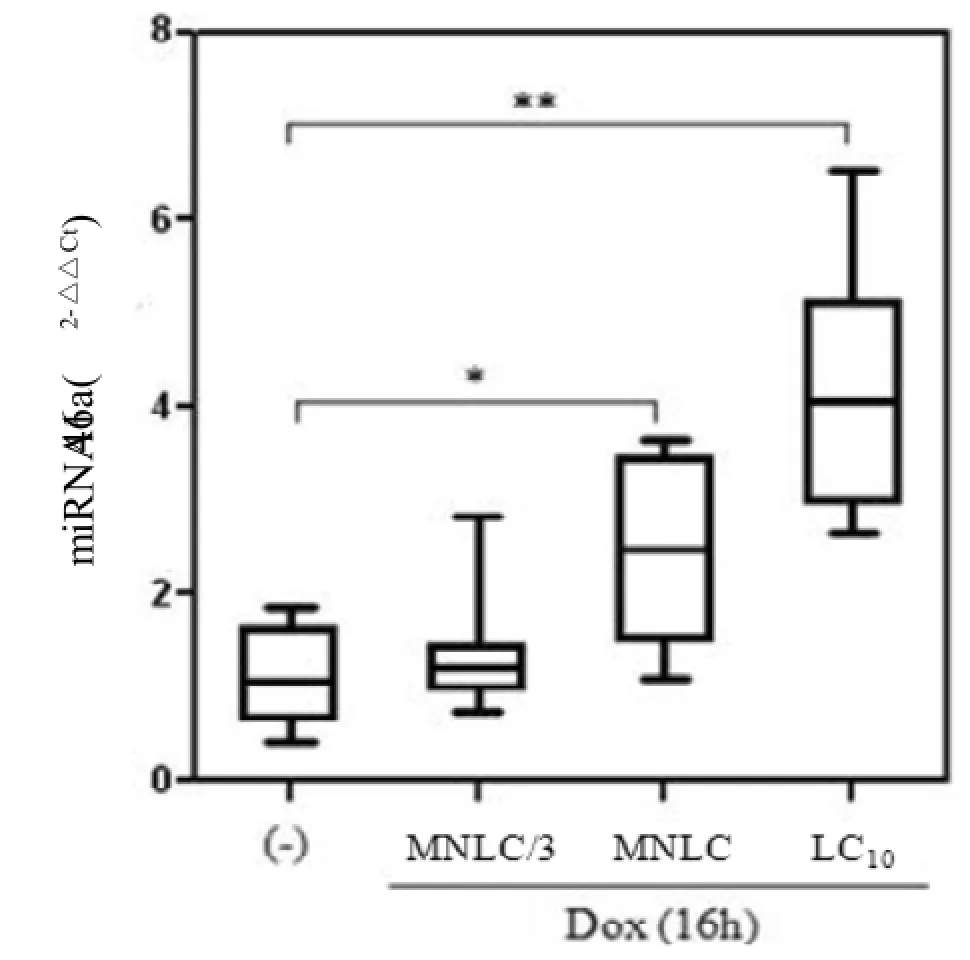
图3 DOX对斑马鱼组织中miRNA146a表达的影响
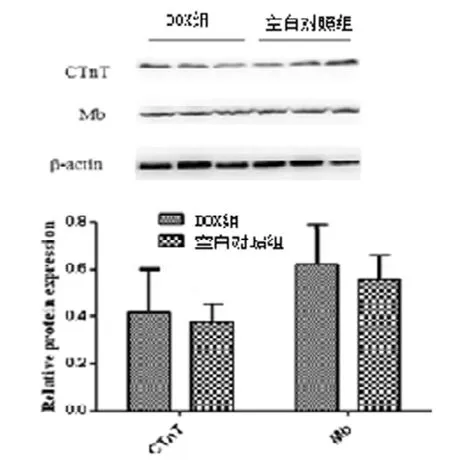
图4 Western blotting分析DOX对斑马鱼组织中cTnT和Mb蛋白表达的影响
3 讨论
斑马鱼作为新型的脊椎模式动物,已成为国内外热点。由于其符合“3R”原则,被欧洲替代法验证中心(ECVAM)推荐为新的替代动物[6]。自1990年代起, 在我国开始应用于药物毒理与安全性评价。斑马鱼早期胚胎及幼鱼通体透明, 发育24 h后几乎所有脏器均已成型, 其心脏体节清晰利用体视显微镜即可直接观察及拍摄[7]。斑马鱼的心脏只有一个心房与一个心室, 结构类似3周的人胚胎心脏[8]。它早期的发育存活不依赖于血液循环, 可以在缺血的状态依靠氧扩散下存活一段时间,相比于哺乳动物缺血后死亡、心脏失活, 斑马鱼这一特点更利于寻找心脏发育或功能缺陷突变体[9]。因而斑马鱼非常适合心血管药物的研究, 是一个很好的脊椎模式动物模型。如吴晓敏等[10]采用阿司咪唑处理72 hpf斑马鱼, 发现斑马鱼出现心率下降、SV-BA间距增大、全身无血流、心脏停跳等中毒现象并具有时间、剂量依赖性。王思锋等[11]以不同浓度的雷公藤红素处理发育48 h斑马鱼胚胎, 结果显示雷公藤红素能引起胚胎心脏中毒、心率下降等现象。方芳等[12]观察不同浓度乌头碱对斑马鱼心脏的影响,证实乌头碱可导致胚胎心脏出现心膜出血、心包囊水肿等中毒现象, 且与乌头碱的浓度呈正相关。
DOX的临床应用受到其严重的心脏毒性所限制,多数研究认为,DOX的心脏毒性机制可能包括自由基损伤、促进细胞凋亡、钙超载等,但氧化应激为其主要的机制之一[13]。DOX在体内代谢转化为具有毒性的半醌阿霉素,与分子氧相互作用,发生氧化应激,产生活性氧。活性氧与细胞内成分作用, 造成脂质过氧化,对心肌细胞膜和线粒体膜造成氧化损伤[14]。由于心肌细胞的过氧化物酶活性偏低,因而心脏毒性更为明显。本研究通过检测与氧化应激水平相关的灵敏度较高的生物标志物miRNA146a的表达, 证实DOX的三个剂量MNLC/3、MNLC、LC10均显著提高miRNA146a的表达(与对照组比较P<0.01),即miRNA146a的表达升高,则氧化应激水平增加。
本实验采用不同浓度的DOX处理72 hpf斑马鱼,实验结果显示当浓度≥MNLC/3(MNLC=6.75 μmol/L)时, 可诱发斑马鱼血流变慢、血流缺失、静脉窦处瘀血和静脉窦处水肿等心血管毒性, 且具有剂量相关性。荧光定量RT-PCR结果显示, DOX的三个剂量MNLC/3、MNLC、LC10均显著提高miRNA146a的表达(与对照组比较P<0.01), 且存在一定的剂量关系。Western blotting结果显示, DOX模型组的cTnT 和Mb蛋白表达与空白对照组比较均未见明显变化(P>0.05)。与前期本研究组用DOX建立的SD大鼠心脏损伤动物模型相比较,发现DOX可以致斑马鱼心脏在外观上发生明显变化, 同时miRNA146a的表达也同样发生显著变化,同样对cTnT和Mb蛋白的表达未出现明显变化。说明斑马鱼模型与哺乳动物模型具有良好的相关性[15]。本研究模型的建立可以为新药心血管毒性的高通量筛选体系以及安全性评价提供基础依据和技术支持。
[1]廖小立, 姚峰, 吴端生, 等. 实验鱼类在药学研究中的应用[J]. 中国医药科学, 2013, 3(22):18.
[2]贾顺姬, 孟安明. 中国斑马鱼研究发展历程及现状[J]. 遗传, 2012, 34(9):1082-1088.
[3]姜利军, 周晓曦, 李钦璐, 等. 斑马鱼GiF-1 基因结构和功能分析[J]. 现代生物医学进展, 2012, 12(17):3213-3216.
[4]Tsang M. Zebrafish: a tool for chemical screens[J]. Birth Defects Res C Embryo Today, 2010, 90(3):185-192.
[5]Robert J. Long-term and short-term models for studying anthracycline cardiotoxicity and protectors[J]. Cardiovasc Toxicol, 2007, 7(2):135-139.
[6]Eimon PM, Rubinstein AL. The use of in vivo zebrafish assays in drug toxicity screening[J]. Expert Opin Drug Metab Toxicol, 2009, 149(2):196-209.
[7]Brittijn SA, Duivesteijn SJ, Belmamoune M, et al. Zebrafish development and regeneration: new tools for biomedical research [J]. Int J Dev Biol, 2009, 53:835-850.
[8]黄惠琳, 刘华钢, 蒙怡, 等. 氯化两面针碱对斑马鱼胚胎心脏影响的初步研究[J]. 广西医学, 2011, 33(5):546-548.
[9]常嘉, 陆亮, 王庆利, 等. 斑马鱼在药物早期毒性筛选中的应用进展[J]. 中国实验方剂学杂志, 2013, 22(13):1500.
[10] 吴晓敏, 何秋霞, 韩利文, 等. 阿司咪唑对斑马鱼心脏毒性的初步研究[J]. 中国药理学通报, 2013, 29(9):1251-1254.
[11] 王思锋, 刘可春, 王希敏, 等. 雷公藤红素对斑马鱼胚胎心脏毒性的初步研究[J]. 中国药理学通报, 2009, 25(5):634-636.
[12] 方芳, 赵杰, 余林中, 等. 乌头碱对斑马鱼心血管毒性的初步研究[J]. 中药药理与临床, 2012, 28(2):31-32.
[13] Robert J. Long-term and short-term models for studying anthracycline cardiotoxicity and protectors[J]. Cardiovasc Toxicol, 2007, 7(2):135-139.
[14] van Boven WJ, Gerrisen WB, Driessen AH, et al. Myocardial oxidative stress, and clee injury comparing three different techniques for coronary artery bypass graft[J]. Eur J Cardio thorac Surg, 2008, 34(5):969-975.
[15] Xin YF, Zhou GL, Deng ZY, et al. Protective effect of lycium barbarum on doxorubicin-induced cardiotoxicity[J]. Phytother Res, 2007, 21(11):1020-1024.
Estabilishment of Cardiotoxicity Model in Zebrafish Induced by Doxorubicin
ZHANG Cheng-da, ZHANG Li-li, ZHANG Li-jiang, CHEN Yun-xiang
(Zhejiang Acadamy of Medical Science, Hangzhou 310012, China)
ObjectiveTo establish zebrafish model of cardiotoxicity induced by doxorubicin (DOX). MethodsThe wild type zebrafish was divided into 6 groups: 4 different concentrations of DOX solution, control group and 0.9% NaCl groups. To assay the expression of cardiac troponin T(cTnT) and myoglobin (Mb) by Western blot at 72 hpf (72 hours post fertilization). Morphologic changes in the cardiovascular system were observed understereomicroscope. The expression of miRNA146a in zebrafish was tested by RT-PCR. ResultsDOX had no cardiotoxicity in zebrafish within 0~MNLC/10; when the concentration of DOX ≥MNLC/3, it can be induced cardiovascular toxicty in the zebrafish, manifested as blood flow slows down, the lack of blood flow, venous sinus congestion, venous sinus edema and it is dose-dependent. Tissue expression of miRNA146a on zebadfishes of 3 concentrations were all increased compared with control group (P<0.01), and it is dose-dependent. There was no significant differences in the expression of cTnT and Mb between DOX groups and control group (P>0.05). ConclusionThe cardiotoxicity induced by DOX was significant and ithad a similar toxic effect to mammal. So the zebrafish model of cardiotoxicity induced by DOX was successfully established.
Doxorubicin (DOX); Cardiotoxicity; Zebrafish; Model
Q95-33
A
1674-5817(2015)05-0362-05
10.3969/j.issn.1674-5817.2015.05.004
2015-03-25
浙江省科技计划项目(2012C37098), 浙江省科技计划项目(2010F10026),浙江省医药卫生科技计划项目(2014KYA046)
张城达(1983-), 男, 研究实习员, 研究方向: 药物毒理学。E-mail: zcdhd@163.com
陈云祥(1975-), 男, 高级实验师, 研究方向: 药物毒理学。E-mail: cyx75001@163.com
