西瓜离体组织培养再生体系的研究进展
2015-10-14牛美丽党选民贺滉詹园凤
牛美丽++党选民++贺滉++詹园凤
摘 要 阐述了西瓜离体组织培养再生体系建立过程中的一些重要影响因素,如苗龄、基因型、外植体等方面,探讨其存在的问题,并对西瓜再生体系的未来进行展望。
关键词 西瓜 ;离体组织培养 ;再生体系
分类号 S651
Research Progress of in Vitro Regeneration System of Watermelon
NIU Meili1) DANG Xuanmin2) HE Huang2) ZHAN Yuanfeng2)
(1 College of agriculture Hainan University, Haikou, Hainan 570208;
2 Tropical Crops Genetic Resources Institute, CATAS, Danzhou, Hainan 571737)
Abstract This paper expounds some important factors of the regeneration system of the tissue culture of the watermelon including seedling age, genotype, and explants, discusses some problems, and looks forward to the establishment of regeneration system of watermelon in the future.
Keywords watermelon ; tissue culture ; regeneration system
西瓜[Citrullus lanatus (Thunberg) Matsumura et Nakai]属葫芦科(Cucurbitaceae)双子叶开花植物,是我国重要的水果类经济作物,为了满足广大消费者的需求,西瓜育种技术也在不断创新。近年来,随着植物基因工程技术的迅速发展,利用转基因技术进行种质创新,培育优质、高产的抗病新品种成为西瓜遗传育种研究的热点。西瓜离体高效组培再生体系的建立是转基因成功的关键。1971年Andrus[1]首次报道,成功建立了无籽西瓜的无性繁殖体系,随后许多学者相继做了大量的研究[2-4]。
西瓜离体培养的基本原理是利用植物的再生能力及植物细胞的全能性。与大多数植物相比,西瓜的再生能力较弱,不易通过愈伤组织途径形成再生植株,而且玻璃化现象严重,移栽不易成活。因此,加强西瓜高效组织培养的研究,有助于提高转基因技术在西瓜育种方面的应用。笔者对目前西瓜离体培养再生体系的研究现状进行综述,为进一步完善西瓜再生体系提供理论基础。
1 影响西瓜离体培养再生体系建立的因素
1.1 苗龄
苗龄对于不定芽诱导率的影响较大,苗龄的不同决定着外植体生理状态的不同。Tabei[5]、Dong[6]和Compton[7]等认为,苗龄为5 d的幼苗子叶的不定芽诱导频率最高;马国斌等[8]认为,不同苗龄子叶的不定芽分化率有明显差异,2 d苗龄子叶的不定芽分化频率最高,这与王春霞等[9]的报道一致;任春梅等[10]的研究认为,刚刚由黄转绿的苗龄(4~5 d)的子叶诱导产生不定芽的频率最高,而苗龄为8~9 d的子叶诱导产生的不定芽最多;Chaturvedi等[11]则认为,7 d苗龄的子叶诱导率最高;赵彩萍等[12]认为,4~6 d苗龄子叶诱导不定芽的效率较高;袁建民[13]的研究认为,苗龄为3~5 d的子叶不定芽诱导率最高,超过5 d不定芽诱导率随之下降,10 d以上苗龄的子叶不能诱导产生不定芽;肖守华等[14]同样认为,西瓜苗龄为3~5 d子叶不定芽诱导率维持在较高水平,而且观察到此时子叶颜色由淡黄色转为浅绿色,随着子叶颜色加深,诱导率下降。因此,在西瓜离体培养中,一般多采用4~5 d苗龄的无菌苗子叶作为外植体。但是,由于不同品种的种子发育快慢存在差异,以培养的天数来确定苗龄并不合适,而以子叶颜色判断可能更加有效,无菌苗子叶呈现淡绿色时不定芽诱导率最高,这在黄学森[15]、任春梅[10]、王果萍[16]及袁建民[13]等学者的研究中都有报道。
1.2 基因型
基因型是影响植株再生的内因。选用合适的基因型材料是西瓜组织培养成功与高效的关键,不同的基因型材料诱导分化率有很大差别[4]。一些研究发现,不定芽的诱导不仅受植物激素的影响,而且跟外植体的基因型有关[4,13,17-20]。如郑先波[21]报道,基因型与愈伤组织诱导关系密切,品种黑蜜5号是最易产生愈伤组织的基因型;董焱等[22]则认为,以未成熟胚为外植体建立的西瓜再生体系对基因型的依赖性不强,如果以未成熟胚为遗传转化的受体,有望克服其品种局限性。
1.3 外植体
可以作为西瓜离体再生的外植体种类很多,如顶芽、体胚、真叶、子叶块、茎尖及下胚轴等,但即使是源自于同一植株的不同外植体类型,其诱导频率也不相同[23]。任春梅[10]、万勇[24]等认为,顶芽诱导不定芽的诱导率高于子叶;张志忠等[25]则认为,茎尖和子叶块是诱导不定芽较好的外植体;张全美[26]采用子叶近胚轴端(带1 mm下胚轴)诱导西瓜不定芽,其诱导率达到100%,远高于远胚轴端,这与Compton[27]和王果萍[16]的研究结果一致;袁建民[13]的研究也认为,子叶近胚轴端是不定芽诱导的最佳外植体。外植体的发育时期也会影响西瓜的再生能力。Compton等[28]用西瓜未成熟胚的子叶作外植体得到了体细胞胚胎,但是他们同时用成熟子叶作外植体进行研究时,就没有得到体细胞胚胎或者不定芽。这说明未成熟胚的子叶再生能力更强。目前大多数研究者在组织培养过程中采用最多的是子叶作为外植体。
目前,针对外植体接种方式对不定芽诱导影响的研究也相对比较少。商丽敏[23]将外植体分别以近轴端和远轴端2种方式接种在芽诱导最适培养基上,研究发现,无论以哪种方式将外植体接种在培养基上,不定芽产生的部位总是局限于近轴端;其他学者也有类似报道[7,20,29]。
1.4 激素浓度配比
生长调节物质的浓度及配比,是调控植物器官产生愈伤组织和丛生芽的主导因素。因此,培养基中激素的种类、浓度与组合对愈伤组织及丛生芽的形成起着至关重要的作用[30]。在西瓜的离体培养中,多数选择从子叶或下胚轴直接诱导芽分化途径,可以获得很高的分化率。在培养基中加入细胞分裂素的目的,主要是促进细胞分裂和分化不定芽,生长素被用于诱导细胞的分裂。
1.4.1 激素浓度配比对愈伤组织的诱导影响
宋道军等[4]研究认为,改良的MS(MS+2.0 mg/L 6-AB+0.1 mg/L NAA)是西瓜愈伤组织诱导的最适培养基;邱敏等[31]将外植体接种于MS+5.0 mg/L 6-BA培养基上诱导愈伤组织,诱导率可达100%;闫静[32]则发现,使用培养基MS+1.0 mg/L NAA+0.5 mg/L BA+2.0 mg/L KT诱导京欣愈伤组织时效果最好,不仅诱导率高,而且诱导的愈伤组织质量好,没有外植体褐化情况发生。
由于西瓜通过诱导愈伤组织形成再生植株难度大、周期长及容易出现玻璃化苗,因此在西瓜再生体系建立中,通常是直接诱导外植体形成不定芽再生完整植株。
1.4.2 激素浓度配比对不定芽诱导的影响
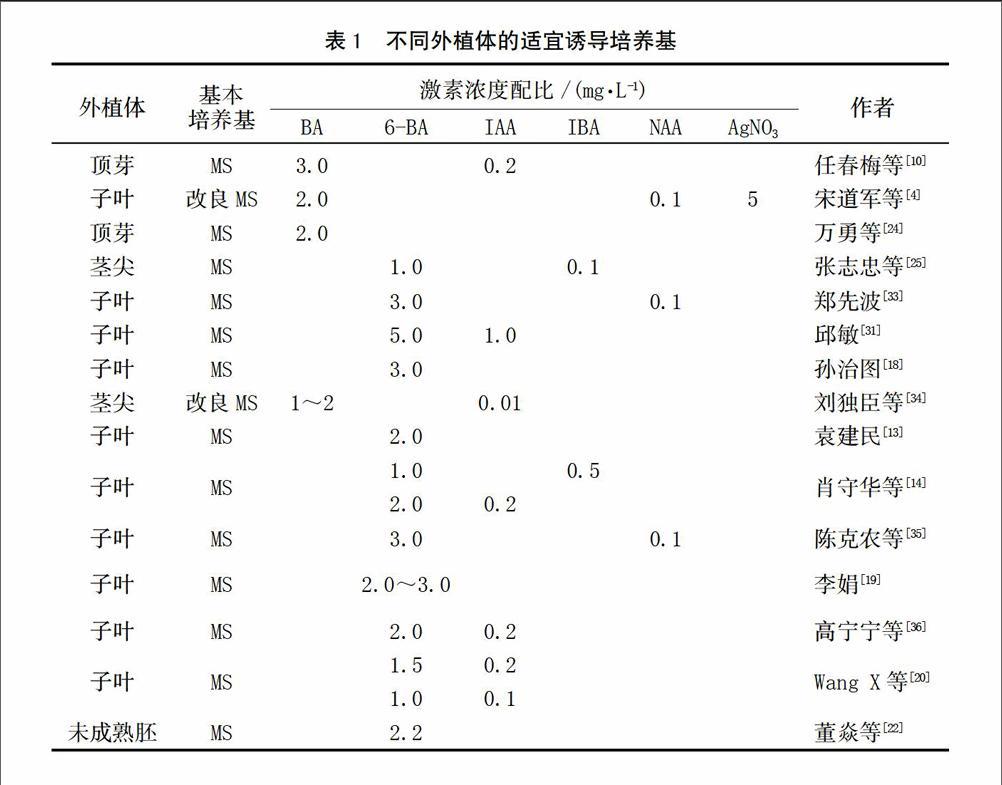
激素是诱导外植体产生不定芽的重要因素之一。不同的激素类型和浓度配比对不定芽影响明显,很多学者对此也进行了研究。统计结果如表1。
表1的研究结果均为直接诱导外植体产生不定芽,且一定浓度的6-BA是诱导西瓜外植体分化所必须的激素,附加低浓度的IAA、IBA或者NAA则有利于不定芽的诱导分化,但是不同基因型的西瓜不定芽诱导率存在一定的差异。而宋道军[4]则认为,加入适量的AgNO3能不同程度地提高西瓜外植体不定芽的分化能力,以5 mg/L最为适宜,其对不定芽分化的诱导率最大可以提高10%。有研究指出,在植物离体培养中,AgNO3不仅可减少外植体愈伤组织的形成,使褐化现象受到抑制,而且还能提高芽诱导率[37-39]。
1.4.3 激素浓度配比对不定芽伸长的影响
万勇等[24]认为,不定芽伸长培养的最佳培养基是MS+0.5 mg/L BA +1.0 mg/L IAA;张志忠等[25]将不定芽移入新鲜的MS+1.0 mg/L 6-BA+0.5 mg/L IBA上获得了很好的伸长效果,这与陈克农等[35]的观点一致;刘独臣等[34]利用改良的MS+0.2 mg/L KT+0.01 mg/L IAA培养基对不定芽进行培养,伸长率高达97%;高宁宁等[36]认为,不定芽的最佳伸长培养基为MS+0.2 mg/L KT,任春梅[10]、袁建民[13]及肖守华[14]等也均有类似报道;而李娟[19]则认为,添加了0.2 mg/L KT的MS培养基对不定芽的伸长无明显促进作用,且伸长后的不定芽较难生根。
1.4.4 激素浓度配比对生根的影响
虽然NAA、KT、IAA和IBA都能明显地促进生根,但不同激素种类及浓度对生根的影响也有差异。任春梅等[10]认为,KT、NAA和IAA这3种激素对生根诱导无明显差异;刘独臣等[34]将不定芽移栽1/2 MS+0.05 mg/L IAA在培养基上生根率达95%;陈克农等[35]则认为,最适宜的生根培养基为1/2 MS+0.4 mg/L IAA;而高宁宁[36]、商丽敏[23]等则认为,最佳的生根培养基为1/2 MS+0.1 mg/L IAA。肖守华等[14]研究认为,在MS培养基中添加0.2 mg/L的IBA或者IAA皆可诱导出形态正常、有明显根毛的不定根,综合考虑最终认为,西瓜再生植株生根采用MS+0.2 mg/L IBA培养基较为理想;赵爽[40]则认为,在MS培养基中附加0.05 mg/L NAA最适合再生苗的生根培养。
1.5 培养条件
温度和光照是影响植物芽诱导的重要环境条件。西瓜外植体离体培养的温度一般控制在(25±2)℃,最适光照一般控制在1 500~3 000 lx,光照时间控制在12~16 h/d。王春霞等[9]认为,对外植体进行暗处理是获得高频再生的关键,未经暗处理外植体的出芽率(19%)显著低于经过6 d暗处理外植体的出芽率(86%)。袁建民[13]的研究认为,先暗培养3 d,待不定根长到0.5 cm左右时转到光照下培养较为适宜。总之,适当的暗处理有利于不定芽的形成。
2 存在的问题
玻璃化现象在西瓜组织培养过程中比较严重。万勇等[24]研究发现,在不定芽的继代培养与伸长培养过程中,均有不同程度的玻璃化现象。尤其是芽的伸长,采用MS+KT 0.2 mg/L培养基,有50%的玻璃化苗,这类苗转入生根诱导后不能形成完整植株。Thomas等[41]也指出,这种情况几乎无法避免,这与培养基类型、琼脂浓度、渗透调节物质、通气情况等均有关。张志忠等[25]通过每2周继代1次、降低外植体密度和定期于无菌条件下通气等措施,在很大程度上缓解了玻璃化现象,芽伸长过程中继代时适当降低激素浓度也有所帮助。
此外,许多研究表明,西瓜试管苗的生根都比较容易,但直接移栽有难度,需通过嫁接保证其成活率[2-3,10]。孙治图等[18]将试管苗先移入消毒的草炭和蛭石,待其长出新根后再移栽,采用这种延缓试管苗移栽的方法,可以让试管苗在无菌条件下适应移栽后的生长环境,提高其适应能力,减少根系的损伤,起到炼苗作用,提高其成活率。
3 展望
目前,有报道通过诱导完全脱分化愈伤组织,然后进行再生不定芽培养,已经成功获得了由伊选和京欣两类西瓜间接再生不定芽,并通过伸长、生根培养获得了完整植株。但是愈伤组织再生成不定芽的频率很低,因此,需要进一步加强这方面的基础理论研究。另外,如何采取更加有效的措施解决西瓜组织培养过程中的问题也必不可少,这将为建立适合西瓜的快速、高效繁殖再生体系提供有力保障。
参考文献
[1] Andrus C F, Seshadri V S, Grimuball P C. Production of seedless watermelons[J]. USA Technical Bulletin, 1971(1425).
[2] 许智宏,卫志明,刘桂云. 用离体培养无性繁殖三倍体无籽西瓜(Citrullus vulgaris Schrad.)[J]. 植物生理学报,1979,5(3):245-251
[3] 高新一,林翔鹰,杨春燕,等. 无籽西瓜无性系繁殖的研究[J]. 中国农业科学,1983(2):58-63.
[4] 宋道军,陈若雷,尹若春,等. 西瓜高效组织培养再生体系的初步研究[J]. 中国西瓜甜瓜,2000(4):8-11.
[5] Tabei Y, Yamanaka H, Kanno T. Adventitious shoot induction and plant regeneration from cotyledons of mature seed in watermelon (Citrullus lanatus L.) [J]. Plant Tissue Culture Letters, 1993, 10(3): 235-241.
[6] Dong J Z, Jia S R. High efficiency plant regeneration from cotyledons of watermelon (Citrullus vulgaris Schrad) [J]. Plant Cell Reports, 1991, 9(10): 559-562.
[7] Compton M E, Gray D J. Shoot organogenesis and plant regeneration from cotyledons of diploid, triploid, and tetraploid watermelon [J]. Journal of the American Society for Horticultural Science, 1993, 118(1): 151-157.
[8] 马国斌,王 鸣,郑学勤. 西瓜组织培养再生体系的比较研究[J]. 中国西瓜甜瓜,1998(3):9-10.
[9] 王春霞,简志英,刘 愚,等. ‘京欣一号西瓜子叶组织培养的研究[J]. 园艺学报,1996,23(4):401-403.
[10] 任春梅,董延瑜,洪亚辉,等. 西瓜组织培养的研究[J]. 湖南农业大学学报,2000,26(1):50-53.
[11] Chaturvedi R, Bhatnagar S P. High-frequency shoot regeneration from cotyledon explants of watermelon cv. sugar baby [J]. In Vitro Cellular and Developmental Biology——Plant, 2001, 37(2): 255-258.
[12] 赵彩萍,王荣华,张治平,等. 西瓜植株再生优化体系的研究[J]. 安徽农业大学学报,2009,36(2):303-308.
[13] 袁建民. 小果型西瓜离体培养关键技术及四倍体诱导研究[D]. 海口:海南大学,2010.
[14] 肖守华,李国生,焦自高,等. 西瓜高效再生体系的建立[J]. 中国瓜菜,2010,23(3):11-14.
[15] 黄学森,焦定量,那 丽. 西瓜子叶离体培养获得再生植株[J]. 中国西瓜甜瓜,1994(3):15-16.
[16] 王果萍. 西瓜高效组织培养技术体系研究[J]. 中国西瓜甜瓜,2002(2):1-3.
[17] Compton M E, Gray D J. Adventitious shoot organogenesis and plant regeneration from cotyledons of tetraploid watermelon[J]. HortScience, 1994, 29(3): 211-213.
[18] 孙治图,许 勇,张海英,等. 西瓜离体再生高效基因型材料的筛选[J]. 中国瓜菜,2008(3):5-9.
[19] 李 娟. 西瓜离体再生体系的建立及根癌农杆菌介导Pti4基因的遗传转化[D]. 雅安:四川农业大学,2011.
[20] Wang X, Shang L, Luan F. A highly efficient regeneration system for watermelon (Citrullus lanatus Thunb.) [J]. Pakistan Journal of Botany, 2013, 45(1): 145-150.
[21] 郑先波,夏国海,崔 红,等. 无籽西瓜种苗愈伤组织诱导研究[J]. 河南农业大学学报,2003,37(1):39-43.
[22] 董 焱,张 洁,张海英,等. 西瓜未成熟胚高效再生体系的建立[J]. 中国瓜菜,2014,27(3):10-13.
[23] 商丽敏. 几丁质酶和葡聚糖酶基因对西瓜遗传转化的研究[D]. 哈尔滨:东北农业大学,2012.
[24] 万 勇,张 铮,刘红梅,等. 西瓜组织培养快速繁殖的初步研究[J]. 江西农业学报,2002,14(4):47-50.
[25] 张志忠,吴菁华,吕柳新. 西瓜高频再生系统的研究[J]. 中国农学通报,2004,20(2):150-153.
[26] 张全美. 西瓜高效植株再生体系建立及四倍体离体诱导研究[D]. 杭州:浙江大学,2004.
[27] Compton M E. Interaction between explant size and cultivar affects shoot organogenic competence of watermelon cotyledons [J]. HortScience, 2000, 35(4): 749-750.
[28] Compton M E, Gray D J. Somatic embryogensis and plant regeneration from immature cotyledons of watermelon[J]. Plant Cell Reports, 1993, 12: 61-65.
[29] Krug M G Z, Stipp L C L, Rodriguez A P M, et al. In vitro organogenesis in watermelon cotyledons [J]. Pesquisa Agropecuária Brasíleira, 2005, 40(9): 861-865.
[30] 陈海伟,毕晓丹. 植物激素对无籽西瓜丛生芽诱导的影响[J]. 安徽农业科学,2011,39(4):1954-1955.
[31] 邱 敏,林 聪. 西瓜组织培养与再生体系的初步建立[J]. 农业科技与信息,2007(11):29-30.
[32] 闫 静. 西瓜愈伤组织分化不定芽体系的建立及耐冷体细胞无性系变异研究[D]. 杭州:浙江大学,2005.
[33] 郑先波,栗 燕,张恒涛,等. 无籽西瓜子叶离体培养及植株再生研究[J]. 中国农学通报,2005,21(8):43-45,48.
[34] 刘独臣,房 超,刘小俊,等. 小西瓜茎尖离体再生体系的建立[J]. 西南农业学报,2008,21(5):1 373-1 377.
[35] 陈克农,朱子成,王 欣,等. 西瓜子叶再生体系的初步建立[J]. 北方园艺,2010(6):156-158.
[36] 高宁宁,张 显,刘娜娜. 西瓜子叶离体再生体系的建立[J]. 北方园艺,2011(10):121-123.
[37] 刘玉霞,叶德友,欧巧明,等. 黄瓜离体子叶再生体系的建立[J]. 北方园艺,2014(19):113-117.
[38] 秦小舒,曹福亮,逯 岩,等. AgNO3对银杏胚愈伤组织诱导及分化的影响[J]. 江西农业大学学报,2014,36(5):958-964.
[39] 刘 娟,汤浩茹,王小蓉,等. 硝酸银在植物离体培养中的应用之研究进展[J]. 中国农学通报,2007,23(10):400-406.
[40] 赵 爽. 西瓜非生物胁迫响应R2R3MYB转录因子基因鉴定[D]. 武汉:华中农业大学,2014.
[41] Thomas P, Mythili J B, Shivashankara K S. Explant, medium and vessel aeration affect the incidence of hyperhydricity and recovery of normal plantlets in triploid watermelon [J]. The Journal of Horticultural Science and Biotechnology, 2000, 75(1): 19-25.
