TDZ对尾细桉叶片离体再生的影响
2015-10-14范春节王象军裘珍飞曾炳山
范春节++王象军++裘珍飞++曾炳山++刘英++李湘阳

摘 要 以尾细桉9个无性系叶片为外植体进行叶片离体培养和植株再生研究。结果表明,TDZ对尾细桉的再生诱导起着明显的促进作用,9个尾细桉无性系都获得了植株诱导再生,再生过程中不同的无性系呈现出不同的TDZ响应浓度,TDZ浓度在0.005~0.010 mg/L时获得较高的再生效率。不同无性系之间的再生率呈现出明显的差异,其中无性系YL2获得了最高达69.2%的植株再生效率,且每个外植体平均芽数超过10个。TDZ浓度对YL2的再生起到显著性影响,0.050 mg/L时再生效率最高,可以进行下一步的遗传转化研究。
关键词 尾细桉 ;叶片 ;植株再生 ;TDZ
分类号 S792
Effect of TDZ in Vitro Culture and Plant Regeneration from Leaves
of Eucalyptus urophylla×E. tereticornis Clones
FAN Chunjie WANG Xiangjun QIU Zhenfei
ZENG Bingshan LIU Ying LI Xiangyang
(Research Institute of Tropical Forestry, Chinese Academy of Forestry,
Guangzhou, Guangdong 510520, China)
Abstract In this study, leaves were applied as explants to establish a regeneration protocol for nine Eucalyptus urophylla×E. tereticornis clones. The results showed that all nine clones tested were amenable to improve production using modified MS media containing TDZ. Differences in TDZ concentrations requirements for organogenesis were observed between different clones and shoots were induced at a high frequency with 0.005~0.010 mg/L TDZ. For E. urophylla×E. tereticornis clones YL2, shoot regeneration frequency was significantly effected by TDZ concentration. Up to 69.23% regenerating leaves provided with over 10 buds were obtained on modified MS medium containing 0.050 mg/L TDZ. The efficient plant regeneration system developed here will be helpful for further genetic improvement in E. urophylla ×E. tereticornis clone YL2.
Keywords Eucalyptus urophylla×E. tereticornis ; leaves ; shoot regeneration ; TDZ
桉树起源于澳大利亚及附近岛屿,是桃金娘科(Myrtaceae)桉树属(Eucalyptus)的总称,是一种集观赏、用材、纸浆原料、药用于一体的优良树种。由于桉树具有速生丰产、适应性广等特点,在热带和亚热带地区有广泛的栽培,是华南地区第一大造林树种[1]。近年来,由于转基因技术的发展,通过转基因技术获得桉树抗虫、抗旱、抗寒优良特征的新品种是植物育种的重要途径之一[2]。然而,转基因体系依赖于高效稳定的再生体系,具有高效稳定再生率的再生体系成为发展桉树转基因技术的一大难题。
桉树再生体系建立已经有多个报道,在早期的研究中主要以来源雨桉树种子苗的下胚轴、子叶等有性材料作为外植体材料进行植株再生研究,赤桉(E. camaldulensis)、巨桉(E. grandis)、蓝桉(E.globulus)、尾叶桉(E. urophylla)等多个桉树的再生体系已经建立[3-5]。由于目前桉树种植和栽培已经无性系化,这些以有性材料为基础建立的再生体系难以进行真正的转基因育种。近年来,研究者逐渐开展了以桉树无性系的组培苗离体叶片或茎段为外植体进行再生体系建立研究,获得了巨桉EG5、尾赤桉(E. urophylla×E. camaldulensis)DH201-2、尾巨桉(E. urophylla×E. grandis)DH3229等无性系的再生体系[6-9],为桉树进一步的转基因育种奠定基础。尽管如此,以尾细桉叶片或茎段为外植体的再生体系尚未建立。
尾细桉(Eucalyptus urophylla×E. tereticornis)是尾叶桉与细叶桉的杂交种,综合了父本和母本的优良速生、制浆得率高、抗风能力强等优点。广泛种植于广东、广西、海南、福建等省区,经国营雷州林业局多年生长测定已成为台风多发地区造林首选树种[10]。目前尾细桉的组织培养体系和扦插体系已完全建立[11-12],但尾细桉的叶片离体再生研究尚未开展。噻二唑苯基脲(thidiazuron, TDZ)作为一种植物生长调节剂,有很强的细胞分裂素活性,在包括桉树等多个植物再生研究中发现其具有较强的诱导再生能力[13-15]。本研究选择TDZ对多个无性系进行叶片再生诱导研究,以期建立起尾细桉的再生体系,为尾细桉的转基因研究奠定基础。
1 材料和方法
1.1 材料
9个尾细桉无性系母本来源于印度尼西亚的MT Egon,父本来源于澳大利亚的40K N Gladstone,QLD,由中国林业科学研究院热带林业研究所进行杂交获得。试验所用材料全部采用在生根培养基上生根培养25~30 d的无菌生根苗,选取完全展开的叶片作为外植体进行再生研究。
1.2 方法
1.2.1 再生诱导培养基和培养条件
再生诱导培养基以改良的MS培养基加入0.20 mg/L的6-BA为基本培养基;在所有的培养基中分别加入7.0 g/L的琼脂和30.0 g/L的蔗糖。光照时间为16 h/8 h, 光照强度为1 500~2 000 lx, 培养温度为(25±2)℃左右。
1.2.2 实验设计
在再生诱导基本培养基上分别添加0.000、0.005、0.010、0.050、0.100、0.200 mg/L的TDZ(Thidiazuran),每个处理有40~60个叶片外植体,重复3次。
诱导的不定芽转移到不定芽伸长培养基中进行芽伸长培养,15~20 d转接1次。选择2~3 cm的不定芽转接到生根培养基中进行生根诱导培养。
1.2 数据统计与分析
外植体在培养基上培养45 d后,调查愈伤组织诱导率、芽再生率、平均再生率、平均再生芽数、芽状态、愈伤组织大小和愈伤颜色等指标。其中愈伤组织的大小分为4种:愈伤组织的直径不超过叶片切面直径2倍的为1;2~4倍时为2;4~10倍以上的为3;超过10倍以上的为4。 愈伤组织诱导率(%)=产生愈伤组织的外植体数/总外植体数×100%;芽再生率(%)=产生芽的外植体数/总外植体数×100%;平均再生率为一个无性系所有处理下的再生率;平均再生芽数=外植体不定芽总数/产生不定芽外植体个数。数据分析采用SPSS18.0进行分析,显著性分析采用LSD法,α≤0.05为显著性差异。
2 结果与分析
2.1 不同无性系叶片再生差异
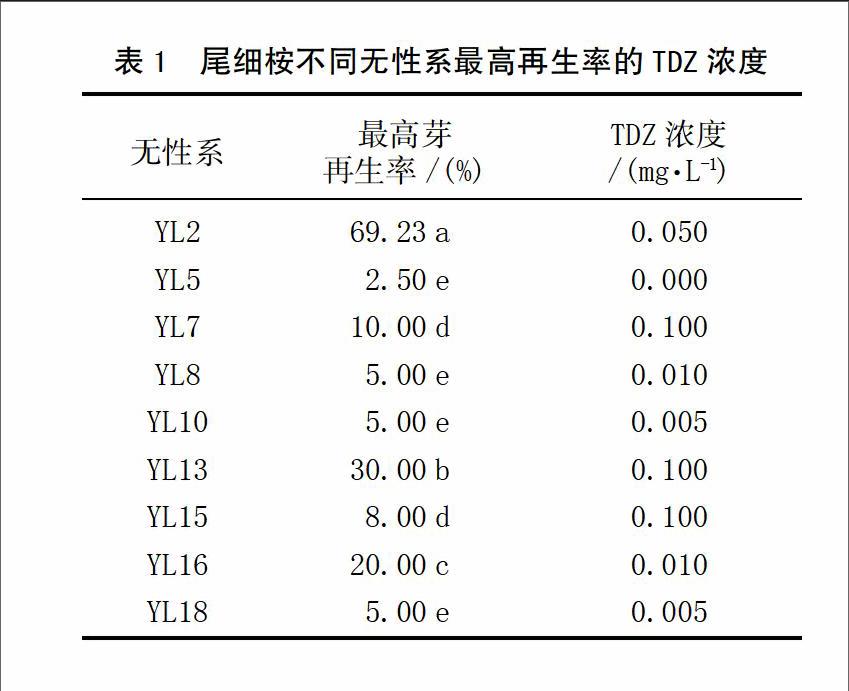
通过对尾细桉9个无性系进行叶片再生诱导,对所有处理的平均芽再生率和愈伤组织再生率等进行统计。结果表明:不同的无性系之间的芽再生率存在着显著性差异,其中YL2、YL16在不同浓度的TDZ诱导下均能够再生出芽,其平均再生率超过10.0%,其中无性系YL2的平均再生率达到33.2%(如图1),其他大多数无性系植株再生诱导率均低于10.0%,其中无性系YL5在所有的处理中没有得到或极少得到再生植株。通过对不同无性系的愈伤组织调查发现,在所有的无性系中都获得了较高的愈伤组织诱导率,除偶尔个别叶片出现死亡没有愈伤组织出现外,几乎所有的叶片都能够诱导出愈伤组织,但不同无性系愈伤组织形态和颜色均出现较大差异,如YL2、YL13、YL16诱导的愈伤组织较致密且呈现出黄绿色,个别出现红黄色。而YL5、YL7诱导的愈伤组织松散,在早期是灰白色,且容易发生褐变。这些说明再生率与愈伤组织形态和愈伤组织颜色有一定的关系。
2.2 不同TDZ浓度对叶片再生影响
通过对不同TDZ浓度对尾细桉无性系再生诱导发现,除了YL5,不同浓度的TDZ的添加都能促进尾细桉的叶片再生。在不同的无性系之间,TDZ对芽再生率呈现出显著性差异。TDZ浓度为0.005 mg/L时,YL10、YL18获得5.0%的再生率;添加0.010 mg/L TDZ时,YL8、YL16分别得到5.0%和20.0%的再生率;而YL2在0.050 mg/L时得到最高69.23%的芽再生率;对于无性系YL7、YL13、YL15,TDZ浓度在0.100 mg/L时,获得较高的芽再生率,见表1。除此之外,TDZ浓度在0.200 mg/L时,所有的尾细桉无性系芽再生率较低甚至无法再生,且愈伤组织状态松散,颜色呈灰白色,部分愈伤组织还出现玻璃化和褐变。这些结果说明对于尾细桉再生诱导中TDZ浓度不宜超过0.200 mg/L。尽管在所有的尾细桉无性系中都得到不同比例的植株再生诱导,但几乎大多数尾细桉的再生效率低于30.0%。
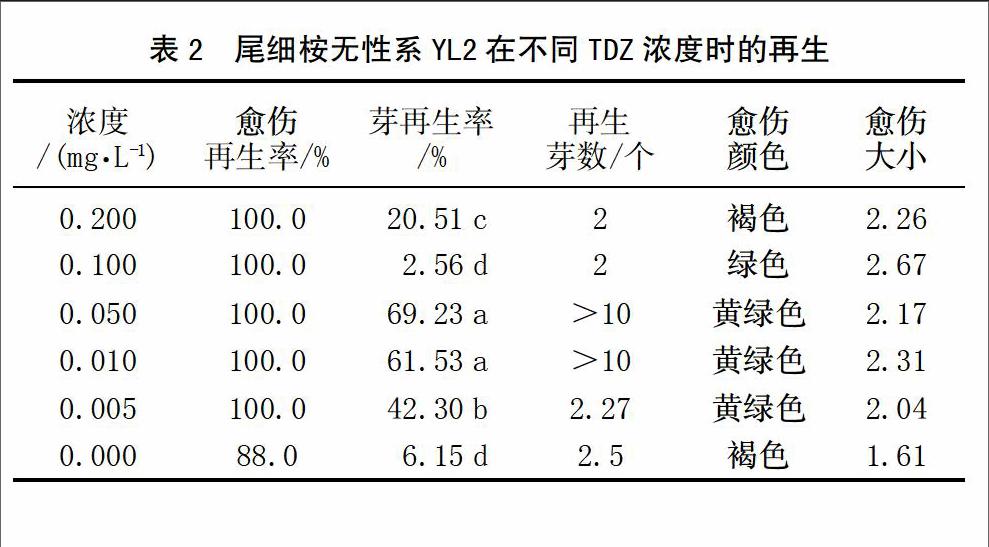
在9个尾细桉无性系中,YL2无性系获得了最高的芽再生率,因此对YL2不同TDZ浓度下芽再生率、再生芽数、愈伤组织再生率、愈伤组织颜色、愈伤组织大小在进行进一步分析。不同TDZ浓度对芽再生率有显著影响,随着TDZ浓度的增加,芽再生率升高,在0.050 mg/L时达到最高诱导效率69.23%,同时发现在0.010和0.050 mg/L时愈伤组织的颜色呈现出黄绿色、愈伤致密,愈伤组织大小合适,且再生芽数较多,超过10个,且表现为多个再生位点。随着TDZ浓度的进一步增加,在0.100和0.200 mg/L时,愈伤组织开始出现褐化,且有玻璃化现象出现,同时芽再生率和再生芽数也明显减少。这些结果说明YL2叶片诱导再生时合适的TDZ浓度是0.010~0.050 mg/L,见表2。
2.3 YL2再生植株的伸长和生根诱导
将带有多个芽点的愈伤组织转移到再生植株伸长培养基上,芽苗生长状态良好,20 d后大量的芽苗抽高。切取2~3 cm的芽转移到生根培养基中,14 d后获得了85%以上的生根率,且生根苗生长状态良好。
3 讨论与结论
本研究选取多个无性系以TDZ为主要激素进行再生研究,在所有的无性系中,只有YL2在0.050 mg/L的TDZ中获得了69.23%的再生率,而其他8个无性系再生率都在30.0%以下,证实了尾细桉的再生诱导存在着低再生率的问题。同时这些无性系的低再生率无法满足接下来的尾细桉转基因研究,需要进一步调整培养基或者外植体的生长状态如生根时间等。同时也间接说明基因型对植株再生的影响,这在杨树等木本植物中都得到了证实[16-17]。
TDZ作为一种有效的植株诱导再生植物生长调节剂,广泛应用于桉树不同种以及其他物种的叶片外植体诱导植株再生[9-11]。在已建立的桉树无性系再生体系中,大多都是以TDZ等为主要诱导激素对叶片或茎段进行植株再生诱导建立离体培养再生体系[4-5]。笔者在研究中曾使用KT和6BA作为主要的再生诱导激素进行再生植株诱导,除了偶尔有个别芽再生外,大多数处理不能诱导出再生植株,以TDZ作为再生激素诱导时获得了较多的再生植株,证实了TDZ在桉树叶片诱导芽再生体系建立中起着重要的作用。尽管如此,在尾细桉不同的无性系中的试验表明,只有YL2无性系获得了较高的再生率,说明TDZ并不是对所有的无性系起作用。在以巨桉和尾叶桉的杂种桉树中发现,分别以噻唑基脲类新型分裂素(N-phenyl-N'-[6-(2-chlorobenzothiazol)-yl]urea,PBU)和吡效隆(1-(2-chloro-4-pyridyl)-3-phenylurea,CPPU)为主要的再生诱导生长调节剂获得了91.3%和83.42%的再生诱导率[9,18]。因此,在下一步研究中,需要采用PBU或CPPU单独或与TDZ结合进行叶片再生诱导试验,研究其对尾细桉再生的影响。同时提示研究者在难以再生或低再生率的桉树品种或无性系时,应考虑PBU或CPPU等其他生长调节剂,可能获得更好的效果。
致 谢 中国林业科学研究院热带林业研究所甘四明研究员为本实验提供了实验材料和并且对实验方案提出宝贵的意见,在此特别感谢。
参考文献
[1] 谢耀坚.中国桉树育种研究进展及宏观策略[J]. 世界林业研究,2011,24(4):50-54.
[2] 施季森.迎接 21 世纪现代林木生物技术育种的挑战[J]. 南京林业大学学报,2000,2(1):1-6.
[3] 范春节,曾炳山,裘珍飞,等.桉树转基因研究进展[J]. 浙江林业科技,2008,28(2):65-72.
[4] Matsunaga E, Nanto K, Oishi M, et al. Agrobacterium-mediated transformation of Eucalyptus globulus using explants with shoot apex with introduction of bacterial choline oxidase gene to enhance salt tolerance[J]. Plant Cell Reports, 2012, 31(1):225-235.
[5] Ahad A, Maqbool A, Malik K A. Optimization of agrobacterium tumefaciens mediated transformation in Eucalyptus camaldulensis[J]. Pakistan Journal of Botany, 2014, 46(2):735-740.
[6] 邓 艺,曾炳山,刘 英,等. 巨桉无性系 EG5 叶片高效再生体系的建立[J]. 林业科学研究,2012,25(3):394-399.
[7] 裘珍飞,曾炳山,李湘阳,等. 4 个桉树无性系愈伤诱导和分化[J]. 林业科学研究,2012,25(4):531-534.
[8] 范春节,曾炳山,裘珍飞,等. 尾赤桉叶片及茎段的离体培养与植株再生[J]. 福建林学院学报,2009,29(1):74-78.
[9] 孙长斌,郭 棣,张兰英. 尾巨桉愈伤组织诱导与再生体系的建立[J]. 基因组学与应用生物学,2013,31(6):592-596.
[10] 彭仕尧,徐建民,李光友,等. 尾细桉无性系在雷州半岛的生长与遗传分析[J]. 中南林业科技大学学报,2013,33(4):23-27.
[11] 甘四明,李 梅,李发根,等.尾叶桉×细叶桉杂种无性系扦插生根和生长性状的研究[J]. 林业科学研究,2006,19(2):135-140.
[12] 刘奕清,王大平. 尾细桉的组织培养和快速繁殖[J]. 西南农业大学学报,2005,27(2):237-239.
[13] Roy A, Sajeev S, Pattanayak A, et al.TDZ induced micropropagation in Cymbidium giganteum Wall. Ex Lindl. and assessment of genetic variation in the regenerated plants[J]. Plant Growth Regulation,2012, 68(3): 435-445.
[14] Bettencourt G, Oliveira C, Buss S, et al. In vitro organogenesis of Eucalyptus urophylla×E. grandis in three culture media[C].Guarujá:Congresso Brasileiro de Biotechnologia,2013.
[15] Degenhardt-Goldbach J, Quoirin M, Buss S, et al. In vitro shoot organogenesis from Eucalyptus sp. leaf explants[J].Bio Med Central Ltd, 2011, (5): 134.
[16] 崔旭东,苏晓华,张冰玉,等. 欧美杨渤丰1号高效组培再生体系建立[J]. 林业科学研究,2012,25(2):157-162.
[17] 沈周高,项 艳,蔡 诚,等. 3个杨树品种叶片再生体系的建立[J]. 中国农学通报,2006,22(11):90-96.
[18] Ouyang L, Huang Z, Zhao L, et al. Efficient regeneration of Eucalyptus urophylla×Eucalyptus grandis from stem segment. Brazilian Archives of Biology and Technology, 2012, 55(3): 329-334.
