水稻黄色突变体的生理特性研究
2015-10-14余海洋张宇王萌
余海洋++张宇++王萌


摘 要 为了探明水稻营养生长阶段的衰老机制,鉴定了一个在抽穗期前多数叶片逐渐死亡的黄色水稻突变体。黄色衰老突变体表型特征为在分蘖期后,其绿色叶片基部随机出现斑点,并逐渐扩散至整个叶片。与之相反,野生型叶片在整个分蘖期均保持绿色。超微结构分析发现,水稻突变体叶片叶绿体类囊体膜和其他细胞器结构在不同衰老时期破裂,严重时导致细胞质皱缩。在叶片衰老过程中,突变体叶片光合活性、叶绿素含量和抗氧化酶活性发生不可逆转的下降。
关键词 水稻 ;衰老 ;生理特性 ;超微结构 ;抗氧化酶
分类号 Q945.45
Physiological Characterizations of a Yellow Mutant
of Rice Oryza sativa L.
YU Haiyang ZHANG Yu WANG Meng
(Environment and Plant Protection College,Hainan University, Haikou, Hainan 570228,China)
Abstract In order to senescent mechanisms in vegetative stages of rice, a yellow senescent mutant of rice (Oryza sativa L.) with progressing death in most of leaves before heading stage was characterized. Its characterization were: at tillering stage, the spots were originally scattered randomly at the base of green leaves in the mutant. Then, the spots expanded to whole leaves which resulted in senescent phenotype with yellow colour. On the contrary, the leaves of wild type remained green at whole tillering stage. Ultrastructure observation in mutant leaves showed breakdown of chloroplast thylakoid membrane structures and other organelles, as well as condensation of the cytoplasm at severe senescent stage. The photosynthetic activities, chlorophyll (Chl) contents and antioxidative enzymes activities decreased irreversibly along with leaf senescent process.
Keywords rice ; senescence ; physiology ; ultrastructure ; antioxidative enzyme
正常的叶片衰老是由于植物组织和器官中营养分配引起的[1]。在叶片衰老过程中,细胞结构、生理代谢、基因表达和生理参数均发生显著变化。叶片衰老阻碍了碳同化作用,导致植物生长迟缓并降低产量[2]。在细胞结构方面,细胞膜蛋白和膜系统的降解会导致细胞质浓缩,呈现皱缩细胞结构。已经证明,叶片衰老过程与一系列生化过程相关,其中多数与光合作用器官的分解有关[3]。其中,叶绿体类囊体膜降解后,由于吸收的光能不能通过光合电子传递链转变成化学能,会导致活性氧的上升[4]。采用H2O2诱导植物衰老的实验证明了衰老与活性粒子之间的关系[5]。衰老是由于正常生理活性中产生的活性粒子不断累积所引起的。也有人认为,衰老是一个由病原菌、年龄、激素和编程的基因表达等多种因素导致的过程[6-8]。
在水稻生产过程中,用硅、水杨酸和抗坏血酸预处理会提高其生理活性并延缓衰老[9]。目前,已经发现水稻点状叶片和早衰症状是由内涵素相关接头蛋白复合体I基因SPL28引起的[10]。牵牛花花衰老与ERF转录因子有关[11]。此外,分子生物学和遗传学的发展又发现了许多衰老突变体,为研究叶片衰老发生和防御机制打下了基础[12-13]。水稻的生长可分为3个时期,营养生长(从萌发到穗分化)、生殖生长(穗分化到开花)和成熟期(开花到结实)。穗分化后期的衰老研究很多[14]。然而,营养生长期水稻衰老机制研究很少。本研究在海南省儋州市海南大学实验基地发现一个水稻早衰突变体,系统研究其生理变化规律,为研究水稻营养生长期衰老机制打下基础。
1 材料与方法
1.1 植物材料
水稻品种日本晴(WT)和衰老突变体(ysm)种植在海南大学环境与植物保护学院儋州试验基地(19°51′51N;109°55′63E)。砖红壤,生长期4~6月的月平均温度是30℃,平均降水量180 mm,平均湿度97.5%。水稻叶片分蘖后,选取10、20、30 d对照和突变体基部叶片中间段进行分析测定,取样时间为早上8点。
1.2 方法
1.2.1 电镜观察
采用透射电镜JEM1230(JOEL,Tokyo,Japan)对水稻叶片进行观测。将剪下来的基部叶片 材料剪碎后固定于3%戊二醛和0.1 mol/L(pH 7.2)磷酸缓冲液中4 h;冲洗后再固定于1%锇酸(pH 7.2)中4 h,用30%、50%、70%、80%、90%、100%丙酮系列脱水后用环氧树脂SPURR包埋-聚合。在LKB-V型切片机超薄切片后染色,最后在透射电子显微镜下观察、照相[15]。
1.2.2 叶片叶绿素和β-胡萝卜素的测定
采用80%的丙酮提取单位重量叶片色素,室温闭光放置48 h,中间要混匀多次。混匀后在5 000×g下离心5 min后,按照文献[16]中方法测定。
1.2.3 叶绿素荧光动力学参数的测定
水稻叶片的光诱导叶绿素荧光动力学参数的测定采用PAM-2500便携式荧光仪(Walz. Effeltrich. Germany)进行。
1.2.4 生理指标测定
脯氨酸、丙二醛等生理指标测定参考文献[17]。
1.2.5 统计分析
实验测定均为6次重复的平均值,数据统计和绘图用Origin 9.0科学绘图软件处理。
2 结果与分析
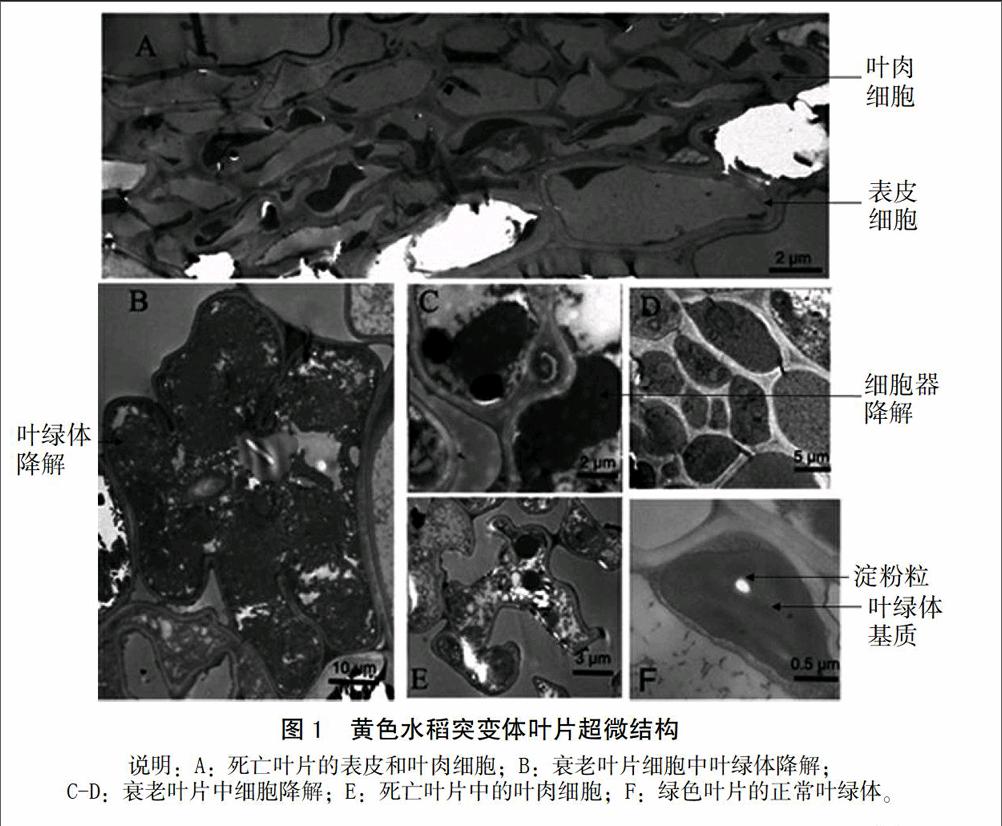
黄色早衰突变体表现为随着植株的生长,下部叶片先产生褐色斑点,但褐色斑点面积不随衰老程度增加,却引起水稻叶子不断变黄,进而枯萎,最终导致下部叶片逐渐死亡。这种死亡是阶段性的,总是保证每个分蘖冠层叶片维持生长。只有新生叶片长到一定程度时,该分蘖下部叶子才死亡。对黄衰突变体黄色斑点的保湿培养和镜检分析没有发现任何细菌和真菌的存在,这说明黄衰突变体不是由细菌浸染引起的。在褐色斑点刚出现,即DNA降解刚开始的时候 ,叶肉细胞的细胞质首先表现出松散,随后皱缩,引起细胞壁和细胞质的分离。叶绿体仍然保持完整,但开始肿胀。其内部的膜结构例如基质片层均已降解。 在叶片死后,衰老细胞中细胞质完全降解之后,但死亡细胞壁仍然保持完整(图1)。
从图2可以看出,水稻突变体分蘖后20和30 d 叶片单位鲜重的色素含量要显著低于绿叶。绿叶的Chl a、Chl b和β-Car的含量分别为1.55、0.53和0.37 mg/g叶片鲜重。与对照相比,突变体20 d和30 d水稻叶片的Chl a和Chl b分别下降了76.8%、92.3%和71.7%、83.1%。突变体20和30 d水稻叶片的β-car分别下降了64.9%和54.1%。色素分析表明,20和30 d叶片的Chl a、Chl b和总Chl含量均随着死亡的加剧呈现极显著的下降趋势,但由于Chl a降解比Chl b快,导致Chl a/b下降。这是植物死亡时的典型反应,即叶绿素酶活性增加,导致叶绿素降解。而β-car则是持续下降,说明衰老开始后,由于叶绿素含量的降低,不能有效地淬灭光能,但也无法采用β-car进行过剩激发能的淬灭。说明伴随着程序性死亡的加剧,突变体20和30 d水稻叶片的质膜叶绿体的膜脂结构均遭到破坏。
从图3可以看出,随着衰老程度的不断加剧,突变体20和30 d水稻叶片原初光化学效率(Fv/Fm)与对照相比分别下降了2.9%和15.9%,突变体20 d水稻叶片的电子传递速率(ETR),光化学淬灭系数(qP)和事实光化学效率(ΦPSII)与绿叶相比均有所提高,这与黄叶突变体的结果类似。30 d的电子传递速率(ETR),光化学淬灭系数(qP)和事实光化学效率(ΦPSII)与绿叶相比分别下降了36.6%、15.0%和36.4%,非光化学淬灭高于绿叶55.6%。
单位重量突变体20 d水稻叶片的SOD活性为绿叶的78.7%,脯氨酸含量为101.1%,MDA含量为103.0%,POD活性为142.5%,ABA含量584.2%。与氧化胁迫紧密相关的SOD活性下降21.3%,POD活性上升了42.5%,ABA则是显著提高(图4)。MDA是反映膜脂过氧化程度的指标,它和脯氨酸不变表明黄叶的膜脂系统在初期没有遭到破坏。黄衰突变体的SOD含量显著下降,说明其抗光氧化能力下降。ABA含量显著上升说明其通过启动ABA信号转到途径导致进一步衰老和死亡。
3 讨论
衰老可以在植物发育的时期自发发生,也可以非生物胁迫如缺氧诱导,或是植物与病原菌侵染诱导产生[2,18-19]。前人研究表明,水稻叶片从完全展开到衰老过程其叶绿素含量和光合活性均呈现下降趋势[20]。水稻旗叶衰老过程中叶绿素含量,叶黄素和荧光发射强度均呈下降趋势,PSI蛋白和PSII蛋白的降解模式略有不同,主要是反应中心蛋白复合体的降解[21-22]。叶绿素a和叶绿素b含量的大量减少是不可逆的死亡标志。有人认为,功能叶绿体在防止植物细胞死亡过程中具有重要作用。本研究发现,黄色水稻突变体不同时期叶片的最大光化学效率(Fv/Fm)的直线下降表明光能对其光系统的伤害有增加的趋势,这与叶绿体降解的结果一致。此外,不同衰老程度的叶片非光化学淬灭(NPQ)具有增加的趋势。黄色水稻突变体中qN增加表明低的ΦPSII值是由于对水解产生电子利用率降低,以及将更多的光能分配给非光化学淬灭路径。光化学淬灭表明了PSII受体侧的氧化还原状态,它是由PSII受体光还原速率和其与通过PSI相耦联的CO2再氧化速率相关。光化学淬灭也用来估计还原态QA的比例,这反映了对PSII激发能的压力。黄色水稻突变体早期黄色叶片qP的增加是一种对叶绿素减少的补偿效应。PSII最大光化学效率(Fv/Fm),又称为原初光化学最大效率或PSII光化学反应的潜在效率,通常它反映了完整植物叶片光合器官的生理状态。黄叶和枯叶原初光化学最大效率的下降说明了随着衰老的加剧,光合系统结构不断遭到破坏。qP是反映PSII激发能和电子传递之间平衡的参数,NPQ是反映与光化学相竞争的包括热耗散等能量淬灭的总称。以上结果说明黄色水稻突变体的黄叶和枯叶分配给PSII,用于光化学反应的激发能要显著低于绿色叶片分配光化学反应的光能,并造成非光化学淬灭的显著增加。
衰老是指植物营养和生殖生长的最后阶段,发生在细胞和器官的大量死亡之前。衰老已经被证明是可以由乙烯诱导的,需要核基因的参与,并与O2-和H2O2产量的增加有关[23-24]。最近发现H2O2和激素ABA在衰老中具有很大的作用。活性氧物质的产生激发了信号网络产生,引起包括胁迫耐受性,积累和细胞死亡等几个结果。过氧化物酶(POD)和超氧化物歧化酶(SOD)最先响应活性氧分子[25-28],它们的活性和数量的变化被认为是植物受到胁迫后氧化还原状态的指标。丙二醛是脂类过氧化的产物,反映了脂过氧化的程度,是一个脂类过氧化指标。活性氧物质和ABA含量被证明在胁迫反应中呈正相关趋势[29-30]。本研究结果表明,丙二醛含量、POD酶活性和ABA含量在黄色水稻叶片中大量增加。因此,推测黄色衰老突变体是由于光氧化过程的降解引起的,与活性氧代谢相关。 但其分子机制仍需进一步研究。
参考文献
[1] Zhang K, Xia X, Zhang Y, et al. An ABA‐regulated and golgi-localized protein phosphatase controls water loss during leaf senescence in Arabidopsis[J]. Plant J, 2012, 69(4): 667-678.
[2] Im Kim J, Murphy A S, Baek D, et al. YUCCA6 over-expression demonstrates auxin function in delaying leaf senescence in Arabidopsis thaliana[J]. J Exp Bot, 2011, 62(11): 3 981-3 992.
[3] Akhtar M S, Goldschmidt E E, John I, et al. Altered patterns of senescence and ripening in gf, a stay-green mutant of tomato (Lycopersicon esculentum Mill.)[J]. J Exp Bot, 1999, 50(336): 1 115-1 122.
[4] Pisciotta J M, Zou Y, Baskakov I V. Role of the photosynthetic electron transfer chain in electrogenic activity of Cyanobacteria[J]. App Microbiol Biotechnol, 2011, 91(2): 377-385.
[5] Beckman K B, Ames, B N. The free radical theory of aging matures[J]. Physiol Rev, 1998, 78(2): 547-581.
[6] Chou C M, Kao C H. Methyl jasmonate, calcium, and leaf senescence in rice[J]. Plant Physiol, 1992, 99(4): 1 693-1 694.
[7] Kao C H, Yang S F. Role of ethylene in the senescence of detached rice leaves[J]. Plant Physiol, 1983, 73(4): 881-885.
[8] Mishra D, Pradhan P. Regulation of senescence in detached rice leaves by light, benzimidazole and kinetin[J]. Exp Gerontol, 1973, 8(3): 153-155.
[9] Anwar S, Iqbal M, Raza S H, et al. Efficacy of seed preconditioning with salicylic and ascorbic acid in increasing vigor of rice (Oryza sativa L.) seedling[J]. Pak J Bot, 2013, 45(1): 157-162.
[10] Qiao Y, Jiang W, Lee J, et al. SPL28 encodes a clathrin-associated adaptor protein complex 1, medium Subunit μ1 (AP1M1) and is responsible for spotted leaf and early senescence in rice (Oryza sativa)[J]. New Phytol, 2010, 185(1): 258-274.
[11] Liu J, Li J, Wang H, et al. Identification and expression analysis of ERF transcription factor genes in petunia during flower senescence and in response to hormone treatments[J]. J Exp Bot, 2011, 62(2): 825-840.
[12] Liu X, Li Z, Jiang Z, et al. LSD: a leaf senescence database[J]. Nucl Acids Res, 2011, 39(S1):1 103-1 107.
[13] Xiao S, Dai L, Liu F, et al. COS1: an Arabidopsis coronatine insensitive1 suppressor essential for regulation of jasmonate-mediated plant defense and senescence[J]. Plant Cell, 2004, 16(5): 1 132-1 142.
[14] Tang Y, Wen X, Lu C. Differential changes in degradation of chlorophyll-protein complexes of Photosystem I and Photosystem II during flag leaf senescence of rice[J]. Plant Physiol Biochem, 2005, 43(2): 193-201.
[15] Wang L F, Ji H B, Bai K Z, et al. Photosystem 2 activities of hyper-accumulator Dicranopteris dichotoma Bernh from a light rare earth elements mine[J]. Photosynthetica, 2006, 44: 202-207.
[16] Wang L F, Ji H B, Bai K Z, et al. Photosynthetic characterization of the plant Dicranopteris dichotoma Bernh. in a rare earth elements mine[J]. J Integr Plant Biol, 2005, 47 (9): 1 092-1 100.
[17] 李合生. 植物生理生化试验原理和技术[M]. 北京: 高等教育出版社,2000:167-168.
[18] Notteghem J, Silue D. Distribution of the mating type alleles in Magnaporthe grisea populations pathogenic on rice[J]. Phytopathol, 1992, 82(4): 421-424.
[19] Kimura I. Improved purification of rice dwarf virus by the use of polyethylene glycol[J]. Phytopathol, 1976, 66: 1 470-1 474.
[20] Hoetensteiner S. Chlorophyll degradation during senescence[J]. Ann Rev Plant Biol, 2006, 57: 55-77.
[21] Yoshida S. Molecular regulation of leaf senescence[J]. Curr Opin Plant Biol, 2003, 6(1): 79-84.
[22] Wang L F, Chen Y Y. Photosynthetic characterization at different senescence stages in an early senescence mutant of rice Oryza sativa L.[J]. Photosynthetica, 2011, 49(1): 140-144.
[23] Apel K, Hirt H. Reactive oxygen species: metabolism, oxidative stress, and signal transduction[J]. Ann Rev Plant Biol, 2004, 55: 373-399.
[24] Thomas H, Ougham H J, Wagstaff C, et al. Defining senescence and death[J]. J Exp Bot, 2003, 54(385): 1 127-1 132.
[25] Alscher R G, Erturk N, Heath L S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants[J]. J Exp Bot, 2002, 53(372): 1 331-1 341.
[26] Chia L S, Thompson J E, Dumbroff E B. Simulation of the effects of leaf senescence on membranes by treatment with paraquat[J]. Plant Physiol, 1981, 67(3): 415-420.
[27] Halevy A, Mayak S, Tirosh T, et al. Opposing effects of abscisic acid on senescence of rose flowers[J]. Plant Cell Physiol, 1974, 15(5): 813-821.
[28] Hung K T, Kao C H. Hydrogen peroxide is necessary for abscisic acid-induced senescence of rice leaves [J]. J Plant Physiol, 2004, 161(12): 1 347-1 357.
[29] Yang J, Zhang J, Wang Z, et al. Abscisic acid and cytokinins in the root exudates and leaves and their relationship to senescence and remobilization of carbon reserves in rice subjected to water stress during grain filling [J]. Planta, 2002, 215(4): 645-652.
[30] Yang S D, Seo P J, Yoon H K, et al. The arabidopsis NAC transcription factor VNI2 integrates abscisic acid signals into leaf senescence via the COR/RD genes[J]. Plant cell, 2011, 23(6): 2 155-2 168.
