不同低温胁迫下葡萄枝条抗寒生理指标的分析
2015-10-13肖东明等
肖东明等

摘要:为了探究低温胁迫对葡萄(Vitis L.)枝条相关生理指标的影响,试验以抗寒山葡萄左优红(V. amurensis Rupr. cv. Zuoyouhong)与不抗寒欧洲葡萄赤霞珠(V. vinifera L.cv. Cabernet Sauvignon)枝条为试材,比较了不同温度(25、5、-5、-15 ℃)对葡萄枝条内超氧化物歧化酶、过氧化物酶与谷胱甘肽过氧化物酶活性以及总酚、木质素与纤维素含量的影响。结果表明,随着处理温度的降低,枝条中的超氧化物歧化酶、过氧化物酶活性均呈现先上升后下降的变化趋势;总酚含量呈逐步减少的趋势,且2种葡萄之间存在差异;纤维素含量呈先上升后下降的趋势,与超氧化物歧化酶变化规律基本一致,木质素含量变化无明显规律,谷胱甘肽过氧化物酶经过低温处理后酶活性得到明显提高。
关键词:葡萄(Vitis L.);枝条;温度;抗寒力;生理指标
中图分类号:S663.1;Q944.55;Q948.112+.2 文献标识码:A 文章编号:0439-8114(2015)18-4509-05
DOI:10.14088/j.cnki.issn0439-8114.2015.18.030
葡萄(Vitis L.)是全球重要的果树种类之一,主要分布于北纬30°~50°区间,被广泛用于酿酒、制汁、制干与鲜食。中国的葡萄产区主要集中在北方地区,低温冷害是北方葡萄生产中存在的主要问题,发生冻害的树体需要一年或者多年才能恢复,严重的甚至导致树体死亡,造成产量和品质的波动,致使生产者蒙受经济损失[1]。宁夏回族自治区葡萄产区作为全国最大的酿酒葡萄产地,其酿酒葡萄面积高达3万hm2。该地区昼夜温差大,光照充足,葡萄产量高、品质好,在中国葡萄产地中具有独特的优势;但是当地的严寒气候是制约鲜食葡萄及酿酒葡萄大规模生产的重要限制因子。在葡萄的生长过程中,防止葡萄在低温气候中发生冻害是葡萄种植中最关键的一步。目前,宁夏葡萄产区越冬防寒的主要措施是采用埋土来防寒,尽管这样做取得了一定的效果,但是冬季埋土防寒、春季出土上架造成了劳动力与财力的大量消耗,不仅增加了果农的生产成本,并且在一定程度上破坏了葡萄园的生态环境。
因此,有必要对葡萄自身的抗寒性能进行系统深入研究。国内外有关葡萄抗寒性的研究已有很多报道,在低温胁迫下,葡萄体内的渗透调节物质、保护酶活性、丙二醛、脯氨酸等生理生化产物均会产生变化,并被作为葡萄抗寒性鉴定的筛选指标。试验以不抗寒的欧洲酿酒葡萄品种赤霞珠(V. vinifera L.cv. Cabernet Sauvignon)与抗寒山葡萄品种左优红(V. amurensis Rupr. cv. Zuoyouhong)为研究对象,通过模拟不同低温胁迫条件,测定一年生葡萄枝条的有关抗寒生理指标,包括总酚、木质素、纤维素含量以及超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)的活性,旨在比较分析低温胁迫下葡萄枝条相关抗寒生理指标的变化规律,了解这些调节物质与抗寒性的关系,从而探索它们与低温胁迫、抗寒能力的相关性,并对葡萄抗寒性鉴定的生理生化指标进行筛选,同时为培养葡萄抗寒新品种提供理论依据。
1 材料与方法
1.1 材料
1.1.1 植物材料 试验在宁夏大学葡萄与葡萄酒工程研究中心玉泉营实验基地进行采样,该地位于北纬38°12′,东经105°99′;参试的赤霞珠和左优红植株都为定植于园内的五年生成年树。在2013年9月3日进行采样,从生长势一致的植株上收集一年生枝条,从基部第六节开始,每株剪取长40~50 cm、粗0.9~1.1 cm的枝条若干,剪取后用自来水、蒸馏水先后冲洗数次,用洁净的纱布擦干,两端封蜡,塑封后置于冰盒带回实验室。
1.1.2 试剂 试剂主要有福林肖卡溶液、饱和碳酸钠、磷酸缓冲液、重铬酸钾、愈创木酚、甲基氨酸、氮蓝四唑、核黄素、乙二胺四乙酸、乙醇、酸性茚三酮、冰醋酸、浓硫酸、硝酸、盐酸、双氧水、偏磷酸、丙酮、乙醚、硫代硫酸钠、碘化钾、磺基水杨酸等。
1.2 处理
在宁夏大学葡萄与葡萄酒工程研究中心实验室将样枝用蒸馏水冲洗干净,均匀分为4份,其中3份分别在-15、-5、5 ℃的冰箱中进行冷冻(藏)处理。降温至设定温度后持续24 h,之后将-5、-15 ℃处理的样品统一放置在5 ℃环境中解冻4 h;另外1 份作为对照,在室温(25 ℃)下放置24 h;然后选取不同处理的枝条进行相关指标测定。
1.3 抗寒生理指标测定
将参试样品分为两部分,其中一部分枝条放置于通风口处使其自然脱水,直至枝条干重不再发生变化,用组织破碎机粉碎,得到的粉末状物过40 mm筛后,低温储存备用。另外一部分葡萄枝条用蒸馏水冲洗干净,避开芽眼,剪成薄片,混合均匀,取材料2.0 g切碎,放入研钵中,加适量的磷酸缓冲液冰浴研磨成匀浆,低温离心之后,取上清液测定有关生理指标。总酚含量采用福林肖卡法[2-4]测定,纤维素含量采用硫酸与重铬酸钾氧化法测定[5],木质素含量采用醋酸分离与硫酸水解法测定[6],POD活性采用愈创木酚法测定[7],SOD活性采用氮蓝四唑法测定[7],GSH-Px活性采用DTNB法测定[8]。
1.4 数据分析
试验所得数据采用Microsoft Office Excel 2003软件进行处理和绘图,采用DPS 7.05统计分析软件进行数据分析与差异显著性比较。
2 结果与分析
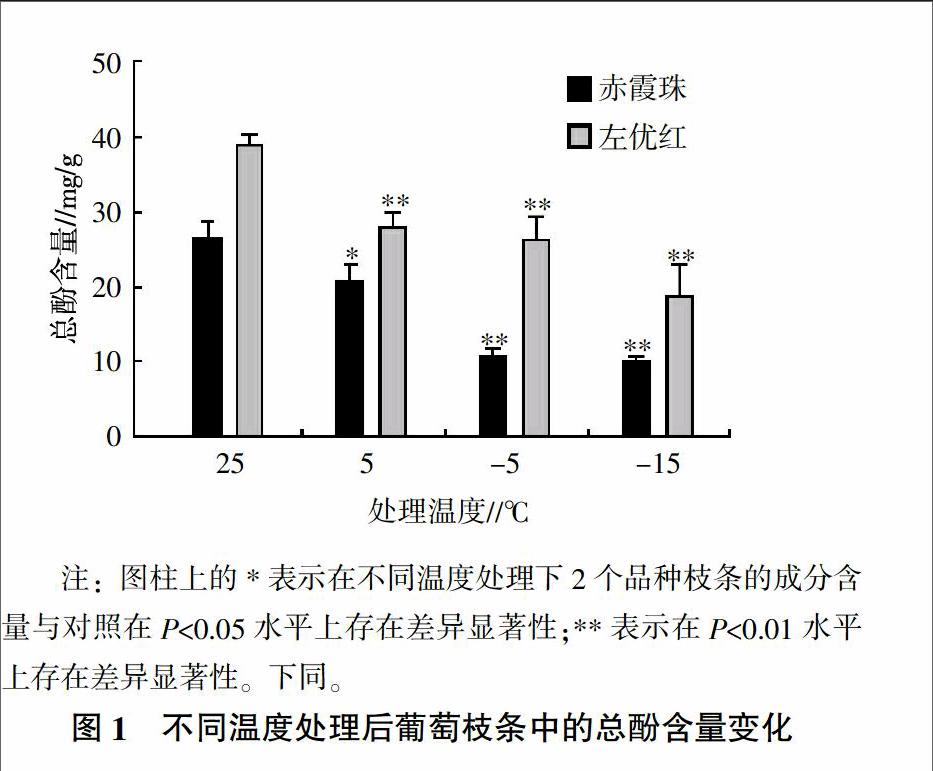
2.1 低温处理对不同葡萄品种枝条总酚含量的影响
植物体内的酚类物质是一类天然的自由基清除剂,具有很强的抗氧化活性;在严寒恶劣的环境里,这些酚含量会增加,以抵御或减少低温胁迫使植物体内所产生的自由基和活性氧对植物组织的伤害[9]。试验测定的低温处理对不同葡萄品种枝条总酚含量的影响情况见图1。从图1可见,低温胁迫明显抑制了葡萄枝条内可溶性总酚物质的积累,随着低温胁迫强度的加大,2个品种的可溶性总酚含量呈现出逐步降低的变化趋势,在常温对照中,赤霞珠与左优红枝条内的总酚含量达到最高值,分别为26.60、38.94 mg/g,随后一路下降,且在-15 ℃的低温胁迫下达到最低值,此时2个品种与常温处理相比,枝条内的总酚含量都降低了50%以上,并且2个品种在5、-5、-15 ℃处理后的总酚含量与对照相比多数处理差异极显著(P<0.01),只有赤霞珠在5 ℃处理后的可溶性总酚含量与对照相比差异显著(P<0.05)。通过以上数据可以看出,外界温度对葡萄植株体内总酚含量的影响还是较为明显的,而且品种之间存在差异,左优红的可溶性总酚含量一直高于赤霞珠。
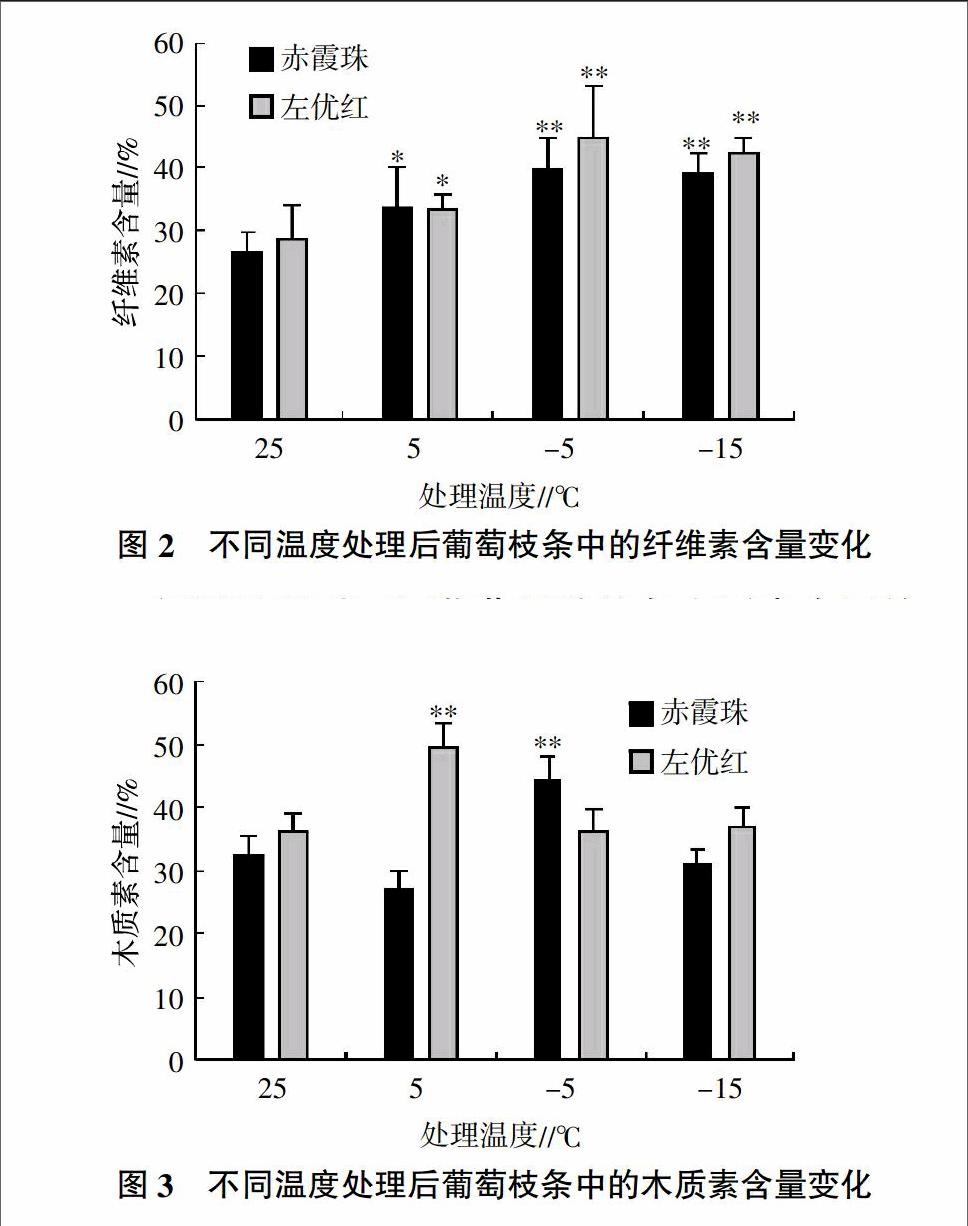
2.2 低温处理对不同葡萄品种枝条纤维素含量的影响
试验测定的低温处理对不同葡萄品种枝条纤维素含量的影响情况见图2。从图2可见,赤霞珠与左优红枝条的纤维素含量均表现先上升、后下降的变化趋势,并在-5 ℃处理后达到高值(-15 ℃处理后稍有回落),其纤维素含量分别从常温处理的26.43%、27.19%升至-5 ℃处理的40.81%、43.73%。其中赤霞珠、左优红在5 ℃处理后枝条纤维素含量与对照相比差异显著(P<0.05),而2个品种在-5、-15 ℃处理后枝条纤维素含量与对照相比差异极显著(P<0.01)。
2.3 低温处理对不同葡萄品种枝条木质素含量的影响
在低温胁迫环境下,植物体内的酚类物质会有所增加,同时这些酚类物质随后会在细胞壁中转化成为木质素或木栓质[9]。试验测定的低温处理对不同葡萄品种枝条木质素含量的影响情况见图3。从图3可见,低温处理后,赤霞珠的枝条木质素含量与对照相比,起伏较大,其在-5 ℃处理后枝条木质素含量达到高点(43.28%),此时高于对照,与对照相比差异极显著(P<0.01),但在5、-15 ℃处理后木质素含量都明显低于对照。而左优红的枝条木质素含量在低温处理后都比对照高,其中在5 ℃处理后枝条木质素含量达到高点(48.19%),与对照相比差异极显著(P<0.01)。
2.4 低温处理对不同葡萄品种枝条POD活性的影响
试验测定的低温处理对不同葡萄品种枝条POD活性的影响情况见图4。从图4可见,低温处理后,2个品种枝条的POD活性均出现了先上升、后下降的变化趋势。其中赤霞珠的枝条在5 ℃处理后达到酶活性的最高点,为16.142 μg/g,与对照相比差异极显著(P<0.01);此后POD活性逐渐下降,与对照相比差异不显著(P>0.05)。左优红的枝条POD活性在5 ℃处理后达到酶活性高点,与对照相比差异极显著(P<0.01);在-5 ℃处理后酶活性下降,与对照相比差异显著(P<0.05);在-15 ℃处理后POD活性继续下降,与对照差异不显著(P>0.05)。
2.5 低温处理对不同葡萄品种枝条SOD活性的影响
试验测定的低温处理对不同葡萄品种枝条SOD活性的影响情况见图5。从图5可见,低温处理后,2个品种枝条的SOD活性总体呈现出先上升、后下降的变化趋势。在常温条件下,左优红的SOD活性高于赤霞珠。受到5 ℃低温胁迫后,赤霞珠的SOD活性快速提升,与对照差异极显著(P<0.01);而左优红提升的相对缓慢,与对照差异显著(P<0.05)。在-5 ℃处理后,赤霞珠与左优红的SOD活性都达到高值,分别为123.34、128.84 U/g,与对照差异极显著(P<0.01)。在-15 ℃处理后,赤霞珠与左优红的SOD活性都随之回落,但SOD活性仍维持在高于对照的水平,赤霞珠的酶活性与对照差异显著(P<0.05),左优红的酶活性与对照差异极显著(P<0.01),说明低温处理还是可以提高葡萄的抗寒性能的。
2.6 低温处理对不同葡萄品种枝条GSH-Px活性的影响
GSH-Px作为一种重要的抗氧化酶,能够清除植物体内的自由基,从而减缓植物在逆境胁迫中所受到的伤害。试验测定的低温处理对不同葡萄品种枝条GSH-Px活性的影响情况见图6。从图6可见,2个品种对照处理的GSH-Px活性相对较低,随着温度的降低,2个品种枝条中的GSH-Px活性表现出跨越式的提升。在5 ℃胁迫后赤霞珠与左优红的GSH-Px活性就达到高值,分别为18.56、17.81 kU/g,与对照相比差异极显著(P<0.01)。此后,在低温胁迫程度继续加剧的情况下,2个品种的GSH-Px活性出现少许回落,但维持在较高的水平,并仍然与比照差异极显著(P<0.01)。
3 小结与讨论
植物在逆境条件下能够通过调节体内一系列生理生化过程来提高对逆境的抵御能力,并且在一定强度的温度下,通过诱导植株细胞的代谢活动向着适应低温、增加抗寒性的方向发展。试验中,葡萄品种赤霞珠、左优红枝条的POD活性随着胁迫温度的降低呈现逐步降低的变化趋势,而SOD活性则是先上升、后下降,这与鲁金星等[8]的研究结果一致;与未经过低温处理的枝条(对照)相比,经过处理的枝条其SOD与POD的活性得到了一定的提升。在低温胁迫条件下,植物体内会超常积累活性氧自由基[10,11],而这些物质的积累加剧了膜脂过氧化,从而导致膜系统受损,最终破坏植物组织。在植物的保护酶系统中,SOD的作用是清除超氧自由基·O2-,同时产生歧化性产物H2O2;而POD的主要作用是酶促降解H2O2,使身处逆境胁迫下的植物能够对代谢过程产生的有害物质进行抵御,表现出一定的抗逆性[12],所以POD活性的高低体现了植物抗寒力的强弱[13]。低温诱导可使葡萄细胞内防御活性氧的酶促保护系统能力增强,从而维持细胞膜的稳定性,提高了葡萄的耐寒性。
酚类物质是一类作用很强的自由基清除剂,在严寒时节,酚含量增加可以消除低温使植物体内产生的自由基和活性氧对植物的伤害[14];试验里葡萄枝条中的总酚含量随着胁迫温度的降低而逐渐减少;但王丽雪等[15]、王静[16]在研究植物叶片后发现多酚物质会在温度逐渐降低的条件下大幅增加,并且半致死温度低,抗寒性强。本试验结果与之结论相悖,推测可能是由于枝条中的总酚转移到了叶片中所致;从理论上说,清除自由基和活性氧有助于提高植物的抗寒性,但酚类物质的结构复杂、种类繁多[14,17],具体哪种酚类物质在低温下起保护作用,是否能作为反映植物抗寒性的一个指标,还需要进一步试验论证。
低温胁迫下植物体内的酚类化合物合成加速,这些酚类物质随后会进入细胞壁间而转化为木质素[18]。国外学者认为木质化与软木质沉积物能够充当细胞壁之间的防水隔离层,从而增强植物抵御低温胁迫的能力[19]。本试验中,葡萄品种赤霞珠、左优红的枝条纤维素含量随着温度的降低呈现先上升、后下降的变化趋势;但木质素含量却呈现不同的变化。植物的抗寒性是由许多数量或质量遗传基因综合作用累加的结果,每一个与抗寒性有关的性状对木本植物的抗寒性都起一定的作用[16]。有研究表明,纤维素的合成与SOD、POD活性存在一定的相关性[20],试验也证明了这一点,纤维素的含量与SOD活性变化趋势基本一致。在低温胁迫环境下部分酶会出现响应,比如木质素代谢途径[21](咖啡酸3-O-甲基)出现变化,由此可以推断纤维素与木质素的合成会受到低温的影响。但木质素的合成是植物体内比较复杂的生化过程,存在多基因、多条代谢途径交互作用的结果,其中不乏抗寒基因表达途径的关联部分。
GSH(谷胱甘肽)作为一种重要的抗氧化剂,能够清除生物体内的自由基,从而减缓植物在逆境胁迫中所受到的伤害。而GSH-Px的作用就是将GSH转化为GSSG(GSH的氧化形态)。从试验结果可以看出,低温胁迫能明显诱导GSH-Px的活性,低温处理与对照相比,前者的GSH-Px活性明显高于后者。Logan等[19]将GR基因转入棉花(Gossypium hirsutum L.)内,在室内模拟条件下将温度由28 ℃降至14 ℃,使转基因棉花的GSH活性比野生型棉花高30~40倍,表明转基因棉花的抗逆境胁迫能力得到提高。康国章等[18]在自然低温环境下对小麦(Triticum aestivum L.)叶片的抗冻生理指标进行测定,得出了GSH在叶片中只是一种应激性物质,并不宜作为评价植株受冻程度的指标。目前,虽然认为GSH-Px在植物的逆境生理中发挥着很重要的作用,但仍存在争议。一种观点认为GSH-Px活性在逆境胁迫过程中的变化反映的是作物对逆境胁迫的积极适应性调节过程;另一种观点认为这种表现只是一种被动的受害症状。本研究初步探寻了低温胁迫与GSH-Px的关系,得到了它们之间的一些规律,但其内部作用机理还不很明晰,还需进一步研究。
参考文献:
[1] 李玉梅,陈艳秋,李 莉.梨品种枝条膜透性和水分状态与抗寒性的关系[J].北方果树,2005(1):3-5.
[2] 杨秀平,尉 芹,辛转霞,等.单宁提取与测定实验的改进[J].科教文汇,2007(2):26-30.
[3] 高 园,房玉林,张 昂,等.葡萄枝条中多酚类物质的超声波辅助提取[J].西北农林科技大学学报(自然科学版),2009,37(9):77-82.
[4] 汪成东,张振文,宋士任.葡萄多酚物质提取方法的研究[J].西北植物学报,2004,24(11):2131-2135.
[5] 王金主,王元秀,李 峰,等.玉米秸秆中纤维素、半纤维素和木质素的测定[J].山东食品发酵,2010(3):44-47.
[6] 郝建军,康宗利,于 洋.植物生理实验技术[M].北京:化学工业出版社,2006.101-178.
[7] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000.163-165.
[8] 鲁金星,姜寒玉,李 维.低温胁迫对砧木及酿酒葡萄枝条抗寒性的影响[J].果树学报,2012,29(6):1040-1046.
[9] GRIFFITH M,YAISH M W. Antifreeze proteins in overwintering plants:A tale of two activities[J]. Trends Plant Sci,2004, 9(8):399-405.
[10] 李美如,刘鸿先,王以柔.细胞氧化应激机制与植物抗冷性机理的研究[J].生命科学,1996(4):1-6.
[11] WISE R R,NAYLOR A W. Chilling-enhanced photooxidation evidence for the role of singlet oxygen and superoxide in thebreakdown of pigments and endogenous antioxidants[J].Plant Physiol, 1987, 83: 278-282.
[12] 曾超西,王以桑.水稻幼苗的低温伤害与膜脂过氧化[J].植物学报,1997,29(5):506-512.
[13] LEE E H, BENNETT J H. Superoxide dismutase:A possible protective enzyme agaist ozone injury in snapbeans (Phaseolus vulgaris L.)[J]. Plant Physiology,1982,69(6):1444-1449.
[14] JANSKA A, MARSIK P, ZELENKOVA S, et al. Cold stress and acclimation-what is important for metabolic adjustment[J]. Plant Biol, 2010, 12(3): 395-405.
[15] WANG L X, LI F R, ZHANG F R. Changes of total protein and peroxidase activity in grape shoots, and their relationships to cold resistance[J]. Journal of Inner Mongolia Insititute of Agriculture & Animal Husbandry,1996,17(1):45-49.
[16] 王 静.高寒地区植物中酚类物质含量动态及其与抗寒性关系的研究[D].兰州:甘肃农业大学,2005.
[17] CHALKER-SCOTT L, FUCHIGAMI L H. The role of phenolic compounds in plant stress responses[A]. PAUL H L. Low-Temperature Stress Physiology in Crops[M]. Florida: CRC Press Inc. Boca Raton, 1989. 27-40.
[18] 康国章,岳彩凤,彭慧芳,等.冻害胁迫对小麦叶片抗寒生理生化指标的影响[J].河南农业科学,2011,40(12):56-60.
[19] LOGAN B A, MONTEIRO G, KORNYEYEV D, et a1. Transgenic overproduction of glutathione reductase does not protect cotton, Gossypium hirsutum (Malvaceae), from photoinhibtion during growth under chilling conditions[J]. Am J Bot, 2003, 90:1400-1403.
[20] 徐宇强,胡 轶,付凤玲,等.干旱胁迫下玉米自交系叶片木质素含量变化及其与耐旱性的关系[J].玉米科学,2007,15(5):72-75.
[21] 章霄云,郭安平,贺立卡,等.木质素生物合成及其基因调控的研究进展[J].分子植物育种,2006,4(3):431-437.
