芽孢杆菌8—32对大豆根腐病的生防效果
2015-10-13高同国等
高同国等

摘要:从实验室保存的237株细菌中筛选得到一株对大豆根腐病病原菌尖孢镰刀菌(Fusarium oxysporum)具有较强拮抗能力的菌株8-32,该菌株经生理生化试验、16S rRNA基因序列分析最终鉴定为Bacillus subtilis。以尖孢镰刀菌为病原菌研究了菌株8-32在盆栽条件下对大豆根腐病的防治作用。结果表明,菌株8-32可以有效防治大豆根腐病的发生,其防治效果最高可达32.08%,并且8-32可以明显促进大豆植株幼苗的生长,使株高增加7.7%~15.8%;使叶绿素含量提高7.8%~12.9%;大豆POD活性增加11.6%~63.8%;说明菌株8-32对由尖孢镰刀菌引起的根腐病具有显著的防治效果,具有进一步应用的潜力。
关键词: 大豆根腐病; 生物防治; Bacillus subtilis; 生防效果
中图分类号:Q949.32;R151 文献标识码:A 文章编号:0439-8114(2015)18-4489-04
DOI:10.14088/j.cnki.issn0439-8114.2015.18.025
大豆是重要的经济及油料作物,原产于中国,而2000年中国成为全球最大的大豆进口国,2013年进口量为6338万t,占全球大豆贸易总量的60%,对进口大豆的依存度高达80%左右。中国大豆种植产业面临来自国际市场的巨大压力,中国大豆单位面积产量远低于其他主要大豆生产国(美国、阿根廷、巴西等),而由大豆根腐病引起的连作障碍是引起大豆减产的重要原因之一[1]。大豆根腐病是一种分布广、危害重、病原菌种类繁多和防治困难的世界性病害,其中尤其以美国、日本、加拿大和中国等地发病严重[2]。在中国该病主要集中在东北和黄淮海大豆产区,仅黑龙江省每年发病面积就达7×105 hm2左右,占大豆播种面积的1/3以上。根腐病造成的产量损失一般达10%~30%,严重的可达50%~60%,甚至绝产[3],因此大豆根腐病每年给国家造成数亿元的经济损失。
中国自80年代以来相继开展了大豆根腐病的防治研究,直到现在还主要依靠化学药剂防治。化学药剂的大量使用不仅导致土壤水体污染,威胁食品安全,直接危害人类健康,并且还会引起根腐病病原菌出现抗性,甚至抑制大豆的结瘤和氮的固定[4]。生物防治技术避免了化学农药带来的一系列问题而成为植物病害防治的重要手段。目前用于生物防治的菌株涉及到放线菌、细菌和真菌,其中研究最多的是芽孢杆菌属(Bacillus sp.)和假单胞菌属(Pseudomonas sp.),芽孢杆菌可以产生内生芽孢,抗逆能力强,繁殖速度快,营养要求简单,易定殖在植物表面,芽孢杆菌产生的芽孢对于生防制剂生产和储存都是十分有利的[5],芽孢杆菌正逐渐成为世界上生防细菌研究的重点。
在前期工作中,以大豆根腐病病原菌即尖孢镰刀菌(Fusarium oxysporum)为指示菌,采用平板对峙法从实验室保存的237株芽孢杆菌中筛选得到一株具有较强拮抗能力的菌株8-32,对菌落菌体形态、生理生化性质及16S rRNA基因序列进行分析、鉴定。本试验采用盆栽方法对其生防效果进行了验证,以期为开发大豆根腐病生防菌剂提供理论基础。
1 材料与方法
1.1 材料
指示菌为尖孢镰刀菌,由中国科学院东北地理与农业生态研究院王光华教授提供。细菌为河北农业大学生命科学学院分离保存的237株细菌。大豆为冀豆12,购买于种子市场。
1.2 培养基
PDA培养基:土豆200 g,葡萄糖或蔗糖20 g,去离子水1 000 mL,pH 7.0~7.2,琼脂15~18 g;NB培养基:牛肉膏5 g,蛋白胨10 g,NaCl 5 g,去离子水1 000 mL,pH 7.0~7.2;每1 000 mL NB培养基中加入琼脂15~18 g为NA培养基。
1.3 微生物活化
尖孢镰刀菌的活化采用PDA培养基,用打孔器取直径6 mm的指示菌(尖孢镰刀菌)菌饼,置于PDA培养基中央,28 ℃倒置培养3~4 d,待用。细菌的活化采用NA培养基,将4 ℃保存的细菌接种在NA培养基中进行活化,37 ℃培养24 h后取出一环接种于NB培养基中,置于摇床中以37 ℃ 160 r/min培养48 h待用。
1.4 盆栽试验
采集农田土,风干后过10目筛,每盆(直径13 cm×高12 cm)装土1 000 g。浇透水晾2 d后,每盆放5块直径为6 mm的尖孢镰刀菌菌饼。将表面消毒后的大豆播种于盆中,每盆保苗3株,每个处理60盆。同时,在每粒种子上加入1 mL浓度为1×106 CFU/mL(处理1)或1×108 CFU/mL(处理2)的Bacillus subtilis 8-32菌液。待大豆生长到第7天、第14天和第21天对大豆根腐病病情指数进行调查,并测定其株高、植株干重、叶片中叶绿素含量和根部过氧化酶系(CAT、POD)活性的变化。
1.5 病情指数
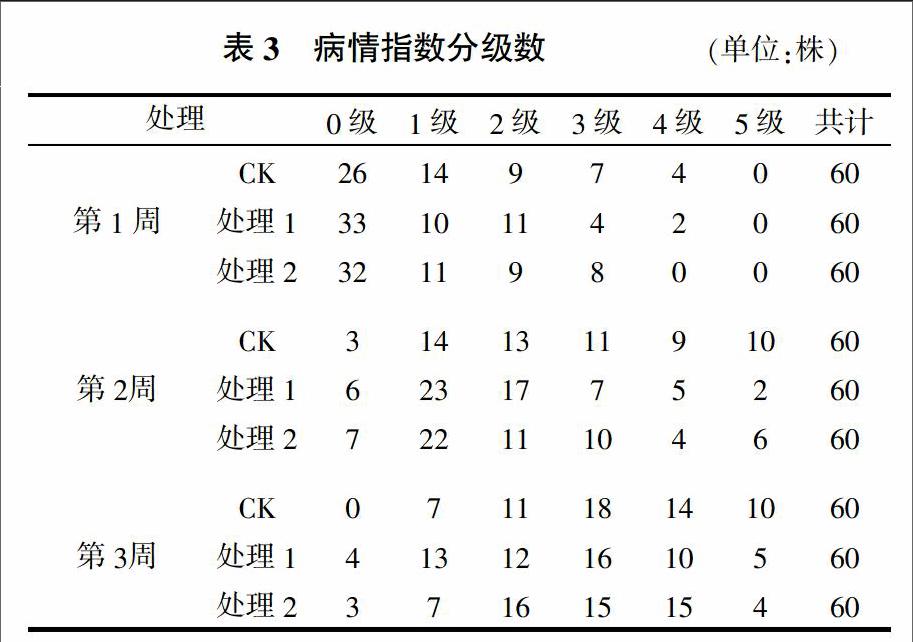
每个处理取20盆,对盆中60株大豆幼苗发病程度进行分析,根据根腐病分级标准(表1)对大豆幼苗根部进行分级。
分级后对病情指数进行计算:
病情指数=100×∑(级数×该级株数)/(发病最高级数×总株数)
1.6 叶绿素含量测定
叶绿素的测定参照文献[6]。选取生长发育正常、无病虫害、无干叶的大豆叶片,暗处保存。在避光室内,取出待测样品,剪碎,混匀。精确称取2.0 g样品于研钵中,加少量碳酸钙及80%丙酮溶液3 mL研磨匀浆,再加丙酮10 mL继续研磨至叶片组织变白。将研磨后的样品滤入100 mL棕色容量瓶中,并用80%丙酮定容至100 mL,测定叶绿素含量。
80%丙酮作参比液,分别在645 nm和665 nm处测定样品液的吸光值,并且按下列公式计算叶绿素含量,重复3次。
叶绿素含量=(20.29A645 nm+8.04A665 nm)×V/1000×W
其中A645 nm、A665 nm分别为645 nm和665 nm时的吸光度,V为提取液总体积(mL),W为叶片鲜重(g)。
1.7 POD活性测定
POD活性测定采用愈创木酚法[7],以1 min内OD470 nm变化0.01为1个过氧化物酶活性单位(U)。取大豆病根1 g放入研钵中,加5 mL 0.05 moL/L磷酸缓冲液,冰浴研磨成匀浆后以4 000 r/min离心15 min,上清液即为粗酶提取液,于4 ℃下保存备用。
取10 mL试管4支,3支测定,1支对照。每支试管加2.9 mL 0.05 moL/L磷酸缓冲液,1 mL 0.05 moL/L愈创木酚和0.1 mL粗酶液,对照组用1 mL 0.05 moL/L磷酸缓冲液代替粗酶液。反应体系加入粗酶液后,立即于37 ℃水浴中保温15 min,加入1 mL质量百分数为2%的H2O2后立即测定,470 nm波长下测定吸光度。
根据公式计算出酶活性,计算公式为:POD活性[U/(g Fw·min)]=(Vt×ΔOD)/0.01Fw×V2×Δt
式中,每分钟内变化0.01为1个活性单位(U),过氧化物酶活性单位[U/(g Fw·min)];其中ΔOD为反应时间内吸光度的变化,比色波长为470 nm;Δt为ΔOD对应的时间(min);Vt为酶液总体积(mL);V2为测定时取用的提取酶液体积(mL);Fw为样品鲜重(g)。
1.8 CAT活性测定
CAT活性测定采用紫外吸收法[8], 以1 min内ΔA240 nm减少0.1的酶量为1个过氧化氢酶活性单位(U)。称取大豆根部样品0.5 g放置于遇冷研钵中,加2~3 mL pH 7.0的磷酸缓冲液(4 ℃预冷),冰浴研磨匀浆移至25 mL容量瓶中。用磷酸缓冲液冲洗研钵数次,定容。将容量瓶置于5 ℃冰箱中静置10 min。取上清液于离心管中离心(4 ℃,4 000 r/min,15 min),上清液即为粗酶提取液,取上清液并在4 ℃下保存备用。
取10 mL试管4支,3支测定,1支对照。每支试管加2 mL去离子水,3 mL pH 7.8的磷酸缓冲液,0.4 mL粗酶液,对照加等量的磷酸缓冲液。试管于25 ℃水浴中预热3 min后,各加0.1 moL/L的过氧化氢溶液0.6 mL,每加1管立即测A240 nm,分别于60、120、180 s记录每支试管的测量值。
CK组测得的吸光值记为A0,处理1记为A1,处理2记为A2。
ΔA240 nm=A0-(A1+A2)/2
过氧化氢酶活性[U/(g FW·min)]=ΔA240×Vt/(0.1V1×t×Fw)
Vt为酶液总体积(mL);V1为测定时取用的提取酶液体积(mL);Fw为样品鲜重(g)。
2 结果与分析
2.1 生防菌8-32对大豆的促生作用
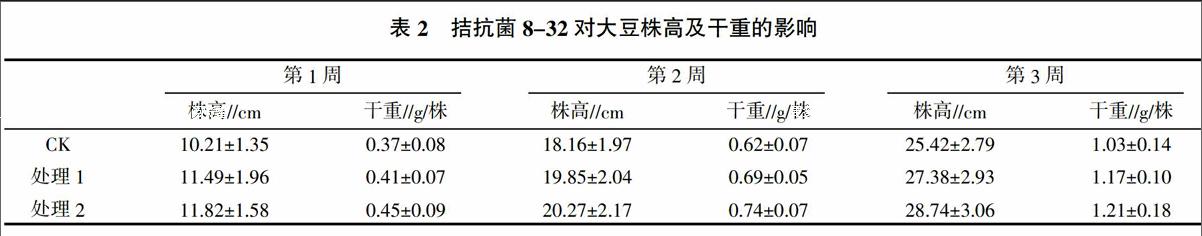
研究了生防菌8-32对大豆幼苗的促生作用,结果见表2。表明8-32有效促进了大豆的生长,当每粒种子加入1×106 CFU/mL菌液后,其第1周、第2周、第3周株高分别增加12.5%、9.3%和7.7%,而当加入量为1×108 CFU/mL时,第1周至第3周株高分别增加15.8%、11.6%和13.1%,并且干物质重量都有明显的增加。进一步采用Sackowskis比色法测定,以LB为培养基,30 ℃ 160 r/min振荡培养72 h后,测得发酵上清液中吲哚乙酸(IAA)的质量浓度为45.29 mg/L。
在植物病害生物防治领域中,枯草芽孢杆菌已经成为主要的生防细菌之一,它具有较强的防病作用。IAA是一种重要的植物激素,可以促进植物根系生长发育[9],研究表明,8-32具有较强的IAA产生能力,具有促进大豆生长的能力。
2.2 枯草芽孢杆菌8-32对大豆根腐病的防治效果
通过大豆盆栽试验研究了枯草芽孢杆菌对大豆根腐病的防治效果,结果见表3、表4。表明8-32对大豆幼苗根腐病具有明显的防治作用,其生防效果为13.22%~32.08%,并且处理1生防效果优于处理2,处理1在大豆栽培第2周时防治效果达到最高,为32.08%。试验中分别采用2种浓度的8-32进行盆栽试验,其中处理1(1×108 CFU/mL)菌含量明显低于处理2(1×108 CFU/mL),但防治效果却较处理2更明显,其原因还需进一步分析。
2.3 枯草芽孢杆菌8-32对大豆叶绿素含量的影响
叶绿素含量的多少是检测植物光合作用强弱和有机物合成能力的重要指标,并且与氮素营养有密切关系。试验中进一步研究了枯草芽孢杆菌8-32对大豆植株中叶绿素含量的影响,结果见图1。与对照组相比,8-32增加了叶片中叶绿素的含量。在第1周,处理1和处理2分别较CK高9.2%和12.4%,在第2周时处理1、处理2较CK分别增加了12.3%和12.9%,第3周处理1和处理2较CK高7.8%和8.8%。枯草芽孢杆菌8-32可以提高大豆幼苗叶片中叶绿素的含量。
2.4 枯草芽孢杆菌8-32对大豆根腐病根系过氧化物酶活性的影响
抗氧化酶系统可以减小活性氧对细胞产生的危害,与植物抗逆具有密切联系[10,11]。本试验研究了大豆幼苗POD及CAT酶的活性变化。其中POD活性见图2,结果表明,8-32有效增加了大豆幼苗根部POD的活性,处理2优于处理1。第1周时处理1和处理2分别比对照组提高了19.7%和32.8%,第2周时处理1和处理2的POD活性分别比对照增加11.6%和41.8%,第3周分别增加22.4%和63.8%,上述结果与温广月[12]研究18BR2-2对大豆根腐病的生防效果一致。
2.5 枯草芽孢杆菌8-32对大豆根腐病根系过氧化氢酶活性的影响
过氧化氢酶同样是抗氧化酶系的主要组成之一。由图3可以看出,接种8-32后第1周及第2周CAT活性有明显的提高,在第3周不明显。其中以第2周处理1提高幅度最大,达50%,说明8-32可以提高大豆根部过氧化氢酶的活性。
3 小结
由试验结果可知,枯草芽孢杆菌8-32对大豆根腐病具有一定的防治效果,当接种浓度为1×106 CFU/(mL·株)时,可以有效防治大豆根腐病的发生,其防治效果达到32.08%。并且使用8-32可以有效提高大豆叶片中叶绿素含量,增加植株根系过氧化物酶及过氧化氢酶等抗氧化酶系的活力。8-32具有较强的大豆根腐病的防治能力,可进一步开发应用于实际生产,但其机理尚不明确,还需进一步研究。
参考文献:
[1] 苗淑杰,乔云发,韩晓增.大豆连作障碍的研究进展[J].中国生态农业学报,2007,15(3):203-206.
[2] 郑殿峰,梁喜龙,左豫虎,等.大豆根腐病菌对大豆幼苗生理生化指标的影响[J].中国油料作物学报,2004,26(3):57-61.
[3] 梁喜龙,郑殿峰,左豫虎.大豆根腐病的研究现状及展望[J].黑龙江八一农垦大学学报,2003,15(4):30-34.
[4] JENSEN C E,PERCICH J A,GRAHAM P H. Integrated management strategies of bean root rot with Bacillus subtilis and Rhizobium in Minnesota[J].Field Crops Research,2002,74(2-3):107-115.
[5] EMMERT E A B,HANDELSMAN J. Biocontrol of plant disease: a (Gram-) positive perspeetive[J]. FEMS Microbiology Letters,1999,171(1):1-9.
[6] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000.54-55,62-63,72-75,111-112.
[7] 张志良.植物生理学实验指导[M].北京:高等教育出版社,1990.154-156.
[8] KRAUS T E,FLETCHER R A. Paclobutrazol protects wheat seedlings from heat and paraquat injury. Is detoxification of active oxygen involved[J]. Plant Cell Physiology,1994,35(1):45-52.
[9] ERTURK Y,ERCISLI S,HAZNEDAR A,et al. Effects of plant growth promoting rhizobacteria(PGPR) on rooting and root growth of kiwifruit(Actinidia deliciosa) stem cuttings[J].Biological Research,2010,43(1):91-98.
[10] 栾 白,高同国,姜 峰,等.微生物降解褐煤产生的黄腐酸对大豆种子萌发及主要抗氧化酶活性的影响[J].大豆科学,2010,29(4):607-610.
[11] 蒋选利,李振岐,康振生.过氧化物酶与植物抗病性研究进展[J].西北农林科技大学学报(自然科学版),2001,29(6):124-129.
[12] 温广月.大豆根腐病生防细菌的筛选及作用机制研究[D].哈尔滨:东北农业大学,2005.
