铁缺乏与过量对花生幼苗叶绿素、MDA含量和SOD、POD活性的影响
2015-10-13李晓华等
李晓华等
摘要:以花生(Arachis hypogaea cv.)山花9号为试验材料,采用砂基培养法,研究了6种不同铁浓度Hoagland溶液处理下花生幼苗总叶绿素含量、丙二醛(MDA)含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)酶活性的变化。结果表明,叶绿素a/b比值和MDA含量随着铁浓度的升高先降低后升高,0.05×10-3 mol/L处理最低;总叶绿素含量、SOD和POD活性先升高后降低,0.05×10-3 mol/L处理最高。综合分析认为,铁浓度超过0.10×10-3 mol/L时,会对砂基培养的花生幼苗产生毒害,砂基培养下花生幼苗生长发育的最适螯合硫酸亚铁浓度应为0.05×10-3 mol/L。
关键词:花生(Arachis hypogaea cv.);铁;叶绿素;MDA;SOD;POD
中图分类号:S565.201 文献标识码:A 文章编号:0439-8114(2015)18-4408-04
DOI:10.14088/j.cnki.issn0439-8114.2015.18.007
铁是一种二价或三价阳离子重金属,取决于土壤中的氧化还原条件。铁在地球上现存的原核生物和真核生物的生命活动中具有不可替代的作用,铁参与植物体内氧化还原反应,是血红蛋白和细胞色素的组成成分,还是超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等的组成成分,并在叶绿素的合成中发挥重要作用[1-3]。植物中铁的研究可追溯至170多年前,Gris发现缺铁造成的葡萄黄化现象[4,5]。植物吸收铁的形态多为Fe2+,Fe3+必须在输入细胞之前在根表面还原成二价铁[6]。缺铁的典型症状是植物叶片失绿;除了亚洲的稻类作物,田间铁毒害现象不常见[7]。
在盆栽试验或盆栽植物如杜鹃花铁供应量大的时候会发生铁毒害[8]。不同花生品种对缺铁的敏感程度有差异,ICG12672为高耐品种,中花8号为耐铁品种,远杂9102为敏感品种,ICG11855和中花5号为高敏感品种[9]。对铁敏感的花生通常比不敏感的花生品种在缺铁条件下过氧化物酶活性降低更快[10]。铁还原力的提高和分泌质子量的增加是花生适应缺铁胁迫的主要机制[11]。包含亚铁血红素的过氧化物酶用过氧化氢作为电子受体催化许多氧化还原反应;当缺乏铁元素时,鹰嘴豆(Cicer arietinum L.)的过氧化物酶活性被抑制而锰缺乏时活性升高,但锰并不是POD的构成成分[12]。缺乏Fe元素时,鹰嘴豆的CAT和POD活性受到抑制,而CAT和POD活性成为鹰嘴豆Fe和Mn营养状况评估指标[13]。完全缺乏Fe元素时,玉米幼苗叶片CAT、POD和硝酸还原酶活性降低;但POD/CAT活性比值还不能成为Fe匮乏的诊断指标[14]。缺铁状况下,溶液培养法培养的向日葵(Helianthus annuus L.)叶片过氧化氢含量显著升高,抗坏血酸过氧化物酶(APX)和愈创木酚依赖POD活性降低[15]。酶活性测定尚未成为植物营养状况的关注点,但酶活性可以作为植物营养匮乏或过量的指示;酶活性测定可以使用铁匮乏组织或将疑似铁匮乏组织浸入酶活性恢复体系中的组织;酶活性测定可以使用进行快速测定的叶片粗提取液[16]。
花生(Arachis hypogaea cv.)铁营养研究多是从缺铁的角度进行的,本研究将从缺铁和铁过量两个方面设置6个浓度梯度,研究不同浓度Fe2+处理下(包含0.02×10-3 mol/L[17]和0.05×10-3 mol/L[18]两种常用的Hoagland营养液配方中的铁浓度)花生幼苗叶片叶绿素含量、MDA含量、SOD和POD活性的变化。
1 材料与方法
1.1 材料的培养与处理
本研究以花生山花9号为试验材料,采用砂基培养法。
石英砂先用自来水洗净,再用1%的盐酸浸泡过夜,后用去离子水冲洗3遍,装于干净的塑料盆中。
挑选饱满大小一致的种子,体积分数为75%的乙醇消毒30 s,然后用去离子水冲洗干净,26 ℃去离子水中浸种4 h,播种到塑料盆中。开始用去离子水浇灌,幼苗长出真叶时浇不同Fe2+浓度的Hoagland营养液。鉴于溶液培养法和砂基培养法常用的Hoagland营养液配方中螯合铁的浓度常见有0.02×10-3 mol/L、0.05×10-3 mol/L,所以,共设6个Fe2+浓度,分别为0.00×10-3 mol/L(CK)、0.02×10-3 mol/L(A)、0.05×10-3 mol/L(B)、0.10×10-3 mol/L(C)、0.20×10-3 mol/L(D)、0.40×10-3 mol/L (E)。光周期为白天/夜晚=14 h/10 h;温度为白天/夜晚=26 ℃/20 ℃;光照强度为70 μmol/m2·s;每隔1 d浇一次营养液,每次300 mL;处理15 d后取成熟叶用于试验测定,每个处理3次重复。
1.2 测定项目与方法
叶绿素含量测定采用比色法[18];MDA含量的测定采用硫代巴比妥酸比色法[18];SOD酶活性测定采用氮蓝四唑光化学还原法[19];POD酶活性测定采用愈创木酚法[20]。
试验数据采用Microsoft Excel 2010 进行统计分析,新复极差法(SSR检验)检验差异显著性。
2 结果与分析
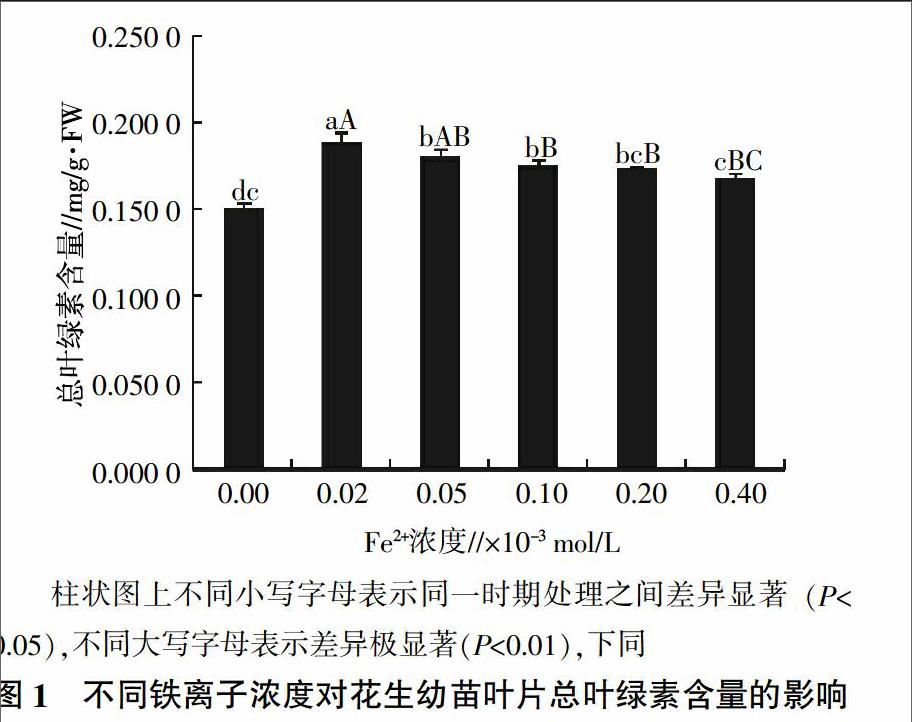
2.1 不同铁离子浓度对花生幼苗叶片叶绿素含量及叶绿素a/b比值的影响
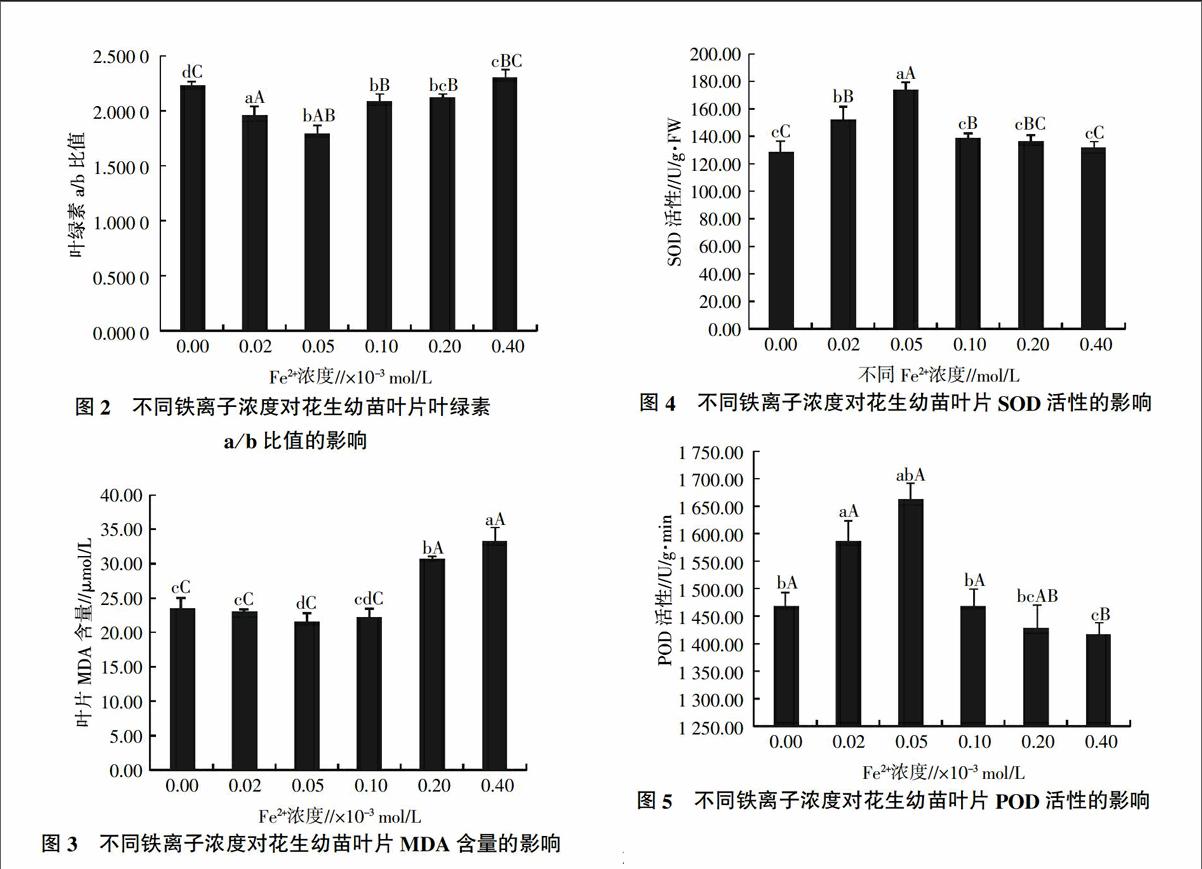
由图1和图2可知,以缺铁为对照,随着铁浓度的逐渐升高,叶绿素含量先升高后降低,以A处理叶绿素含量最高,与其他处理(B处理除外)间差异极显著。叶绿素a/b比值随铁浓度的升高先降低而后升高,以B处理最低,与其他处理之间差异极显著。前人研究中,常用的螯合铁的浓度有0.02×10-3 mol/L和0.05×10-3 mol/L两种,本研究结果表明,0.02×10-3 mol/L铁浓度有利于叶绿素合成,而0.05×10-3 mol/L铁处理对叶绿素a/b比值影响最大。
2.2 不同铁离子浓度对花生幼苗叶片MDA含量的影响
由图3可知,随着铁浓度的逐渐升高,丙二醛(MDA)含量先降低而后升高,以B处理MDA含量最低,与CK、A、D和E处理间差异显著;与D和E处理间差异极显著,E处理MDA含量最高,B处理MDA含量最低,说明该浓度是花生幼苗生长的最适浓度,而铁匮乏和过量均对细胞膜造成了伤害,而随着Fe2+浓度(大于0.05×10-3 mol/L时)的增大,细胞膜的伤害程度逐渐加重。
2.3 不同铁浓度对花生幼苗叶片SOD、POD活性的影响
由图4和图5可知,随着铁浓度的逐渐升高,SOD和POD活性均呈现先升高后降低的趋势,以B处理酶活性最高。当Fe2+浓度超过0.05×10-3 mol/L时,SOD活性降低较小,C、D和E处理的SOD活性均略大于CK;而POD活性则降低幅度较大,C处理的POD活性与CK相当,D和E处理的POD活性小于CK。由此可见,铁过量对POD活性的影响更大。
3 小结与讨论
铁是植物必需的微量元素;铁虽不是叶绿素的组成成分,但它直接影响叶绿素的合成;总叶绿素含量和叶绿素a/b比值反映了植物营养状况和受胁迫的程度[1,4,5,7]。本研究结果表明,在铁缺乏和过量情况下总叶绿素含量均降低,缺铁影响叶绿素的合成已成共识,而铁过量情况下叶绿素的降低未见报道,需进一步研究。
过氧化作用破坏细胞膜结构,MDA是膜脂过氧化的最终产物,是膜系统受伤害的重要标志之一,其含量可表示膜脂过氧化作用的程度[11,15]。本研究结果表明,CK处理和C、D、E处理MDA的含量显著高于A和B处理,这充分说明当缺铁和铁过量时均造成花生幼苗膜质过氧化,且过量胁迫的程度超过缺铁,这与任小平等[9]对水培条件下花生幼苗缺铁处理的研究结果一致。
SOD和POD作为植物体内抗氧化酶系统的重要组成成分,在清除自由基方面发挥重要作用,被称为保护酶系统;超氧化物歧化酶可以消除超氧化物阴离子自由基产生H2O2,而H2O2可被过氧化氢酶、过氧化物酶分解;SOD和POD都是含Fe的金属蛋白质,因此缺铁将影响酶的生物活性[11,15,21,22]。本研究发现,随着Fe2+浓度的升高,SOD和POD活性均呈现先升高后降低的趋势。这表明缺铁和铁过量均影响到SOD和POD的活性,只有在Fe2+浓度为0.05×10-3 mol/L时酶活性达到最高。
综上所述,缺铁和铁过量对花生幼苗均形成胁迫,伤害的情况存在差异;Fe2+浓度超过0.10×10-3 mol/L时,对砂基培养的花生幼苗产生毒害;砂基培养下适合花生幼苗生长发育的最适螯合硫酸亚铁浓度应为0.05×10-3 mol/L。
参考文献:
[1] 张智猛,万书波,戴良香,等.花生铁营养状况研究[J].花生学报,2003,32(S1):361-367.
[2] WIEDENHOEFT A C,HOPKINS W G.Plant Nutrition[M].New York: Chelsea House Publishers, 2006.30-31.
[3] 丁 红,宋文武,张智猛.花生铁营养研究进展[J].花生学报,2011,40(1):39-43.
[4] GUERINOT M L,YI Y.Iron: nutritious, noxious,and not readily available[J].Plant Physiol,1994,104(3):815-820.
[5] 周志钦.植物铁结合蛋白基因研究现状[J].生物技术,2001,11(3):29-33.
[6] CHEN Y,BARAK P.Iron nutrions plants in calcareous soils [J].Adv Agron,1982,35:217-240.
[7] BARKER A V,PILBEAM D J.Handbook of plant nutrition[M]. Boca Raton:Taylor & Francis Group,LLC,2007.329-350.
[8] MARSCHNER H,R?魻MHELD V,KISSEL M V.Different strategies in higher plants in mobilization and uptake of iron [J]. J Plant Nutr,1986,80(9):695-713.
[9] 任小平,蒋慧芳,黄家权,等.水培条件下花生对缺铁的生理反应[J].植物遗传资源学报,2010,11(4):491-497.
[10] R?魻MHELD V,MARSCHNER H. Effect of Fe stress on utilization of Fe chelates by efficient and inefficient plant species [J]. J Plant Nutr, 1981,3(1-4):551-560.
[11] 高 丽,史衍玺.铁胁迫对花生某些生理特性的影响[J].中国油料作物学报,2003,25(3):51-54.
[12] KAUR N P,TAKKAR P N,NAYYAR V K.Catalase,peroxidase,and chlorphyll relationships to yield and iron deficiency chlorosis in Cicer genotypes[J]. J Plant Nutr,1984,7(8):1213-1220.
[13] LEIDI E O,G?魷MEZ M,DE LA GUARDIA M D. Evaluation of catalase and peroxidase activity as indicators of Fe and Mn nutrition for soybean[J]. J Plant Nutr,1986,9(9):1239-1249.
[14] NENOVA V,STOYANO I.Physiological and biochemical changes in young maize plants under iron deficiency: 2.Catalase, peroxidase, and nitrate reductase activities in leaves[J].J Plant Nutr,1995,18(10):2081-2091.
[15] RANIERI A,CASTAGNA A,BALDAN B,et al.Soldatini. Iron deficiency differently affects peroxidase isoforms in sunflower[J]. J Exp Bot,2001,52(354):25-35.
[16] BAR-AKIVA A.Substitutes for benzidine as H-donors in the peroxidase assay,for rapid diagnosis of iron deficiency in plants[J].Communications in Soil Science and Plant Analysis,1984,15(8):929-934.
[17] 张志良,瞿伟菁.植物生理学实验指导[M].第三版.北京:高等教育出版社,2003.
[18] 赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业科学出版社,2002.38-39.
[19] 王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2010.134-136,280-281.
[20] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.58-65.
[21] LEIDI E O,G?魷MEZ M,DEL RIO L.A.Peroxidase isozyme patterns developed by soybean genotypes in response to manganese and iron stress[J]. Biochemistry and Physiology of Plants,1989,185(5-6):391-396.
[22] SIJMONS P C,KOLATTUKUDY P E,BIENFAIT H E. Iron deficiency decreases suberization in bean roots through a decrease in suberin specific peroxidase activity [J].Plant Physiol,1985,78(1):115-120.
