饲用粪肠球菌培养基及发酵条件的优化研究
2015-10-12马明仑宋志元张新蕾张要齐张军辉孙雪峰
马明仑,宋志元,张新蕾,张要齐,张军辉,孙雪峰
(1.新乡市畜产品质量监测检验中心,河南 新乡 453700;2.河南惠通天下生物工程有限公司)
饲用粪肠球菌培养基及发酵条件的优化研究
马明仑1,宋志元2,张新蕾2,张要齐2,张军辉2,孙雪峰2
(1.新乡市畜产品质量监测检验中心,河南 新乡453700;2.河南惠通天下生物工程有限公司)
为提高饲用粪肠球菌发酵活菌数,通过单因素试验和正交优化试验对粪肠球菌的培养基和发酵条件进行优化。确定最佳发酵培养基为蛋白胨3.2%,酵母粉1%,葡萄糖2.8%,吐温-80 1 ml/L,柠檬酸三铵0.2%,七水硫酸镁0.02%,一水硫酸锰0.005%,碳酸钙1.0%。最佳发酵条件为培养基初始pH(7.1i 0.1),接种量2.5%~5.0%,温度34~37℃,150 r/min振荡培养。在最佳培养基和发酵条件下,粪肠球菌活菌数最高可达8.5 109cfu/ml。
粪肠球菌;发酵;正交试验;优化
随着科技的进步和人们对健康、绿色畜禽产品的需求,益生菌作为抗生素的替代品越来越受到人们的关注及深入研究[1]。
粪肠球菌是革兰氏阳性菌,1994年出版的《伯杰氏细菌鉴定手册》将该菌列为肠球菌属[2]。粪肠球菌存在于人和大多数动物的肠道内,是人体肠道内的重要菌群,能耐受胃酸和胆汁酸的作用[3]。粪肠球菌制作成微生态饲料添加剂,可以对宿主胃肠道进行微生态调节,增强动物免疫力[4],不仅具有提高畜禽生产性能和防治疾病的作用,而且还具有无污染、无耐药性和无残留等优点。该研究通过对培养基和发酵工艺进行优化,以提高粪肠球菌的活菌数,为粪肠球菌制剂工业化生产提供技术支撑。
1 试验材料
1.1菌种
粪肠球菌,购于中国工业微生物菌种保藏中心。
1.2培养基
检测培养基:蛋白胨2%,酵母粉1%,葡萄糖2%,吐温-80 1 ml/L,磷酸氢二钾0.2%,柠檬酸三铵0.2%,无水硫酸镁0.02%,一水硫酸锰0.005%,无水乙酸钠0.5%,溴甲酚紫0.006%,琼脂1.5%,pH(7.1i 0.1)。
种子培养基:蛋白胨2%,酵母粉0.5%,葡萄糖2%,吐温-80 1 ml/L,磷酸氢二钾0.2%,柠檬酸三铵0.2%,七水硫酸镁0.02%,一水硫酸锰0.005%,无水乙酸钠0.5%,pH(7.1i 0.1)。
基础发酵培养基:蛋白胨3.2%,酵母粉1%,葡萄糖3.4%,吐温-80 1 ml/L,柠檬酸三铵0.2%,七水硫酸镁0.02%,一水硫酸锰0.005%,碳酸钙1.0%,pH(7.1i 0.1)。
2 试验方法
2.1粪肠球菌种子培养及发酵
种子培养:以0.5%的接种量,将斜面种子接种至种子培养基中,37℃静置培养10 h,即为种子液。
发酵:以5%的接种量,将种子液接种至发酵培养基中,37℃,振荡培养至碳酸钙消失。
2.2发酵培养基的优化
2.2.1碳酸钙含量的确定
将碳酸钙以0%、0.5%、0.8%和1.0%的添加量添加至发酵培养基中,根据碳酸钙消失情况和活菌数选取最优碳酸钙含量。
2.2.2正交优化试验
选取葡萄糖、蛋白胨、酵母粉等3个影响因素,采用L9(34)正交表设计试验,以发酵液粪肠球菌活菌数为指标,确定葡萄糖、蛋白胨和酵母粉的添加量(见表1),每次处理3个重复。
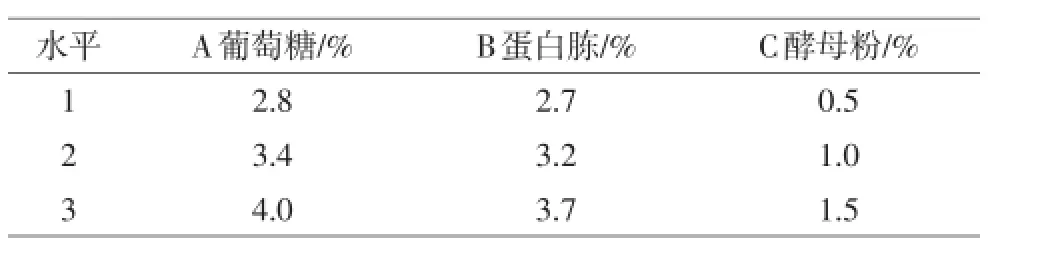
表1 正交试验的因素和水平
2.3发酵条件的优化
2.3.1培养方式对发酵的影响
分别以静置、100 r/min、150 r/min进行发酵,根据碳酸钙消失情况和活菌数确定培养方式。
2.3.2培养基初始pH对发酵的影响
用3 mol/L的盐酸溶液或氢氧化钠溶液调节发酵培养基初始pH分别为6.6、7.1、7.6,发酵完成后,根据碳酸钙消失情况和活菌数确定最佳初始pH。
2.3.3发酵温度对发酵的影响
分别在33℃、37℃、41℃温度条件下,进行发酵,根据碳酸钙消失情况和活菌数确定最佳发酵温度。
2.3.4接种量对发酵的影响
分别以2.5%、5.0%和10%的接种量,将种子液接种至发酵培养基中,发酵完成后,根据碳酸钙消失情况和活菌数确定最佳接种量。
2.3检测方法
2.3.1pH检测
用pH计直接检测发酵,记录结果。
2.3.2吸光度检测
将发酵液稀释适宜浓度,以稀释相同倍数的空白培养基作对照,在600 nm处测稀释发酵液的吸光值,使数值在0.2~0.8之间,记录结果。
2.3.3活菌数的检测
用无菌生理盐水稀释发酵液至适宜浓度,吸取0.1 ml至活菌计数平板上,涂布均匀,37℃倒置培养36~48 h,记录结果。
3 结果
3.1发酵培养基优化结果
3.1.1碳酸钙含量对发酵的影响(见图1)
如图1所示,发酵培养基中不添加碳酸钙时,发酵情况较差,活菌数非常低。当添加0.5%、0.8%和1.0%的碳酸钙时,发酵液中活菌数均较高,但碳酸钙含量为1.0%,发酵14 h时,碳酸钙含量仍未消失完全;碳酸钙含量为0.5%和0.8%时,碳酸钙均消失。故选择碳酸钙含量为0.5%。
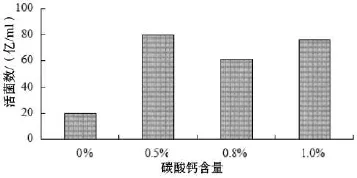
图1 碳酸钙含量对粪肠球菌发酵的影响
3.1.2正交试验结果(见表2)
表2表明,各因素对于正交优化试验的影响顺序依次为:蛋白胨>葡萄糖>酵母粉,最佳组合为B2A1C2,即葡萄糖添加量为2.8%,蛋白胨添加量为3.2%,酵母粉添加量为1.0%。
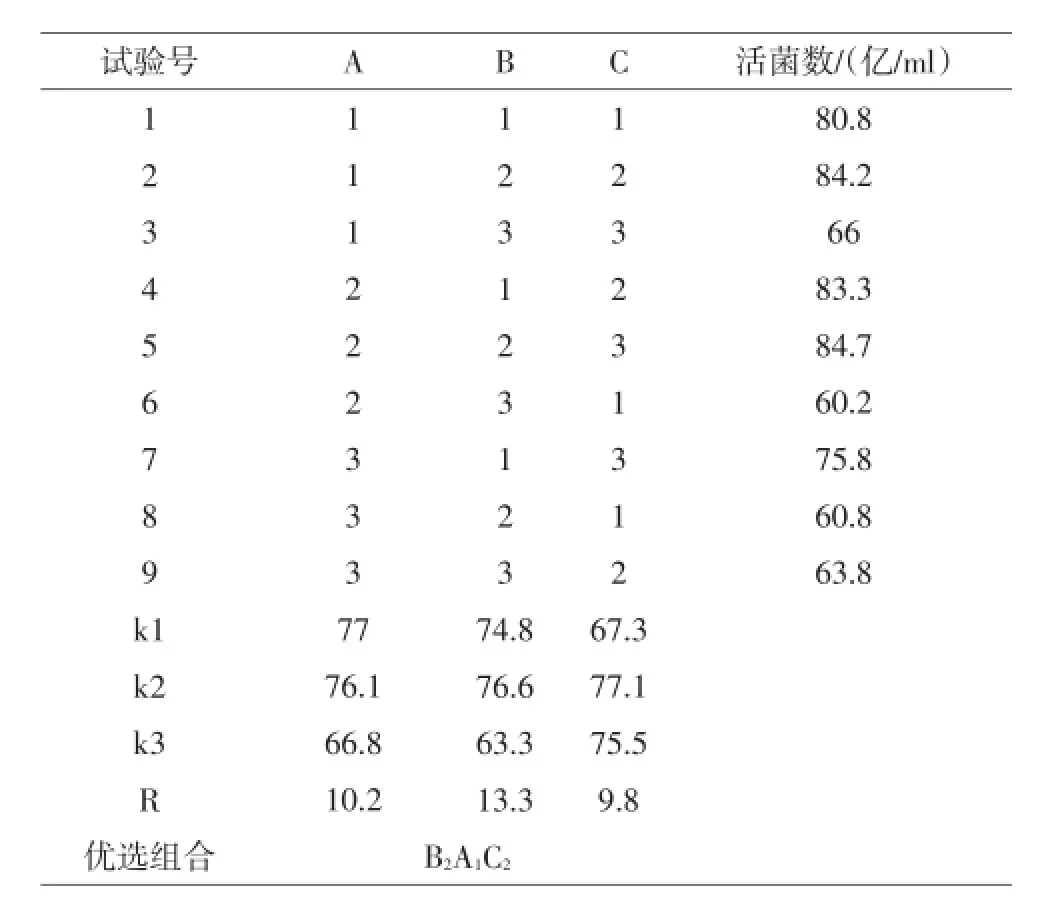
表2 正交试验的设计与结果
3.2发酵条件的优化
3.2.1培养方式对发酵的影响
在静置或100 r/min的发酵条件下,发酵液中碳酸钙均未消失,且活菌数较低;而在150 r/min的发酵条件下,发酵液中碳酸钙均已消失,活菌数也较高。
3.2.2培养基初始pH对发酵的影响(见图2)
图2所示,当初始pH较高时,发酵液中活菌数较低;初始pH为7.1时,发酵液中活菌数较高,达到74亿/ml以上。故确定培养基初始pH为7.1i 0.1。
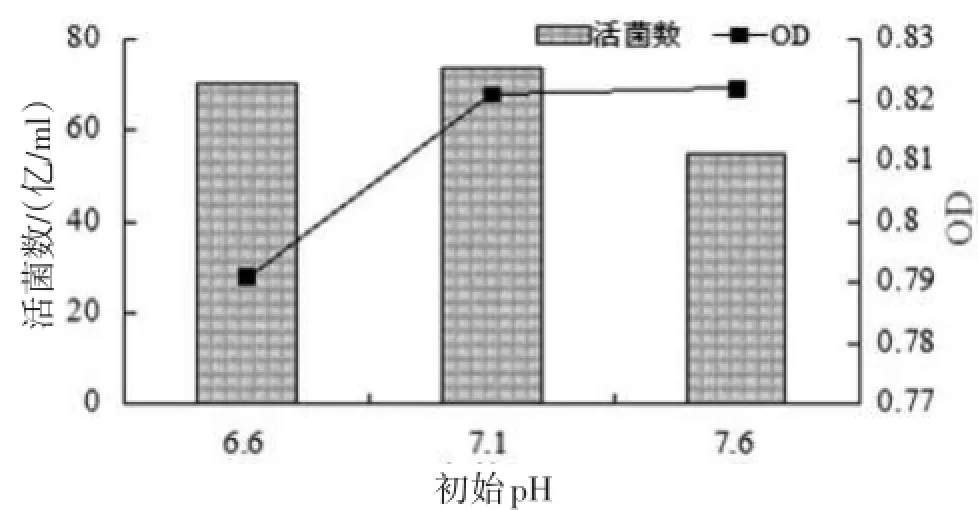
图2 培养基初始pH对粪肠球菌发酵的影响
3.2.3温度对发酵的影响(见图3)图3所示,发酵温度为40℃时,发酵液活菌数较低;发酵温度为34℃和37℃时,发酵液活菌数分别达68亿/ml和70.8亿/ml,差别不大,故发酵温度可控制在34~37℃。
3.2.4接种量对发酵的影响(见图4)
图4所示,接种量为2.5%和5.0%时,发酵液的吸光度和活菌数差别不明显,OD600为0.79左右,活菌数达75亿/ml左右。而接种量为10.0%时,发酵液的吸光度和活菌数均较低。故确定接种量为2.5%~5.0%。
发酵液初始活菌数对发酵结束后活菌数的影响(见图5)。结果显示发酵液初始活菌数每毫升为0.48亿~1.15亿时,发酵结束后活菌数均达到70亿/ml以上;其中发酵液初始菌数为0.99亿/ml时,发酵结束后活菌数达到85亿/ml。
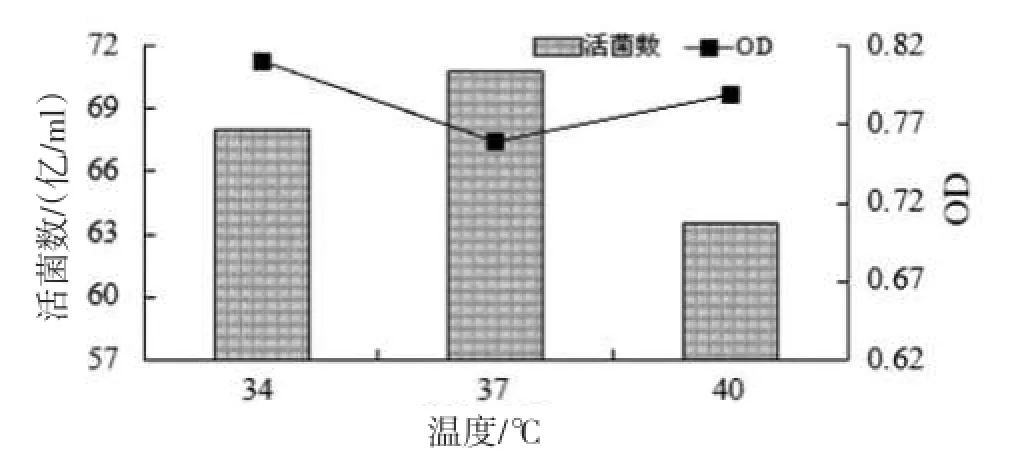
图3 温度对粪肠球菌发酵的影响

图4 接种量对粪肠球菌发酵的影响
4 结论
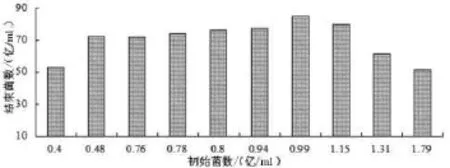
图5 初始活菌数对粪肠球菌发酵的影响
通过对发酵培养基和发酵条件进行优化,确定粪肠球菌最佳发酵培养基配方为蛋白胨3.2%,酵母粉1%,葡萄糖2.8%,吐温-80 1 ml/L,柠檬酸三铵0.2%,七水硫酸镁0.02%,一水硫酸锰0.005%,碳酸钙1.0%,初始pH(7.1i 0.1)。采用最佳发酵培养基、初始pH(7.1i 0.1)、接种量2.5%~5.0%、温度34~37℃,以150 r/min振荡培养,发酵液中粪肠球菌活菌数最高可达8.5 109cuf/ml以上。
[1]刘虎传,张敏红,姜海龙.益生肠球菌的研究进展[J].动物营养学报,2011,23(12):2090-2096.
[2]Hot G J,Krieg R N,Sneath H A P,等.伯杰氏细菌鉴定手册·第9版[M].北京:科学出版社,l994.
[3]沈中艳.猪源益生乳酸菌的筛选及发酵工艺研究[D].硕士学位论文.武汉:华中农业大学,2007:10-18.
[4]王旭明,陈宗泽,袁毅.益生菌作用机理的研究进展[J].吉林农业科学,2002,27(1):50-53.
S816
B
1004-5090(2015)06-0004-03
2015-04-18)
