固相微萃取-气相色谱法测定水中酞酸酯类化合物
2015-10-12南淑清赵新娜刘奕尧
张 军,张 丹,彭 华,南淑清,李 贝,赵新娜,刘奕尧
河南省环境监测中心,河南 郑州 450004
酞酸酯类化合物(PAEs)主要用作塑料的增塑剂,增大产品的可塑性和提高产品的强度,也可用作农药载体、驱虫剂、化妆品、香味品、润滑剂和去泡剂的生产原料。近年来,随着工业生产和塑料制品的使用,酞酸酯类不断进入环境,普遍存在于土壤、底泥、水体、生物、空气及大气降尘物等环境样品中,成为环境中无所不在的污染物。酞酸酯可引起哺乳动物嗜睡、脱瘾、条件性维生素缺乏等症状,其中2-(二乙基己基)邻苯二甲酸酯有动物致癌阳性率。当水中邻苯二甲酸二丁酯达0.2 mg/L或2-(二乙基己基)邻苯二甲酸酯达1.0 mg/L时,影响水的自净作用。美国环保局(USEPA)将6种PAEs列为优先控制的有毒污染物,我国也将3种PAEs确定为水中优先控制污染物[1],《化学品风险防控十二五规划》将邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二辛酯(DOP)列入十二五重点防控化学品名录。欧盟25个成员国于2007年1月又禁止和限定了6种PAEs的使用。
环境水样中PAEs前处理方法主要有有机溶剂提取-硅胶柱净化[2]、固相萃取(SPE)[3-5]、固相微萃取(SPME)[6-9]等。液液萃取方法简便,但所用水样体积大,溶剂量也大,检出限较高。采用固相萃取技术富集PAEs,虽可大大降低溶剂的消耗,但仍需采集大量水样,且检出限与前者类似。固相微萃取(SPME)技术是1990年发展起来的样品预处理方法,具有设备简单、样品需要量少、灵敏、快速、简便等诸多优点。文献[10-11]利用SPME技术分别测定了西班牙埃布罗河6种PAEs和江苏太湖、长江泰州段水样中5种PAEs。本文采用SPME技术结合气相色谱(GC)方法,对水中6种PAEs进行了分析测定。所建立的方法具有较低的检出限(LOD),回收率令人满意,能够满足环境水样中痕量PAEs的测定。
1 实验部分
1.1 仪器与试剂
美国7890N气相色谱仪(配有FID检测器);HP-5 毛细管柱(30 m ×0.32 mm ×0.25 μm);加拿大固相微萃取装置(配有 85 μm PA、30 μm PDMS、100 μm PDMS、65 μm PDMS/DVB、50/30 μm DVB/CAR 萃取头);手柄,4 mL专用样品瓶。
包括邻苯二甲酸二甲酯(DMP)、邻苯二甲酸二乙酯(DEP)、邻苯二甲酸二丁酯(DBP)、邻苯二甲酸二辛酯(DOP)、邻苯二甲酸丁基苄基酯(BBP)和邻苯二甲酸(2-乙基己基)酯(DEHP)在内的6种混合标准溶液,质量浓度为1 000 mg/L。
1.2 实验方法
1.2.1 SPME操作方法
在4 mL的萃取瓶中,加入4 mL水样、PAEs混合标样后放入磁子,用聚四氟乙烯垫加铝盖密封。将固相微萃取装置的不锈钢针管插入瓶中,推出萃取头,在一定条件下完成萃取后,取出萃取头,进入气相色谱中解吸1.5 min。
由于PAEs的普遍存在,甲醇、磁子等都可能引入PAEs而影响实验测定结果的准确度。空白校正实验证实了部分PAEs的存在,因而所有测定的峰面积都要减去该空白值。除特别说明外,所有实验平行测定3次。以保留时间定性,以色谱峰面积定量。
1.2.2 气相色谱条件
色谱柱为HP-5毛细管柱(30 m×0.32 mm×0.25 μm)。以高纯氮气(99.999%)为载气,进样口温度为250℃,不分流进样,柱流速为1 mL/min;FID检测器温度为300℃,氢气流量30 mL/min,空气流量为300 mL/min,尾吹气流量为25 mL/min;柱温80℃保持1 min,以10℃/min的速率升至250℃,保持4 min。分离效果见图1。

图1 固相微萃取酞酸酯类物质色谱图
2 结果与讨论
2.1 实验条件的优化
2.1.1 萃取头的选择
取混合标准溶液,配制3份相同浓度的平行水样,分别经涂有 85 μm PA、30 μm PDMS、100 μm PDMS、65 μm PDMS/DVB、50/30 μm DVB/CAR 的固相微萃取头萃取40 min以后,直接进样分析。
PDMS涂层是非极性的,它对极性较强的DMP和 DEP的萃取效率较低。吸附型65 μm PDMS/DVB的涂层为固相膜,材料表面的孔状结构在范德华力和氢键作用下很容易捕捉到分析物。这种涂层对几种目标化合物表现出较好的萃取效果,这与Penalver等[11]的研究结果一样。
2.1.2 固相微萃取方式的选择
选用顶空和浸没2种固相微萃取方式进行萃取实验,结果表明:在相同条件下(转速为300 r/min,温度为70℃),由于目标化合物的沸点较高,顶空提取的效率要远远低于浸没提取。因此,选择的萃取方式为浸没提取。
2.1.3 磁力搅拌转速的影响
固定已选定的固相微萃取条件,改变磁力搅拌转速为 0、300、500、700、900 r/min,从图2 可见,对于 DMP搅拌的影响很小,而对于 DEP、DBP、BBP、DEHP、DOP搅拌能显著提高纤维的富集效率,增大了方法的灵敏度,因此搅拌是必要的。应当通过固定采样瓶的位置及磁场强度来严格控制稳定的搅拌,过慢达不到搅动的效果,过快则易形成旋涡使搅动不稳。DEP、DBP、BBP、DEHP 4种化合物在500 r/min时基本达到平衡,而化合物DOP在转速为700 r/min时达到最大回收。考虑到化合物DOP萃取面积小,转速的改变使得面积变化大,而在700 r/min时其余几种目标化合物相对于各自的最佳转速时的面积变化不大。因此,选择的转速为700 r/min。
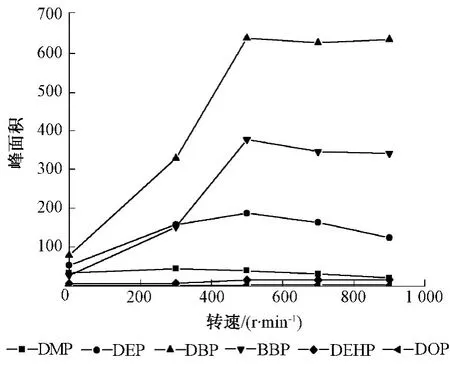
图2 转速对各种目标化合物的影响
2.1.4 萃取温度的影响
选择不同的萃取温度 30、40、50、55、60、65℃,考察温度对目标化合物萃取效果的影响。从图3可见,DMP、DEP这2种化合物在40℃时萃取效果最好,随着温度的增加,萃取效率逐渐降低。DEHP、DOP、DBP、BBP这4种化合物随着温度的增加,萃取效率逐渐增大,60℃时萃取达到平衡。因此,选择的最佳萃取温度为60℃。
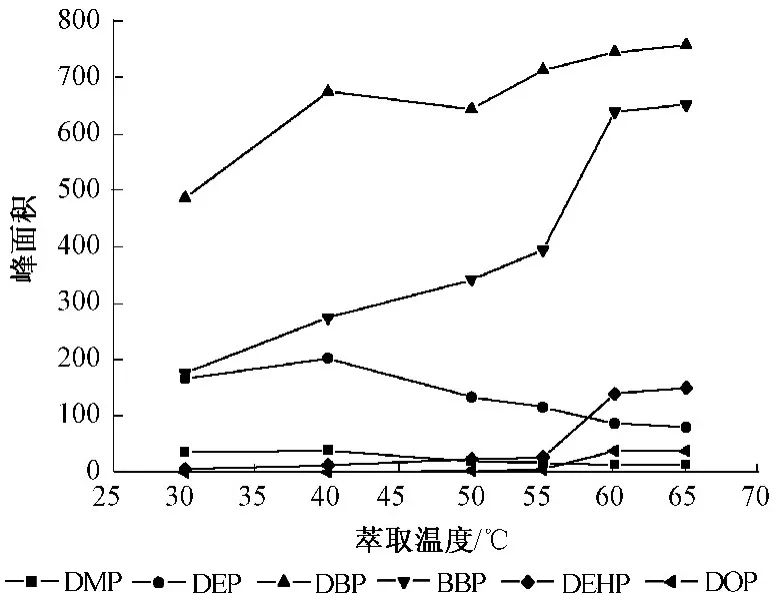
图3 萃取温度的影响
2.1.5 萃取时间的影响
SPME过程是一个逐渐达到平衡的过程,萃取的平衡时间与搅拌速度、固定相的膜厚以及待测物的分配常数、扩散系数、萃取温度有关。高沸点化合物比低沸点化合物需要更长的分析时间。在萃取温度为60℃、转速为700 r/min时,不同的萃取时间与所得到的各种化合物的峰面积关系见图4。从图4可见,DMP、DEP 2种较低沸点的化合物在 20 min就达到最佳效果,DBP、BBP、DEHP、DOP 4种化合物在萃取时间为50 min时,萃取效率最高。最终选择的萃取时间为50 min。
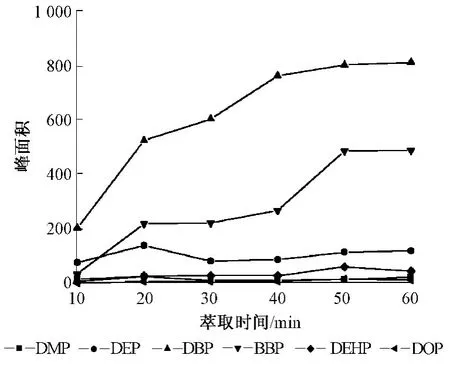
图4 萃取时间的影响
2.1.6 解吸时间的影响
固定已选定的萃取条件,将热解吸时间分别设定为 0.5、1.0、1.5、2.0 min。在色谱进样器中进行热解吸时,由于高温下萃取物的分配系数下降,涂层对待测物的保留很快消失。在同一温度下,待测物解吸的完全与否与解吸时间直接相关,解吸不完全不仅会影响方法的灵敏性,而且会污染后续样品。由图5可见,各种化合物在1.5 min时基本解吸完毕,且将该萃取头进行第2次热解吸时未见样品峰出现。
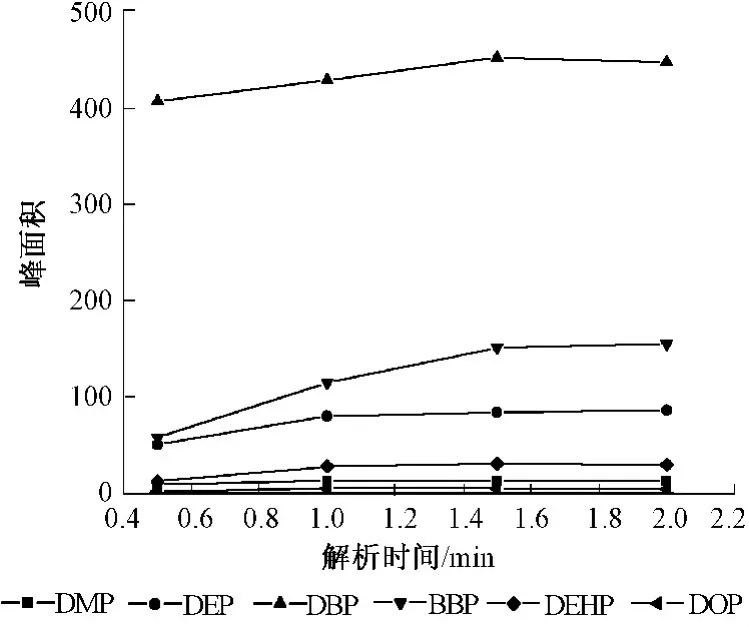
图5 解吸时间的影响
2.2 空白实验及工作曲线
2.2.1 空白实验
由于酞酸酯通过塑料制品等已普遍存在于人们的生活环境中,因此很容易造成实验室的污染,从而导致分析测试结果不真实或浓度偏高。因此,在进行环境样品中酞酸酯类化合物分析时,严格控制各个环节的空白值,保证测定结果的准确性和可靠性。本研究就实验中需要用到的试剂、溶剂、器皿等进行空白实验。
实验中用到的玻璃器皿,放入铬酸中浸泡过夜,再用清水和蒸馏水洗净后烘干使用,对选定的甲醇、丙酮等溶剂进行空白实验,结果表明,所用溶剂均无目标化合物检出。
实验中使用固相微萃取柱,测定前均进行老化程序,确定无目标化合物检出。
2.2.2 工作曲线及检出限
配制一系列的标准溶液,加入水样中,用已选好的条件进行固相微萃取,以质量浓度为横坐标,峰面积为纵坐标进行线性拟合,得到工作曲线。空白样品中加入估计方法检出限的2~5倍的标样萃取检测,平行进行7次,得到方法的检出限。
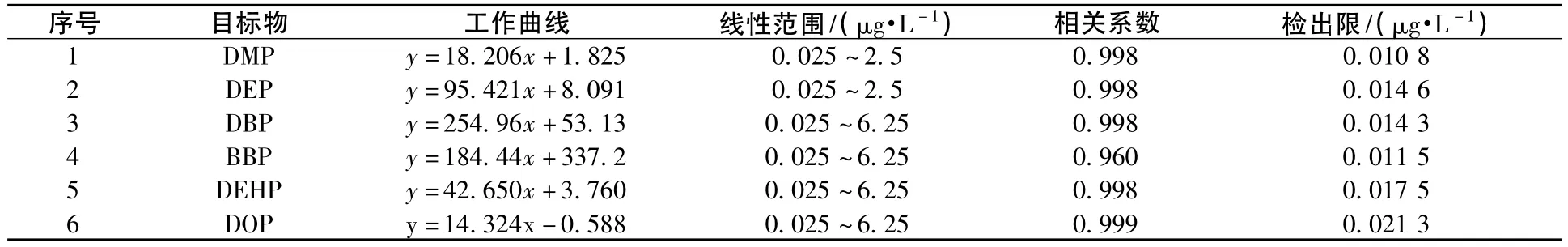
表1 各种化合物的工作曲线和线性范围
2.3 回收率和精密度
在水样中添加6种化合物的混合标准工作溶液,加标水平为 0.025、0.125、0.25 μg/L,分别平行测定7次,获得如表2所示的结果。
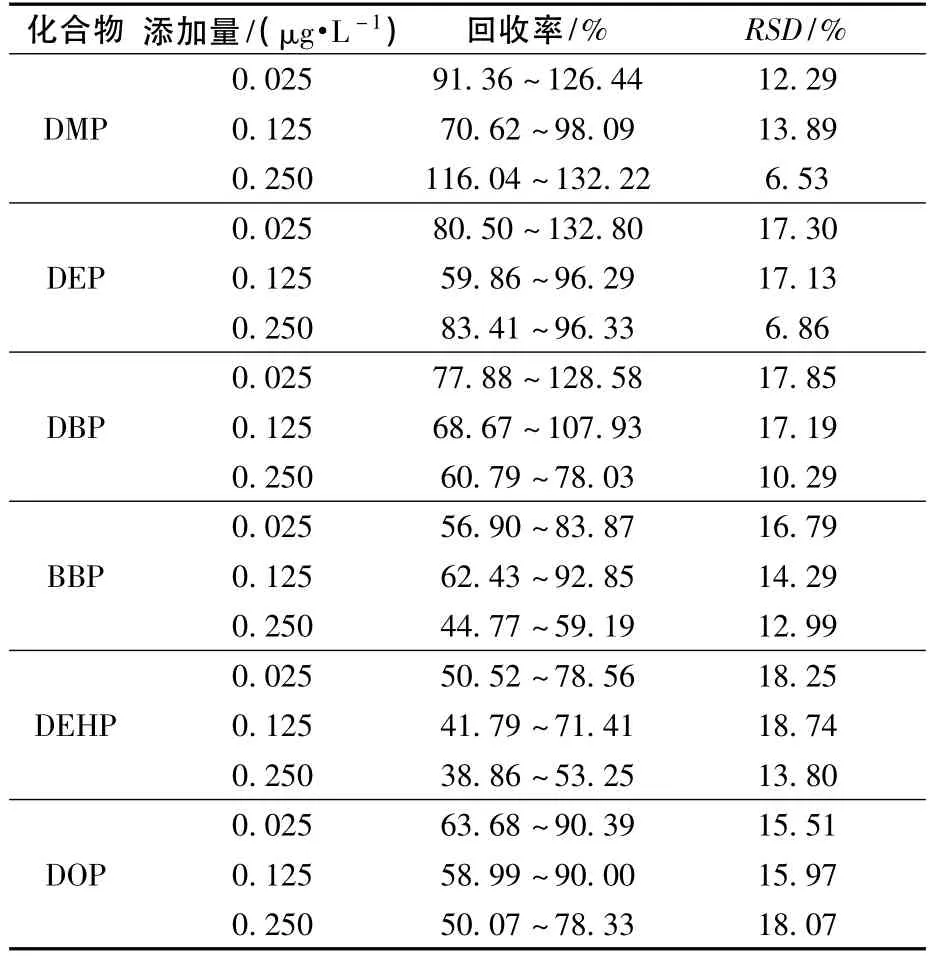
表2 6种化合物在水中的添加回收率和精密度(n=7)
2.4 实际水样的测定
在已选定的最佳萃取条件下测定某制药厂的实际水样,最终测得水样中含有0.018 6 μg/L的DBP。
3 结论
建立了固相微萃取技术结合GC-FID测定水中PAEs的方法,固相微萃取前处理过程中不需有机溶剂,环境友好,适应绿色化学发展的需要。将该方法用于实际水样中6种PAEs的测定,操作简单,灵敏度高,能够满足环境水体中痕量PAEs的测定要求。
[1]周文敏,傅德黔,孙宗光.水中优先控制污染物黑名单[J]. 中国环境监测,1990,6(4):1-3.
[2]Zeng F,Cui K Y,Xie Z Y,et al.Phthalate esters(PAEs):Emerging organic contaminants in agricultural soils in peri urban areas around Guangzhou,China[J].Environmental Pollution,2008,34(3):372.
[3]Liu H C,DenW,Chan S F,et al.Analysis of trace contamination of phthalate esters in ultrapure water using a modified solid-phase extraction procedure and automated thermal desorption-gas chromatography/mass spectrometry[J].J Chromatogr A,2008,1 188(2):286.
[4]戴树桂,张东梅,张仁江,等.固相萃取技术预富集环境水样中邻苯二甲酸酯[J].环境科学,2000,31(2):66-69.
[5]纪雷,王岩,林雨霏,等.水体中邻苯二甲酸酯类污染物在H LB柱净化条件优化的研究[J].分析测试学报,2008,27(7):747-750.
[6]PeÌalver A,PocurullE,BorrullF,et al.Determination of phthalate estersin watersamplesby solid-phase microextraction and gas chromatography with mass spectrometric detection[J].J Chromatogr A,2000,872(1/2):191.
[7]LiX,Zhong M,Xu S F,et al.Determination of phthalates in water samples using polyaniline-based solid-phase microextraction coupled with gas chromatography[J].J ChromatogrA,2006,1 135(1):101-108.
[8]贾宁,许恒智,胡亚丽,等.固相萃取-气相色谱法测定北京市水样中的邻苯二甲酸酯[J].分析试验室,2005,24(11):18-21.
[9]刘岩,高丽,申杰,等.固相微萃取-气相色谱法测定白洋淀水样中的邻苯二甲酸酯类化合物[J].色谱,2010,28(5):517-520.
[10]Penalver A,Pocurull E,Borrull F.Determination of Phthalate Esters in Water Samples by Solid-phase Microextration and Gas Chromatography with Mass Spectrometric Detection[J].J Chromatogr A,2000 ,872:191-201.
