固体电解质Li5La3Ta2O12包覆LiMn2O4的改性研究
2015-10-10彭红建曹远尼肖理红栾向峰刘素琴
彭红建,曹远尼,肖理红,栾向峰,刘素琴
固体电解质Li5La3Ta2O12包覆LiMn2O4的改性研究
彭红建,曹远尼,肖理红,栾向峰,刘素琴
(中南大学化学化工学院,湖南长沙,410083)
采用溶胶−凝胶的方法低温制备石榴石结构的固体电解质Li5La3Ta2O12,并用其包覆LiMn2O4来改善材料的电化学性能。通过XRD,SEM和TEM等表征手段对材料的结构和形貌进行分析,并通过恒电流充放电、循环伏安、交流阻抗等测试分析材料的电化学性能。研究结果表明:Li5La3Ta2O12包覆的LiMn2O4材料与未包覆的材料相比,其电化学性能得到明显改善,经过150次循环后包覆材料的放电比容量保持率为92%,在高倍率10(为倍率)下包覆材料放电比容量为61.2 mA·h/g,而未包覆材料放电比容量仅为40.7 mA·h/g;包覆Li5La3Ta2O12后,LiMn2O4的阻抗明显减小,大幅度提高了其循环性能和倍率性能。
溶胶−凝胶法;Li5La3Ta2O12;包覆;LiMn2O4
锂离子电池具有使用寿命长、能量密度高及携带方便等特点而成为电气设备中不可或缺的一部分,特别是用于电动汽车储能电池和其他便携式电子设备。而LiMn2O4具有低价格、低污染和高电压的优点,被认为是最具潜能的锂离子电池正极材料[1−6]。但LiMn2O4较差的循环性能成为了限制其大规模应用的瓶颈[7−8],其主要原因是锰离子易溶解于电解液。经研究发现,均匀的包覆层能阻止锰离子与电解液直接接触,在很大程度上减小了电池容量的衰减[9−11],目前对LiMn2O4进行包覆采用最多的是金属氧化物[12−16],虽然金属氧化物的包覆能减小了锰离子与有机电解液的接触面积,但由于包覆的金属氧化物不是锂离子导体,对于锂离子的脱出和嵌入有一定的阻碍作用,在一定程度上影响了电极材料的电化学性能[17]。近年来,随着对固体电解质材料的深入研究,出现越来越多的高性能电解质材料。其中,Li5La3Ta2O12(以下简称LLTO)是一种具有石榴石结构的新型的固体电解质材料,因为LLTO结构中存在严重扭曲的八面体氧化物LiO6,为Li+的迁移提供了很大的间隙,能够为电极材料中锂离子的迁移提供了很好的支架[18],有利于锂离子的扩散。另外,LLTO化学性质稳定性好,在高温下不与电极材料发生化学反应且与电极材料具有良好的相容性[19]。为此,本文作者针对LiMn2O4的循环性能差以及包覆材料对锂离子迁移具有阻碍作用等问题,采用溶胶−凝胶的方法低温制备石榴石结构的固体电解质Li5La3Ta2O12,并用其包覆LiMn2O4材料;采用XRD,SEM及TEM等表征手段对材料的结构和形貌进行分析,以及恒电流充放电、循环伏安、交流阻抗等方法来测试分析材料的电化学性能,以期提高LiMn2O4材料的电化学性能。
1 实验
1.1 主要试剂
试剂为氢氧化锂、硝酸锰、硝酸锂,广东西陇化工有限公司生产;硝酸镧、五氧化二钽、N-甲基吡咯烷酮(NMP),上海市国药集团生产;聚偏氟乙烯(PVDF)、乙炔黑,天津市科密欧化学试剂有限公司生产;乙二胺四乙酸(EDTA)、柠檬酸,天津市恒兴化学试剂制造有限公司生产;LiPF6电解液,深圳宝嘉能源有限公司生产;金属锂片,上海化学试剂公司生产。所有化学试剂均为分析纯。
1.2 锰酸锂的制备
1.3 包覆材料制备
将五氧化二钽溶于 (NH4)2C2O4-H2C2O4的饱和溶液,再将氢氧化锂、硝酸镧和EDTA分别加入此溶液中,其中:::=5.75:3.00:2.00: 1.60。放入恒温90 ℃油浴锅中加热1 h,然后将与LLTO的质量比即(LLTO):(LiMn2O4)=1:9的 LiMn2O4加入该溶液加热24 h,得到LLTO包覆的LiMn2O4前驱体。将生成的混合前驱体置于750 ℃下煅烧12 h,即得到LLTO包覆的LiMn2O4粉末。
1.4 极片材料的制备
将LiMn2O4或包覆LLTO的LiMn2O4和乙炔黑、PVDF(或::= 8:1:1)混合研磨2 h,将混合粉末溶于适量NMP中研磨20 min形成料浆,用厚度为0.1 mm涂布器将料浆均匀涂布在铝箔上并置于60 ℃真空干燥箱中干燥 12 h,并将制成的材料切成直径为10 mm的极片。
1.5 样品表征
采用日本理学Rigaku D/max 2550 铜靶KX线衍射仪(XRD)对材料进行结构分析。其中:铜靶K射线波长=0.154 056 nm,扫描范围为10°~70°。
采用日本JSM−6390LV扫描电镜(SEM)对材料的形貌进行分析,并采用EDS分析功能分析材料的组成元素。
1.6 电化学性能分析
采用CHI660C电化学工作站(上海辰华仪器有限公司生产)对电池进行循环伏安测试,扫描速度为0.1 mV/s。采用Partat2273电化学工作站(美国的AMETEK 子公司Princeton Applied Research 公司生产)对电池进行交流阻抗测试,在1(其中,为倍率)下循环40次后进行交流阻抗测试,工作频率设置为50 mHz至500 kHz,AC设置为5 mV。采用LAND电化学工作站(深圳市六维科技有限公司生产)对电池进行初次充放电、循环性能、倍率性能的测试,其中初次充放电和循环性能在1下进行,充放电电压为3.5~4.3 V,测试温度为25 ℃。
2 结果与讨论
2.1 XRD分析
Li5La3Ta2O12,LiMn2O4和LLTO包覆的LiMn2O4的XRD图如图1所示。从图1可以看出:与 LiMn2O4的XRD图谱相比,LLTO包覆的LiMn2O4的XRD图谱中在相同位置与LiMn2O4出现了相同的峰,说明包覆LLTO没有明显改变LiMn2O4的结构。从LLTO包覆后LiMn2O4的XRD图谱中可以看出:在16.89°,29.81°,34.23°和53.45°时出现了强度很弱的峰,与Li5La3Ta2O12的XRD图相比较,包覆材料中Li5La3Ta2O12的存在说明Li5La3Ta2O12已包覆在LiMn2O4上。
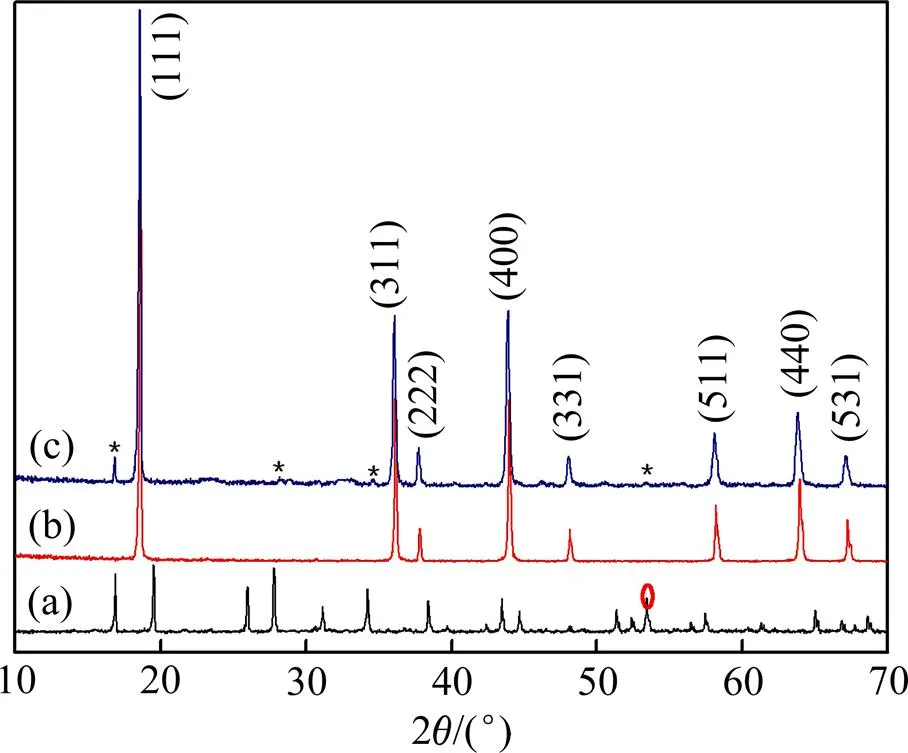
(a) Li5La3Ta2O12; (b) LiMn2O4; (c)包覆LiMn2O4的LLTO
2.2 SEM,EDS及TEM分析
未包覆LiMn2O4和LLTO包覆的LiMn2O4的扫描电镜图(SEM)和能谱图(EDS)分别如图2和图3所示。从图2和图3可以看出:未包覆材料颗粒的棱角和边界比较清晰,说明了其良好的结晶;LLTO包覆的LiMn2O4颗粒的棱角圆润,这可能与LLTO的引入有关。从EDS图可以看出:包覆材料中含有La和Ta元素,说明在包覆材料中有LLTO存在。
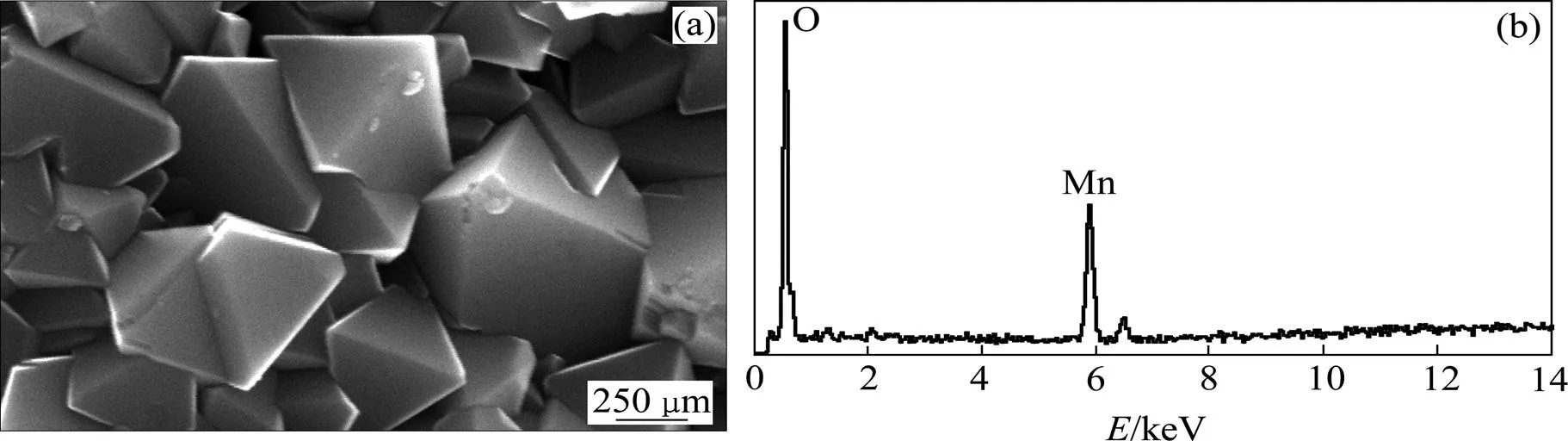
(a) SEM;(b) EDS
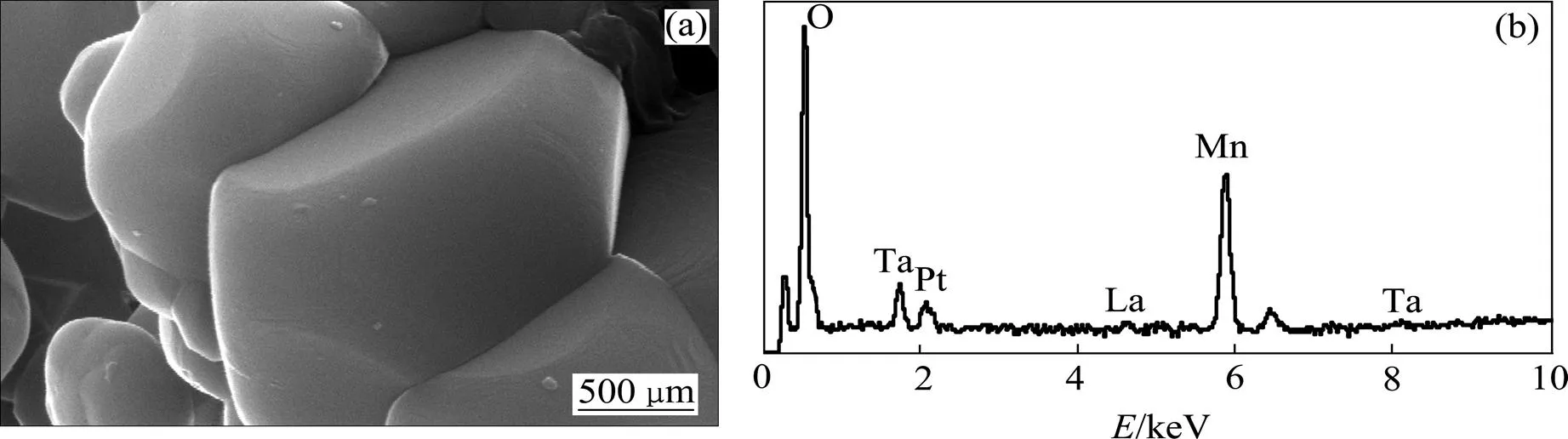
(a) SEM;(b) EDS
LLTO包覆的LiMn2O4的透射电镜图(TEM)如图4所示。从图4可以看出:LLTO包覆的LiMn2O4材料的晶面间距非常均匀,晶面间距约为0.25 nm,对应于LiMn2O4的(311) 晶面,LiMn2O4晶面外侧有明显的不同于LiMn2O4的晶格网面。经测定其网面间距并与XRD图谱数据进行比较,其间距对应于LLTO的第24个峰(即图1(a)所标记的峰),表明LLTO已包覆于LiMn2O4上。

图4 包覆LLTO的LiMn2O4的透射电镜图(TEM)
2.3 电化学性能测试
LLTO包覆的LiMn2O4及LiMn2O4的循环伏安曲线如图5所示,其纵坐标的正半轴对应氧化峰,负半轴对应还原峰。从图5可以看出:2个材料的循环伏安曲线都出现了2对氧化−还原峰,分别对应Li+的脱出和嵌入;与未包覆LiMn2O4的循环伏安曲线相比,LLTO包覆的LiMn2O4的循环伏安曲线的氧化峰向低电位移动,而还原峰向高电位移动,氧化峰和还原峰之间的电位差明显减小,表明包覆LLTO后,材料的极化减小[20],对锂离子的脱出和嵌入更有利,且LLTO包覆的LiMn2O4的氧化还原峰强度明显高于LiMn2O4,说明包覆LLTO后材料的活性比未包覆的好。
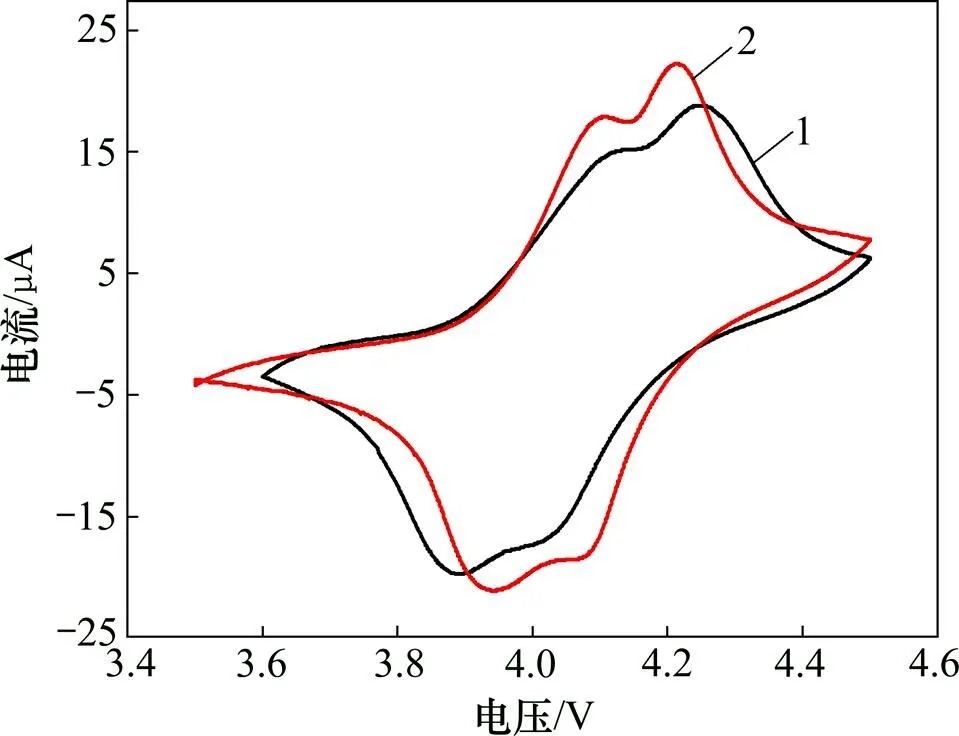
1—LiMn2O4; 2—包覆LiMn2O4的LLTO
包覆LLTO的LiMn2O4和未包覆LiMn2O4的首次充放电曲线如图6所示。从图6可以看出:2种材料的充放电曲线皆出现了2个电压平台,表明锂的嵌入和脱出是分2步进行的[21−22]。其中,LLTO包覆的LiMn2O4的充电平台低于LiMn2O4的充电平台,放电平台高于LiMn2O4的放电平台,说明经过LLTO包覆的LiMn2O4材料极化减小;LLTO包覆的LiMn2O4在1下的首次充放电容量为100.4 mA·h/g和100.3 mA·h/g,LiMn2O4的首次充放电容量均为102.2 mA·h/g。这是因为在相同质量的极片材料中,LLTO包覆的LiMn2O4的极片材料中LLTO具有一定质量,其活性物质变少,所以,LLTO包覆材料容量比未包覆材料的容量低。
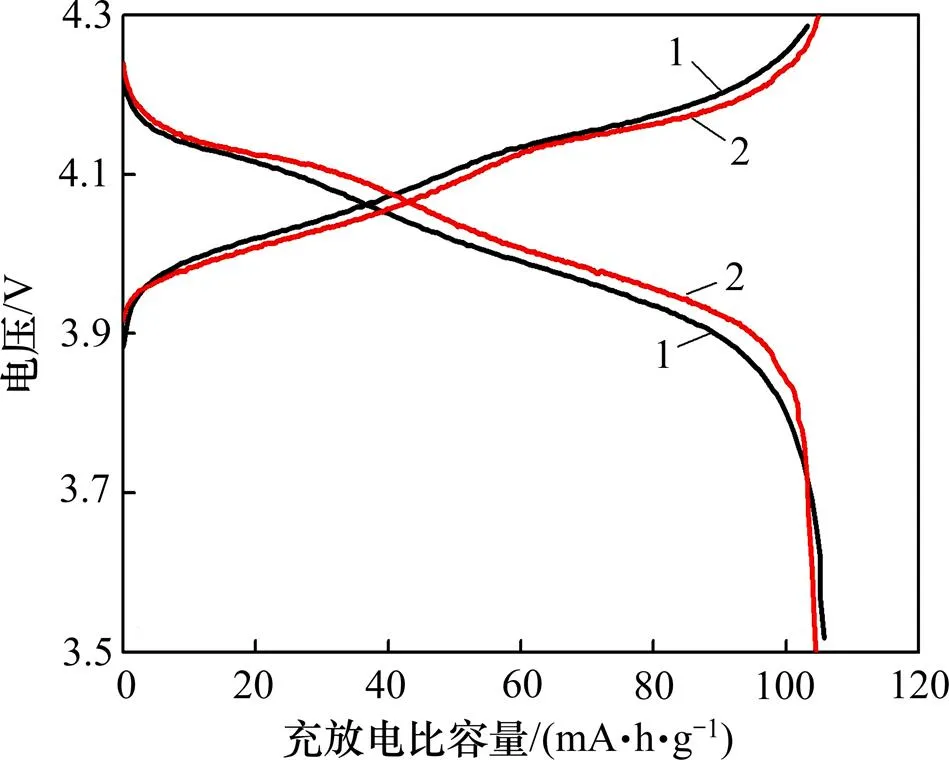
1—LiMn2O4; 2—包覆LiMn2O4的LLTO
LLTO包覆的LiMn2O4和LiMn2O4在1倍率下充放电循环150次的循环性能图如图7所示。从图7可以看出:循环150次后,LLTO包覆的LiMn2O4的放电比容量从100.2 mA·h/g衰减到91.8 mA·h/g,容量保持率为92%,而未包覆的LiMn2O4的放电比容量从102.2 mA·h/g衰减到86.6 mA·h/g,容量保持率仅为84.7%。可见:LiMn2O4包覆LLTO后,循环性能和放电比容量保持率均得到很大提高。这主要是因为LiMn2O4包覆LLTO后,LiMn2O4和电解液直接接触的面积变小,缓解了锰离子在电解液中的溶解,从而改善了材料的电化学性能。
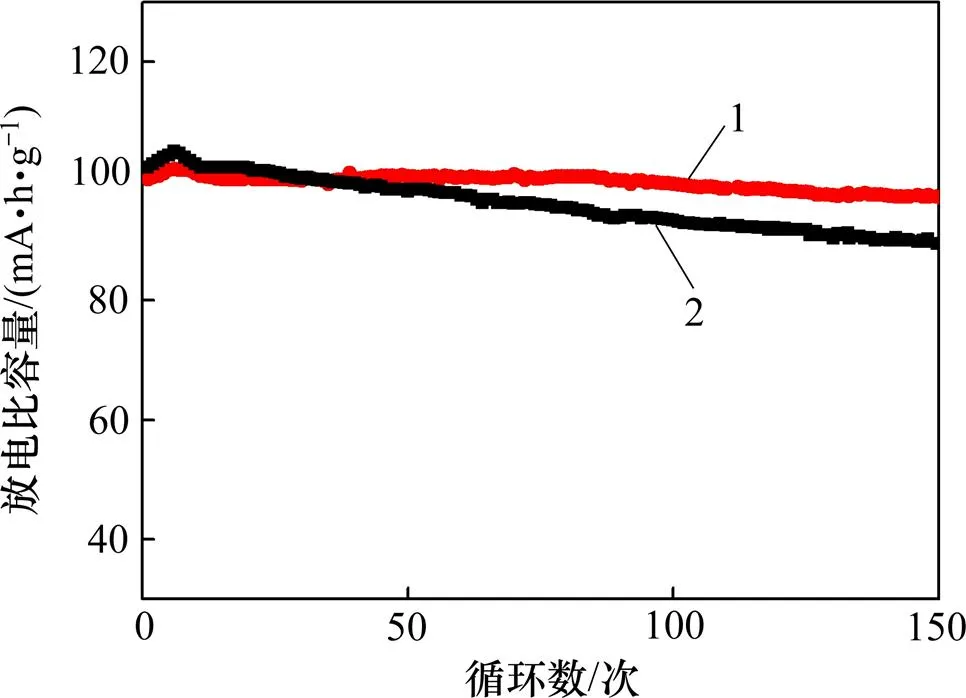
1—包覆LiMn2O4的LLTO; 2—LiMn2O4
LLTO包覆的LiMn2O4和LiMn2O4在0.5,1.0,1.5,2.0,5.0和10.0的倍率性能图如图8所示。从图8可以看出:随着电流倍率的增加,这2种材料的放电容量均逐渐减少;在0.5时,LLTO包覆材料的放电比容量与LiMn2O4的放电比容量分别为117.6 mA·h/g和110.2 mA·h/g;在2时LLTO包覆材料的放电比容量与LiMn2O4的放电比容量分别为71.9 mA·h/g和79.6 mA·h/g;在10时,LLTO包覆材料的放电比容量与LiMn2O4的放电比容量分别为61.2 mA·h/g和40.7 mA·h/g,LLTO包覆材料的放电比容量比LiMn2O4的放电比容量高出21 mA·h/g。可以明显看出:包覆LLTO后LiMn2O4的高倍率性能明显提高。这是因为与LiMn2O4相比,包覆的LiMn2O4电极材料在结构稳定的LLTO层的保护下有效地抑制了锰离子的溶解,使得参与电化学反应的锰离子较多存在,随着电流的增大,其放电比容量的衰减速度明显比未包覆材料的低。
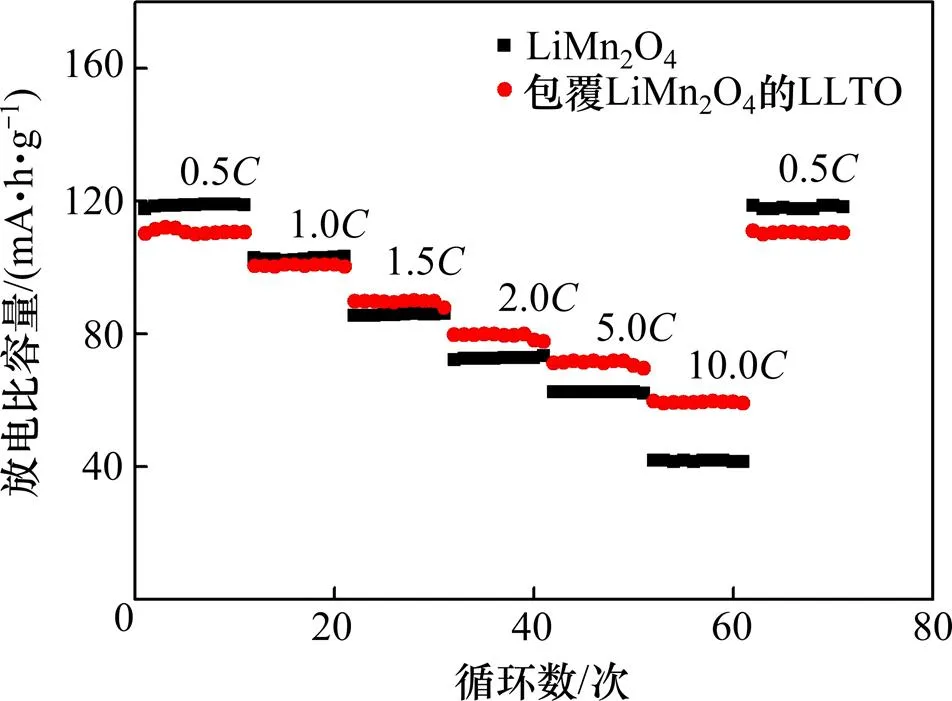
图8 未包覆LiMn2O4和LLTO包覆LiMn2O4在不同倍率下放电比容量随循环的变化
未包覆LiMn2O4和LLTO包覆的LiMn2O4循环10次后的交流阻抗(EIS)如图9所示。从图9可以看出:2种材料的交流阻抗图都是由高频区域1个拉长压扁半圆、中频区域1个圆弧和低频区域的1条斜线三部分组成。Liu等[23−25]认为,高频区域的半圆反映了锂离子在SEI膜中迁移的阻抗,中频区域的半圆则与电荷转移有关,低频区域的斜线反映锂离子扩散过程的Warburg阻抗。从图9中的放大图可以看出:LLTO包覆的LiMn2O4材料的SEI膜阻抗比LiMn2O4的小,这说明包覆层LLTO有利于减少活性物质和电解液直接接触,使SEI膜的形成受阻,导致SEI膜阻抗降低。从图9还可以看出:LLTO包覆的LiMn2O4的电荷转移阻抗明显比未包覆的LiMn2O4的小,使得材料的极化减小,与循环伏安的结果一致,也证实了包覆材料的倍率性能比未包覆材料的好。
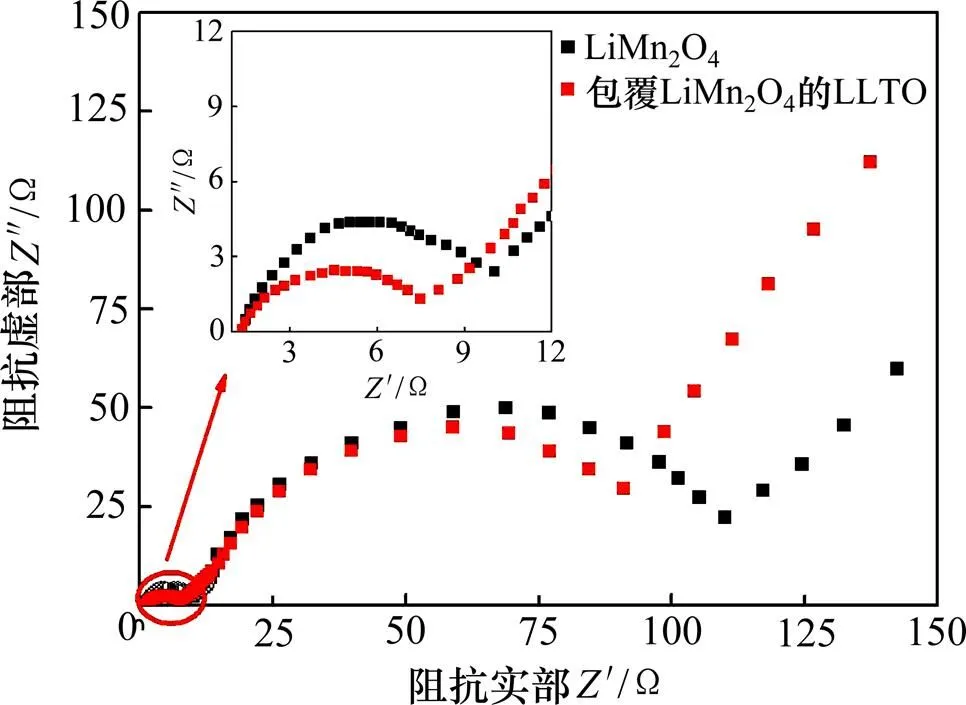
图9 未包覆LiMn2O4和LLTO包覆的LiMn2O4在循环10次后的交流阻抗图
有关低频区域和锂离子扩散有关的Warburg阻抗可以通过以下公式[26]进行分析:
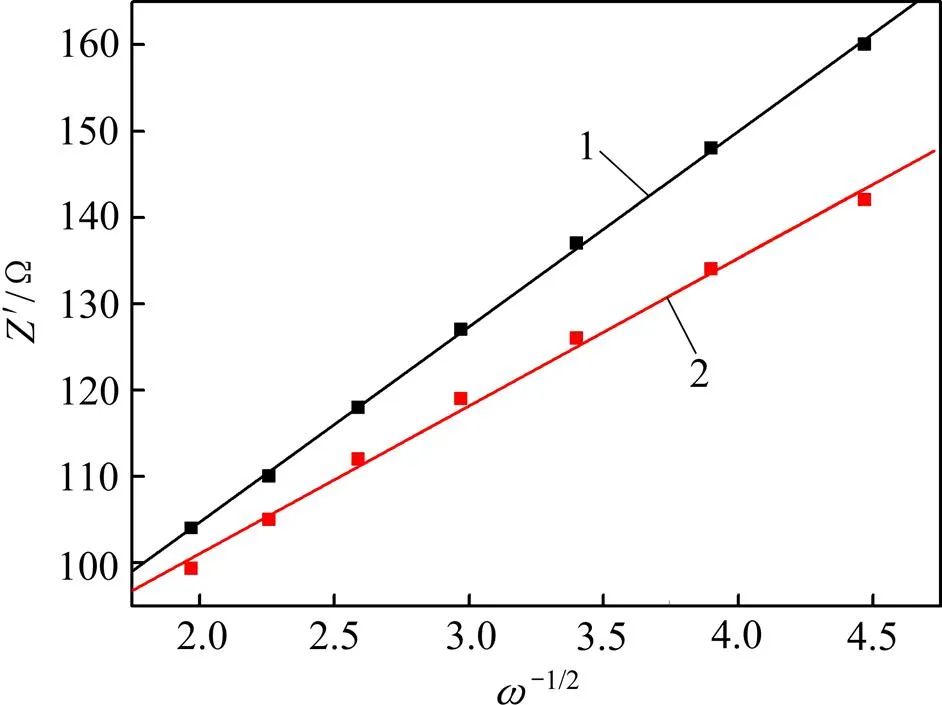
1—LiMn2O4; 2—包覆LiMn2O4的LLTO
3 结论
1) 采用溶胶−凝胶法低温制备了固体电解质Li5La3Ta2O12,并对LiMn2O4进行包覆改性研究。包覆LLTO对LiMn2O4材料的形貌及结构没有显著改变;LLTO包覆于LiMn2O4上;包覆材料循环150次后放电比保持率为92%,而未包覆材料循环150次后放电比容量保持率仅为84.7%。包覆LLTO后,LiMn2O4的循环性能得到显著改善。
2) 0.5时,LLTO包覆材料的放电比容量与LiMn2O4的放电比容量分别为117.6 mA·h/g和110.2 mA·h/g;2时LLTO包覆材料的放电比容量与LiMn2O4的放电比容量分别为79.6 mA·h/g和71.9 mA·h/g;10时,LLTO包覆材料的放电比容量与LiMn2O4的放电比容量分别为61.2 mA·h/g和40.7 mA·h/g,LLTO包覆材料的放电比容量与LiMn2O4的放电比容量高出21 mA·h/g。包覆LLTO后,LiMn2O4的倍率性能明显提高。
3) 相对于未包覆材料,LLTO包覆的LiMn2O4材料的SEI膜阻抗、电荷转移阻抗及Warburg阻抗明显减小,因此,LLTO包覆LiMn2O4材料后,大幅度提高了其材料的循环性能和倍率性能。
[1] 李运娇, 常建卫, 李洪桂, 等. 富锂型掺钴尖晶石锂锰氧化物的结构与电化学性能[J]. 中南大学学报(自然科学版), 2004, 35(3): 381−385. LI Yunjiao, CHANG Jianwei, LI Honggui, et al. Structure and electrochemical performance LiMn2O4of Li-rich spinel lithium manganese oxide with doping cobalt[J]. Journal of Central South University (Science and Technology), 2004, 35(3): 381−385.
[2] Thackeray M M. Manganese oxides for lithium batteries[J]. Progress in Solid State Chemistry, 1997, 25(1): 1−71.
[3] 陈立宝, 贺跃辉, 汤义武. 采用固相配位法制备超细LiMn2O4正极材料[J]. 中南大学学报(自然科学版), 2005, 36(3): 390−395. CHEN Libao, HE Yuehui, TANG Yiwu. Preparation of ultrafine LiMn2O4cathode materials by solid state coordination method[J]. Journal of Central South University (Science and Technology), 2005, 36(3): 390−395.
[4] Thackeray M M. Structural considerations of layered and spinel lithiated oxides for lithium ion batteries[J]. Journal of the Electrochemical Society, 1995, 142(8): 2558−2563.
[5] Etacheri V, Marom R, Elazari R, et al. Challenges in the development of advanced Li-ion batteries: A review[J]. Energy & Environmental Science, 2011, 4(9): 3243−3262.
[6] SUN Huaibing, CHEN Yungui, XU Chenghao, et al. Electrochemical performance of rare-earth doped LiMn2O4spinel cathode materials for Li-ion rechargeable battery[J]. Journal of Solid State Electrochemistry, 2012, 16(3): 1247−1254.
[7] Hibino M, Nakamura M, Kamitaka Y, et al. Improvement of cycle life of spinel type of lithium manganese oxide by addition of other spinel compounds during synthesis[J]. Solid State Ionics, 2006, 177(26/32): 2653−2656.
[8] LIU Dongqiang, LIU Xingquan, HE Zezheng. Surface modification by ZnO coating for improving the elevated temperature performance of LiMn2O4[J]. Journal of Alloys and Compounds, 2007, 436(1): 387−391.
[9] LIU Dongqiang, HE Zeqiang. Increased cycling stability of AlPO4-coated LiMn2O4for lithium ion batteries[J]. Materials Letters, 2007, 61(25): 4703−4706.
[10] Moon H S, Lee S W, Lee Y K, et al. Characterization of protective-layer-coated LiMn2O4cathode thin films[J]. Journal of Power Sources, 2003, 119(10/11): 713−716.
[11] LIUJinlian, WU Xianming, CHEN Shang, et al. Enhanced high temperature performance of LiMn2O4coated with Li3BO3solid electrolyte[J]. Bulletin of Materials Science, 2013, 36(4): 687−691.
[12] Kim W K, Han D W, Ryu W H, et al. Al2O3coating on LiMn2O4by electrostatic attraction forces and its effects on the high temperature cyclic performance[J]. Electrochimica Acta, 2012, 71: 17−21.
[13] Arumugam D, Kalaignan G P. Synthesis and electrochemical characterization of nano-CeO2-coated nanostructure LiMn2O4cathode materials for rechargeable lithium batteries[J]. Electrochimica Acta, 2010, 55(28): 8709−8716.
[14] MING Hai, YAN Yuerong, MING Jun, et al. Gradient V2O5surface-coated LiMn2O4cathode towards enhanced performance in Li-ion battery applications[J]. Electrochimica Acta, 2014, 120: 390−397.
[15] Ha H W, YUN Nanji, Kim K. Improvement of electrochemical stability of LiMn2O4by CeO2coating for lithium-ion batteries[J]. Electrochimica Acta, 2007, 52(9): 3236-3241.
[16] LIU Qiuling, WANG Shengping, TAN Haibo, et al. Preparation and doping mode of doped LiMn2O4for Li-Ion batteries[J]. Energies, 2013, 6(3): 1718−1730.
[17] 吴显明, 谭磊, 李明, 等. 固体电解质包覆 LiMn2O4正极材料的合成及表征[J]. 精细化工, 2011, 28(2): 116−119. WU Xianming, TAN Lei, LI Ming, et al. Synthesis and characterization of the cathode material of LiMn2O4coated bysolid electrolyte[J]. Fine Chemicals, 2011, 28(2): 116−119.
[18] PENG Hongjian, WU Qing, XIAO Lihong. Low temperature synthesis of Li5La3Nb2O12with cubic garnet-type structure by sol–gel process[J]. Journal of Sol–Gel Science and Technology, 2013, 66(1): 175−179.
[19] O’Callaghan M P, Lynham D R, Cussen E J, et al. Structure and ionic-transport properties of lithium-containing garnet Li3Ln3Te2O12(Ln=Y, Pr, Nd, Sm-Lu)[J]. Chemistry of Materials, 2006, 18(19): 4681−4689.
[20] Thangadurai V, Kaack H, Weppner W. Novel fast lithium ion conduction in garnet-type Li5La3M2O12(M=Nb, Ta)[J]. Journal of the American Ceramic Society, 2003, 86(3): 437−440.
[21] Gnanaraj J S, Pol V G, Gedanken A, et al. Improving the high-temperature performance of LiMn2O4spinel electrodes by coating the active mass with MgO via a sonochemical method[J]. Electrochemistry Communications, 2003, 5(11): 940−945.
[22] Eriksson T, Hjelm A K, Lindbergh G, et al. Kinetic study of LiMn2O4cathodes by In situ XRD with constant-current cycling and potential stepping[J]. Journal of the Electrochemical Society, 2002, 149(9): A1164−A1170.
[23] Liu W, Farrington G C, Chaput F, et al. Synthesis and electrochemical studies of spinel phase LiMn2O4cathode materials prepared by the pechini process[J]. Journal of the Electrochemical Society, 1996, 143(3): 879−884.
[24] Aurbach D, Gamolsky K, Markovsky B, et al. The study of surface phenomena related to electrochemical lithium intercalation into LiMOhost materials (M=Ni, Mn)[J]. Journal of the Electrochemical Society, 2000, 147(4): 1322−1331.
[25] Aurbach D, Levi M D, Gamulski K, et al. Capacity fading of LixMn2O4spinel electrodes studied by XRD and electroanalytical techniques[J]. Journal of Power Sources, 1999, 81(8): 472−479.
[26] Aurbach D, Levi M D, Levi E, et al. Common electroanalytical behavior of Li intercalation processes into graphite and transition metal oxides[J]. Journal of the Electrochemical Society, 1998, 145(9): 3024−3034.
Modification of Li5La3Ta2O12coated LiMn2O4
PENG Hongjian, CAO Yuanni, XIAO Lihong, LUAN Xiangfeng, LIU Suqing
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083, China)
LiMn2O4,Li5La3Ta2O12(LLTO) was prepared by sol−gel method and it was employed as a coating layer on the surface of LiMn2O4. The structure and morphology of the material were analyzed by XRD, SEM and other characterization methods. The electrochemical performance of the material was analyzed by galvanostatic charge-discharge experiments, cyclic voltammetry and electrochemical impedance spectroscopy. The results show that the electrochemical performance of the LLTO-coated LiMn2O4is improved significantly. The resistance of LLTO-coated LiMn2O4is reduced significantly. After 150 cycles test, the discharge capacity retention rate of the coated material is 92%.At the high-rate of 10, the discharge capacity of the LLTO-coated LiMn2O4is 61.2 mA·h/g and that of the uncoated material is 40.7 mA·h/g. The impedance of LLTO-coated LiMn2O4decreases evidently, therefore the cycle performance and rate capability increase greatly.
sol−gel method; Li5La3Ta2O12; coating; LiMn2O4
10.11817/j.issn.1672-7207.2015.05.004
TG174.451
A
1672−7207(2015)05−1595−07
2014−06−12;
2014−08−22
国家自然科学基金资助项目(51372278);湖南省科技厅项目(2010RS4015);湖南省知识产权局项目(2014e004);中南大学贵重仪器设备共享基金资助项目(CSUZC2014020) (Project(51372278) supported by the National Natural Science Foundation of China; Project(2010RS4015) supported by the Science and Technology Bureau of Hunan Province; Project(2014e004) supported by Hunan Province Intellectual Property Bureau; Project(CSUZC2014020) supported by the Open-End Fund for the Valuable and Precision Instruments of Central South University)
彭红建,副教授,从事新能源材料研究;E-mail: phj108@163.com
(编辑 陈灿华)
