真菌SF—21483产生的活性物质分离纯化及初步确认
2015-10-09张亚妮等
张亚妮等


摘要:从武汉地区土壤中分离得到一株真菌菌株SF-21483,其发酵液具有较强的抑制真菌的作用。本研究以真菌SF-21483发酵提取物中的活性代谢产物为研究对象,应用高效制备液相色谱经过2次分离纯化,得到了5个化合物。根据紫外吸收光谱、分子离子峰、物理性状及活性情况等确定组分4、5、7、9、10与冬青生菌素(Ilicicolin)F、E、D、C、H较为相似,对植物病原菌生物活性测试表明,该类组分具有较强的抗菌作用。
关键词:真菌菌株SF-21483;农药活性物质;分离;纯化;冬青生菌素(Ilicicolin)
中图分类号:S482.2 文献标识码:A 文章编号:0439-8114(2015)17-4188-04
DOI:10.14088/j.cnki.issn0439-8114.2015.17.020
从微生物中筛选天然物质始于1929年青霉素的发现,自20世纪40年代,至今已发现一万余种抗菌素[1]。微生物在其生长过程中会产生一些初生及次生代谢产物。农用抗生素是微生物产生的次级代谢产物,可用于防治农业有害生物,是一类用途很广泛、 产业化程度很高的生物农药[2]。本研究在武汉某地土样中分离得到一株真菌菌株(编号为SF-21483),对SF-21483的发酵提取物进行化学成分的分析,从中分离到5个化合物,研究包括真菌SF-21483的发酵、提取、分离纯化,初步确定其结构及生物学活性。
1 材料与方法
1.1 材料
1.1.1 培养基 种子培养基:麦芽糖6.25 g,麦芽提取物6.25 g,酵母提取物1.00 g,磷酸二氢钾1.25 g,硫酸镁 0.625 g,蛋白胨 0.625 g,琼脂粉15.00 g,去离子水1 000 mL。
摇瓶发酵培养基:葡萄糖 72.00 g,蛋白胨8.00 g,酵母提取物4.00 g,磷酸二氢钾2.00 g,硫酸镁1.00 g,盐酸硫胺0.10 g,pH 6.0,去离子水1 000 mL。
1.1.2 主要仪器 Water 2695高效液相色谱仪(Waters 996二级管阵列检测器,色谱工作站MasslynxV4.0),高效制备液相色谱仪(Waters2525泵,带2767自动收集系统,2996二级管阵列检测器,色谱工作站MasslynxV4.0);高效液相色谱-质谱联用仪:Waters 2695高效液相色谱系统,美国Micromass Quattro micro?誖质谱仪(电喷雾离子源(ESI)),Masslynx V4.1液质联用分析软件。
1.1.3 主要试剂 甲醇(色谱纯,德国CNW),乙腈(色谱纯,德国CNW),去离子水(Millipore)。液质联用分析所用的高纯氮气购自武汉和远汉盛气体有限公司,纯度为99.999%。
1.1.4 菌株来源 真菌菌种SF-21483由湖北省农业科学院生物农药工程研究中心分离、保存。黄色镰刀菌(Fusarium culmorum)、立枯丝核菌(Rhizoctonia solani)、葡萄灰霉(Botrytis cinema)、小麦颖枯病菌(Septoria nodorum)、番茄早疫菌(Alternaria solani),由湖北省农业科学院生物农药工程研究中心提供。
1.2 色谱条件
1.2.1 分析条件 色谱柱:美国Sunfire?誖 C18 柱,150 mm×2.1 mm(i.d),粒径3.5 μm。柱温40 ℃。流动相:A.去离子水;B.乙腈(梯度洗脱)。进样量3 μL。流速0.3 mL/min。检测条件:PDA全波长扫描。
1.2.2 制备条件 色谱柱:美国Sunfire?誖 OBD C18 Prep柱,250 mm×19 mm(i.d),粒径10 μm。柱温室温。流动相:A.去离子水;B.乙腈(梯度洗脱)。进样量3 000 μL。流速27 mL/min。检测条件:PDA全波长扫描。
1.2.3 质谱检测条件 MS条件:电喷雾电离(ESI),毛细管电压为3.5 kV,锥孔电压为45 V,离子源温度为100 ℃,脱溶剂温度为300 ℃,脱溶剂气体流速500 L/h,锥孔气体流速为50 L/h。
1.3 方法
1.3.1 种子培养 用无菌接种环从斜面中取少量孢子或菌丝转入种子培养基中,在旋转式摇床上28 ℃、130~140 r/min培养96 h。每次每菌株准备10瓶。移种前,对每瓶种子进行取样镜检,以排除有污染的摇瓶。
1.3.2 摇瓶发酵 待种子培养好时,转入500 mL锥形瓶中装样100 mL,接种后的锥形瓶置于旋转式摇床上28 ℃、130~140 r/min培养7 d。
1.3.3 活性物质的提取 将真菌SF-21483发酵液离心,分别将菌丝体和上清用乙酸乙酯进行提取2次,合并提取液,真空减压浓缩至干,加入适量甲醇,离心,备用。
1.3.4 活性成分分布 取少量备用液进行半制备,所用色谱柱为美国Sunfire?誖C18反相柱(10 μm,250 mm×10 mm), 进样体积800 μL,柱温为室温,流速为7.5 mL/min,流动相为乙腈和去离子水,采用梯度洗脱,乙腈的浓度在25 min内由5%变至100%。每分钟收集一个组分,用干净空气吹干后进行生物活性测定,确定活性成分分布位置。
1.3.5 纯品的制备 根据1.3.4活性分布结果,确定活性部位的保留时间。先采用分析液相摸索出适合活性化合物分离的流动相梯度。然后将此梯度直接放大到制备液相中,分离纯化出活性物质单组分,制备时所用色谱柱为美国Sunfire?誖prep-C18反相柱(5 μm,19 mm×250 mm), 进样体积2 000 μL,柱温为室温,流速为27 mL/min。
1.3.6 组分纯度及分子量的测定 将1.3.5分离纯化的单组分化合物干燥,溶于色谱级甲醇中,取1 mL于LC-MS检测,确定化合物的纯度及分子离子峰,根据紫外吸收光谱、分子离子峰及碎片离子判断化合物的归属。
2 结果与分析
2.1 真菌SF-21483发酵提取物中活性组分的测定
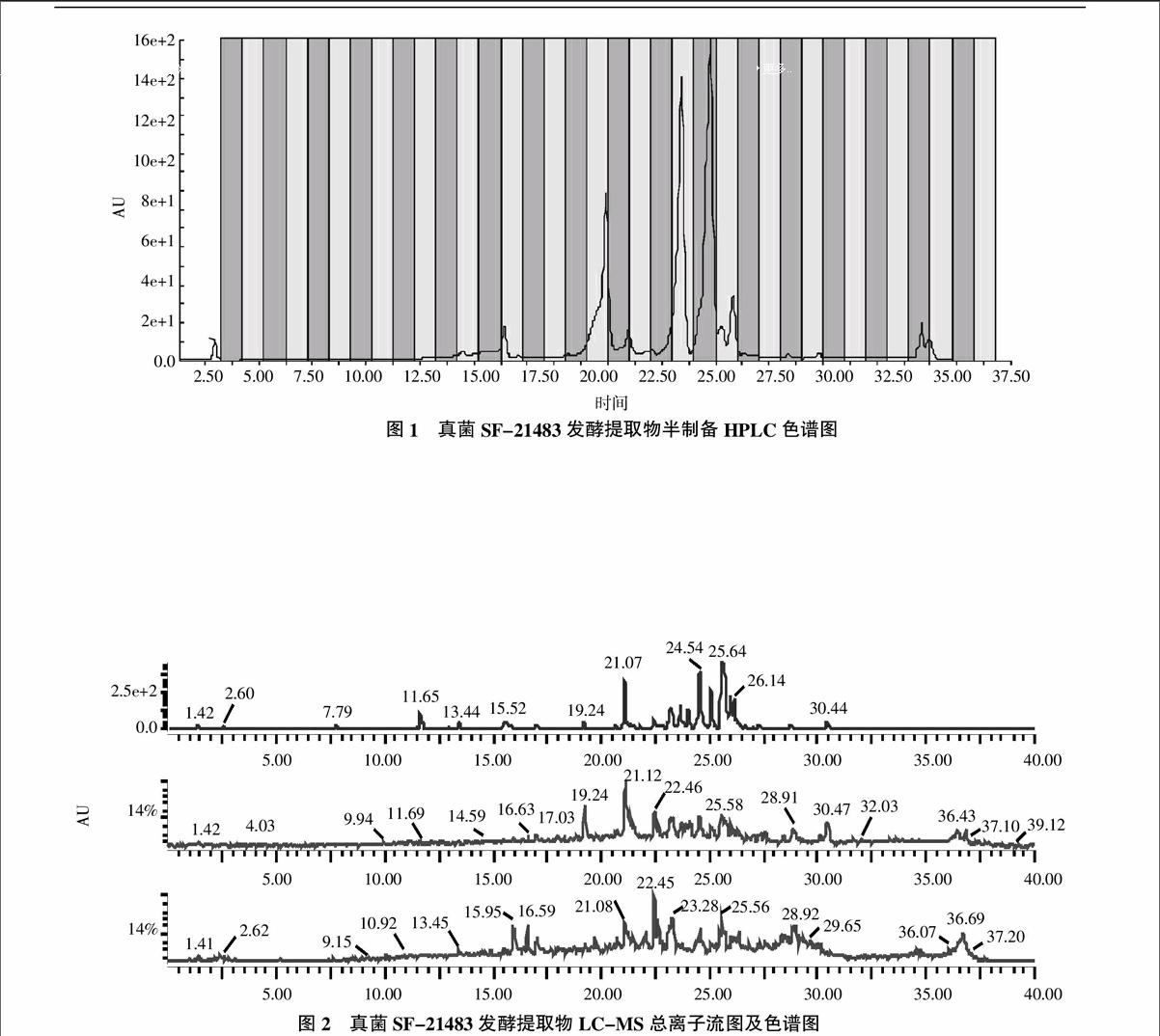
半制备活性跟踪试验显示,主要活性组分出现在20~26 min内。结果表明,此段组分具有较强的抗真菌活性,其余保留时间均无活性(图1)。通过图1可知,20~26 min的组分主要有peak19.90、peak23.42、peak24.77和peak25.82。
2.2 真菌SF-21483活性化合物的分离纯化
根据2.1活性分布结果,明确活性部位的保留时间分布在20~26 min。由此,先采用分析液相考察在1.2.1色谱条件梯度下保留此时间段的分离度。检测结果表明,20~26 min时段内组分较为集中,分离度较小。虽然半制备结果表明主要含有5个活性组分,但是LC-MS检测结果表明20~26 min时段内含有较多的化合物(图2),这可能和分析柱的柱效较高有关。本试验半制备的色谱柱粒径10 μm,而分析液相色谱柱的粒径为3.5 μm,柱效(理论塔板数)远高于半制备色谱柱[3]。因而在分析条件下,更能清晰的检测出相同时间段所有组分。这些化合物的紫外最大吸收值较为接近,均在230、290、345 nm左右,由此判断,可能是同系物或者类似物。因为这些化合物均集中在20~26 min时段内,此段化合物属于中等偏弱极性化合物。对此较为集中且组分较多的样品分离纯化,先采用梯度1条件,每个峰均收集。然后根据梯度1的保留时间段流动相配比,设计出梯度2[4],将这些收集到的组分再进一步分离纯化,得到了5个纯度较高的化合物,这些化合物的理化性质见表2。
2.3 真菌SF-21483发酵提取物中的各活性组分LC-MS归属
将得到的5个化合物分别称量1 mg溶于1 mL甲醇中,于LC-MS上进样5 μL,测定各个组分的分子离子峰(表3)。由表3可知,这5个活性组分的分子离子峰分别为4(462.2)、5(402.2)、7(404.2)、9(406.2)、10(433.3)。紫外吸收光谱也较为接近,最大吸收值分别在230、290、345左右。对比这些化合物紫外吸收光谱、相对分子质量、物理性状、来源及生物活性,经过查询天然产物化合物词典(DNP)和文献,初步推断4、5、7、9、10这5个组分与冬青生菌素较为接近[5-7]。冬青生菌素是由真菌Cylinddrocladium ilicicola MFC-870产生的抗生素[8,9],含有A、B、C、D、E、F、G和H等8个组分。相对分子质量分别为A 390、B 356、C 406、 D 404、E 402、F 462、G 404、H 433,最大紫外吸收值分别为A :230、296、344,B: 233、 296、 340,C: 230、295、347, D: 240、250、292、346,E: 240、 290、346,F: 240、294、348,G:230、295、349, H: 248、349。而4、5、7、9、10这5个活性组分是由真菌菌株SF-21483产生,分子离子峰分别为4(462.2)、5(402.2)、7(404.2)、9(406.2)、10(433.3)。紫外吸收值也较为接近:4(242、292、337)、5(236、291、337)、7(237、298、338)、9(230、292、348)、10(245、347)。物理性状分别为4(淡黄色结晶)、5(淡黄色结晶)、7(淡黄色结晶)、9(黄色针状结晶)、10(黄色针状结晶)。结果表明,5个组分均具有一定的抗真菌活性。由此判断,活性组分4为冬青生菌素F(Ilicicolin F)、活性组分5为冬青生菌素E(Ilicicolin E)、活性组分7为冬青生菌素D(Ilicicolin D)、活性组分9为冬青生菌素C(Ilicicolin C)、活性组分10为冬青生菌素H(Ilicicolin H)。
2.4 SF-21483发酵提取物中各活性组分的抑菌活性
将SF-21483发酵提取物分离纯化得到的这5个活性组分分别在5个真菌病原菌靶标下的1.0、0.3、0.1 mg/mL浓度下进行生物活性测试,结果表明,这些活性组分均具有一定的抑制植物病原真菌的作用(表4)。由表4可知,活性组分4仅在1.0 mg/mL浓度下有活性;活性组分4在3个浓度下均对小麦颖枯、立枯丝核菌均有较强的抑制作用;活性组分5的活性最强,在3个浓度下对其中的3个靶标均具有较强的活性;活性组分9对小麦颖枯、番茄早疫在3个浓度下有较强的活性;活性组分10对葡萄灰霉、番茄早疫、立枯丝核具有一定的抑制作用。
3 小结与讨论
本试验从SF-21483的发酵提取物中分离得到的组分4、5、7、9、10与化合物冬青生菌素(Ilicicolins)相似,具有较强抗真菌作用。文献研究多集中在Ilicicolin H,它是2-吡啶酮类化合物。体外抗菌活性研究表明,该化合物抑制炭疽杆菌(Bacillus anthracis)的剂量为6 mg/mL[8]。其作用机制在最近才被阐明,在酵母中作用于线粒体, 抑制呼吸链中泛醌位点[10]。目前该类化合物的研究主要集中在抗菌机理上,在农药应用方面的研究很少报道。本试验主要是从真菌SF-21483的次生代谢产物应用于植物病原菌的防治上进行了研究,为真菌SF-21483在农业上的应用做了初步的探讨。
参考文献:
[1] B?魪RDY J. Bioactive microbial metabolites[J]. J Antibiot,2005, 58(1):1-26.
[2] 朱昌雄,蒋细良,姬军红,等.我国生物农药的研究进展及对未来发展建议[J].现代化工,2003,23(7):1-4.
[3] 刘国诠,于兆楼.色谱柱技术[M].第二版.北京:化学工业出版社,2005.
[4] 张亚妮,王开梅,张志刚,等.放线菌菌株WS-13182产生的活性物质的分离纯化[J].湖南农业科学,2009(11):33-36.
[5] GUTI?魪RREZ M,THEODULOZ C,RODR?魱QUEZ J,et al. Bioactive metabolites from the fungus Nectria galligena, the main apple canker agent in Chile[J]. J Agric Food Chem,2005,53(20):7701-7708.
[6] SINGH S B, LIU W G, LI X H, et al. Antifungal spectrum, in vivo efficacy, and structure-activity relationship of ilicicolin h[J].ACS medicinal chemistry letters,2012,3(10):814-817.
[7] 邵志宇,冯永红,邓云霞,等.互花米草内生真菌Fusarium sp.F4中的活性代谢物[J].中国天然药物,2007,5(2):108-111.
[8] HAYAKAWA S,MINATO H,KATAGIRI K. The ilicicolins, antibiotics from Cylindrocladium ilicicola[J]. J Antibiot,1971,24(9):653-654.
[9] MINATO H,KATAYAMA T,HAYAKAWA S. Identification of ilicicolins with ascochlorin and LL-Z1272[J]. J Antibiot,1972, 25(5):315-316.
[10] GUTIERREZ-CIRLOS E B,MERBITZ-ZAHRADNIK T,TRUMPOWER B L. Inhibition of the yeast cytochrome bc1 complex by ilicicolin H, a novel inhibi tor that acts at the qn sit e of the bc1 complex[J]. J Biol Chem,2004,279(10):8708-8714.
