汉中市兴元湖纤毛虫群落结构与水质评价
2015-10-09刘智峰
刘智峰


摘要:2014年3~5月,利用PFU法对汉中市兴元湖水中纤毛虫群落进行调查,从3个采样点共观察到56种纤毛虫,隶属1门,3纲,11目,32属。优势种为纵长板壳虫(Coleps elonqatus)、钝漫游虫(Litonotus obtusus)、钩刺斜管虫(Chilodonella uncinata)、珍珠映毛虫(Cinetochilum margaritaceum)、沟钟虫(Vorticella convallaria)、尾瘦尾虫(Uroleptus candatus)、伪尖毛虫(Oxyticha fallax)、阔口游仆虫(Euplotes eurystomus)。通过计算水体纤毛虫的多样性指数,大小关系为3号采样点<1号采样点<2号采样点。水质评价结果,1号采样点属于β-中污型,2号采样点属于寡污型,3号采样点属于α-中污型。
关键词:PFU法;纤毛虫;群落结构;水质评价;
中图分类号:Q959.117;X824 文献标识码:A 文章编号:0439-8114(2015)17-4159-05
DOI:10.14088/j.cnki.issn0439-8114.2015.17.013
纤毛虫是自然水域重要的生态类群,它们的个体微小、结构简单,比表面积越大,对环境变化反应越敏感,与较高等生物比较,纤毛虫对环境污染具有更短、更迅速的响应,是一种非常有效的指示生物[1]。同时,在水生生态系统中,作为捕食者和被捕食者的纤毛虫在物质循环和能量流动过程中扮演了十分重要的角色,它们通过对有机颗粒物、细菌和藻类的摄食和吸收,直接将能量进行转化,使较复杂的物质转化成较简单的成分并得以在水环境中再循环[2]。因此,研究纤毛虫的生物多样性及其空间分布格局,有助于了解水体食物网的物质循环和能量流动过程。
本研究以生物监测理论为原理,分析兴元湖水体中纤毛虫的物种组成、优势种类、丰度等群落结构参数,评价其水质,阐释纤毛虫群落结构与水质之间的关系,为该水体的环境治理提供理论依据。
1 样点设置与研究方法
1.1 样点概况
兴元湖是1982年开始在原八里桥水库的基础上建设而成的综合性城市休闲公园,是集灌溉、养鱼、旅游为一体的综合性公园,水面面积22万m2。它是汉中市重点旅游景区,湖周围没有工厂排污,水质较好。该湖的主要污染源为周边村民的农田农业退水和游人带入的生活垃圾。
1.2 样点设置
依据兴元湖水体功能不同,设置3个采样点(图1),1号为兴元湖鱼塘区,2号为兴元湖观赏区,3号为兴元湖娱乐区。用PFU法每月采样1次,连续监测3个月。
1.3 样品采集
按照国家标准《水质微型生物群落监测——PFU法》(GB/T 12990-91),在每个采样点设置1组纤毛虫群落群集所需的孔径为100~150 μm的聚氨酯泡沫塑料块(polyurethane foamunit,PFU),切割成5.0 cm×6.50 cm×7 cm大小,先用自来水冲洗,再用蒸馏水浸泡12~24 h备用[3]。2014年3~5月份每月月初放样1次,在各采样点水面下约10 cm处悬挂2~3块PFU,7 d后回收。样品用食品塑料袋包装后带回实验室在显微镜下进行活体制片观察、种类鉴定及计数、PFU块的放置、收集以及纤毛虫样品的观察、计数等均参照此国家标准。
1.4 定性、定量方法
定性研究采取显微镜下活体观察法,分类系统采用Levine等[4]的分类法进行,种类鉴定参考《微生物监测新技术》[5-8]中的物种特征表述和图谱。
定量研究采取直接记数法。即先用1 mL定量吸管标定每毫升水滴数m,然后将水样摇匀,用定量吸管吸取1 mL,滴一滴在载玻片上,盖上盖玻片在10×20的放大倍数下按从上至下或从左至右的顺序一个一个视野不重复的把整个1滴水样观察完,得到每滴水样中的个体数n。用下列公式换算成1 L水中的个体数量(ind/L):N=n×m×1 000[9]。本试验中,每升水样随机取5个1 mL,每毫升观察3滴,取平均值。
1.5 优势种的确定
根据纤毛虫出现的不同频次统计各物种的多少,用“++++”(>10 000个/L)、“+++”(1 000~10 000个/L)、“++”(100~1 000个/L)、“+”(<100个/L)来表示。出现频次最高的物种定义为优势种[10]。
1.6 多样性指数计算
多样性指数d值按Margalef多样性指数公式计算:
d=(S-1)/lnN
式中S表示样品中种类数,N表示样品中个体总数。根据这一指数的计算公式,指数越高,表示污染越轻,指数越低表示污染越重。
评价标准分为5个等级:0-1为多污型,1-2为α-中污型,2-3为β-寡污型,3-4为寡污型,>4为清洁水体[11]。
2 结果与分析
2.1 环境因子
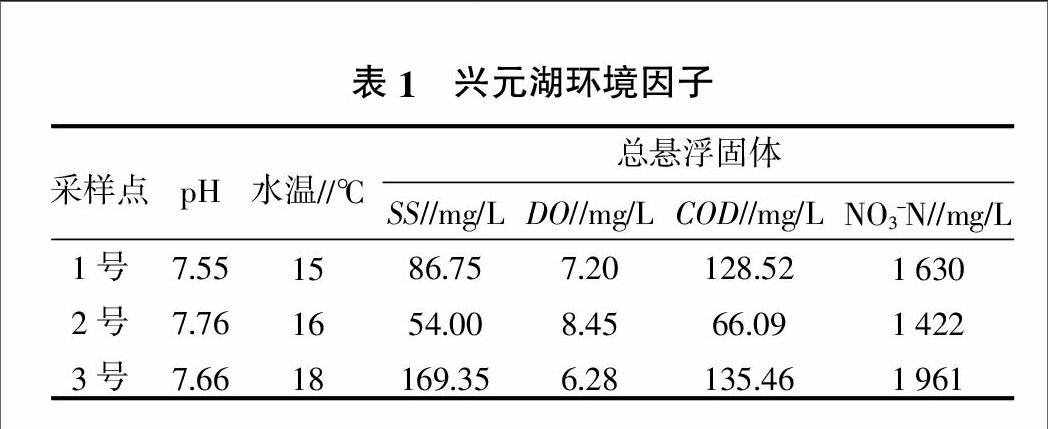
2014年3~5月,每月采集水样测定pH、SS、COD,3个月份的平均值列于表1,测定方法参照《水和废水监测分析方法(第四版)》(2002)中方法进行[12]。测定指标主要有水温(温度计测定),pH值(PHS-3C型pH计测定),COD(重铬酸钾法测定),DO(碘量法测定), NO3-N(酚二磺酸分光光度法测定)。
由表1可看出,pH基本在7.5~7.8之间,约为中性,达到标准要求。SS、COD 3号采样点最高,其次是1号采样点,2号采样点最低。原因是3号采样点属娱乐区,游人在游玩的过程中带入较多生活垃圾,使得有机污染最为严重;1号采样点属养殖区,由于投放饲料使得这一区域的SS、DO、COD也较高;2号采样点为观赏区,水生植物较为丰富,外界污染物进入较少,COD、SS相对较小。
2.2 物种组成与分布
在对兴元湖水体进行为期3个月的研究中,共观察到纤毛虫56种,隶属于3纲11目26科32属。其中,动基片纲(Kinetofragminophorea)24种,占42.86%,寡膜纲(Oligohymenophorea)17种,占30.36%,多膜纲(Polyhymenophorea)15种,占26.79%。从物种分布来看(表2),2号采样点43种纤毛虫,物种最为丰富,1号采样点34种,位居其次,3号采样点种27种,物种最少。
2.3 优势类群与优势种
鉴定到的56种纤毛虫,从各类群优势度来看(表3),下毛目种类最多,为优势类群,优势度为21.43%。前口目为次优势类群,优势度为16.07%。吸管虫目、肾形目为偶见类群,优势度都为1.79%。其余为常见类群。下毛目成为优势类群一方面反映出其在水体中数量丰富,另一方面与采样方式有关,采用PFU海绵块,它是一个多孔的富集基质,有利于棘毛比较发达的下毛目在海绵块中“爬行”。
从各物种的相对丰度来看(表2),兴元湖水体纤毛虫的优势种主要有:纵长板壳虫(Coleps elonqatus)、钝漫游虫(Litonotus obtusus)钩刺斜管虫(Chilodonella uncinata)、珍珠映毛虫(Cinetochilum margaritaceum)、沟钟虫(Vorticella convallaria)、尾瘦尾虫(Uroleptus candatus)、伪尖毛虫(Oxyticha fallax)、阔口游仆虫(Euplotes eurystomus)。
2.4 多样性指数
根据定量方法计算出各采样点3个月纤毛虫的平均丰度,再计算出多样性指数,列于表4。
从表4可以看出,多样性指数大小关系为:3号采样点<1号采样点<2号采样点。水质评价结果为:2号采样点属于寡污型,水质最好;1号采样点属于β-中污型,水质次之;3号采样点属于α-中污型,水质最差。这与同期环境因子监测结果(表1)相一致。
多样性指数是群落演替的一个重要指标,某一群落种类多样性指数越高,表明该群落结构复杂,稳定性好,而当生物生存环境受到胁迫时敏感种类大量消失,多样性指数明显下降。因而群落多样性的变化是生物生存环境发生变化的重要标志[13]。1号采样点属于鱼塘区,建有多个网箱养鱼场,人为投放饲料,使得该水域中营养较为丰富,纤毛虫数量在3个采样点中最高,水质处于β-中污型。主要污染物来自于养鱼饲料和鱼类排放的粪便等有机物。3号采样点属于娱乐区,游人向水体投入大量的生活垃圾,游艇排放的油类污染物,使得该区域水质在3个采样点中最差。从物种看,耐污型纵长毛板壳虫、珍珠映毛虫、尾瘦尾虫、伪尖毛虫在3号采样点呈现出优势分布。2号采样点属于观赏区,水体中种植大量荷花、芦苇等水生植物,其根系吸收水体中的氮磷污染物,加速了水体有机污染物质的分解转化,同时释放出氧气,补充水体溶解氧,起到了良好的净化水质作用,因此该采样点拥有最丰富的物种。本研究中的偶见种,如粘液瓶口虫卑怯管叶虫、修饰篮口虫、大口薄咽虫、冠帆口虫、小旋口虫,大都出现在2号采样点,这是清洁水体的寡污型指示物种。
3 小结
1)对兴元湖水体纤毛虫的研究结果表明,在3个采样点共观察到纤毛虫56种,隶属3纲11目26科32属。其中动基片纲24种,寡膜纲17种,多膜纲15种。
2)兴元湖水体纤毛虫的优势种主要有纵长板壳虫(Coleps elonqatus)、钝漫游虫(Litonotus obtusus)、钩刺斜管虫(Chilodonella uncinata)、珍珠映毛虫(Cinetochilum margaritaceum)、沟钟虫(Vorticella convallaria)、尾瘦尾虫(Uroleptus candatus)、伪尖毛虫(Oxyticha fallax)、阔口游仆虫(Euplotes eurystomus)。
3)兴元湖水体纤毛虫的多样性指数大小关系为3号采样点<1号采样点<2号采样点。水质评价结果为2号采样点属于寡污型,水质最好;1号采样点属于β-中污型,水质次之;3号采样点属于α-中污型,水质最差。
参考文献:
[1] ZINGEL P, PAAVER T, KARUS K, et al. Ciliates as the crucial food source of larval fish in a shallow eutrophic lake[J]. Limnology and Oceanography,2012,57(4):1049-1056.
[2] CHEN M,CHEN F,YU Y, et al. Kong F. Genetic diversity of eukaryotic microorganisms in Lake Taihu,a large shallow subtropical lake in China[J]. Microbial Ecology, 2008, 56(3):572-583.
[3] Xu M Q. A study on applying PFU protozoan community to monitor the self-purification effectiveness of the Beijing wastewater canal[J]. Acta Ecologica Sinica, 1991, 11(1):80-85.
[4] LEVINE C N D,CORLISS J O, COX F E G,et al. A newly revised classification of the Protozoa[J]. Journal of Protozoology, 1980,27:37-58.
[5] 沈温芬.微型生物监测新技术[M].北京:中国建筑工业出版社,1990.
[6] 蒋燮治,沈韫芬,龚循矩.西藏水生无脊椎动物[M].北京:科学出版社,1983:39-334.
[7] FOISSNER W,BERGER H,SCHAUMBURG J.Identification and Ecology of Limnetic Plankton Ciliates[M]. Mfinchen: Bartels & Wernitz,1999.
[8] 沈韫芬.原生动物学[M].北京:科学出版社,1999:139-223.
[9] 饶钦止.湖泊调查基本知识[M].北京:科学出版社,1956,295-298.
[10] 宁应之,王 娟,刘 娜,等.甘肃天水麦积山风景名胜区土壤纤毛虫的物种多样性[J].动物学研究,2007(4):367-373.
[11] MARGALEF R. Diversity and Stability in Ecological Systems [M]. Upton, N. Y.(USA): Biology Department of Brookhaven National Laboratory, 1969.
[12] 奚旦立,孙裕生,刘秀英.环境监测[M].北京:高等教育出版社,2007.
[13] XU M Q, ZHAI J J, SHAO Y Y. Water quality in Beijing Tonghui River, using PFU protozoan communities as indicators[J]. Chinese Journalof Zoology,1998, 33(40):1-7.
